Réaction de Barbier
La réaction de Barbier est une réaction organique entre un halogénure d'alkyle et un groupe carbonyle (utilisé comme électrophile), en présence d'un métal (magnésium, aluminium, zinc, indium, étain ou leurs sels) utilisé pour générer l'espère nucléophile in situ. Cette réaction permet la synthèse d'alcools primaires, secondaires ou tertiaires. La réaction de Barbier est similaire à une réaction de Grignard, à la différence que la réaction de Barbier est réalisée en un seul pot tandis que le réactif de Grignard doit être préparé séparément avant l'addition du composé carbonylé[1]
Les nucléophiles utilisés pour les réactions de Barbier sont générés à partir de métaux (ou leurs composés) relativement peu chers et peu sensibles à l'eau, contrairement aux réactifs de Grignard ou aux organolithiens. Pour cette raison, il est possible dans de nombreux cas d'exécuter la réaction dans l'eau ce qui est compatible avec les objectifs de la chimie verte. La réaction de Barbier est ainsi nommée d'après Philippe Barbier, le directeur de thèse de Victor Grignard.
Exemples de réactions de Barbier
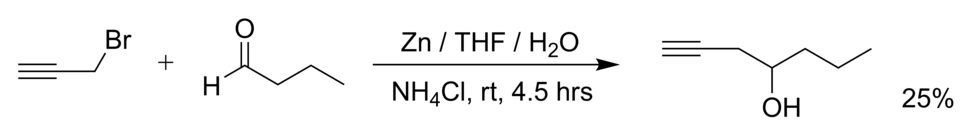
- La réaction du bromure de propargyle (3-bromopropyne) et du butanal avec du zinc métallique dans l'eau[2] :
- La réaction de Babier intramoléculaire avec de l'iodure de samarium(II)[3]:
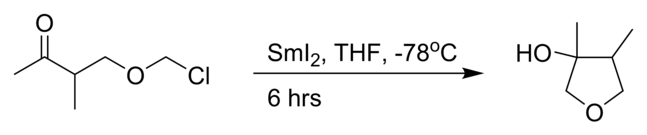 Réaction de Barbier intramoléculaire avec l'iodure de samarium.
Réaction de Barbier intramoléculaire avec l'iodure de samarium.
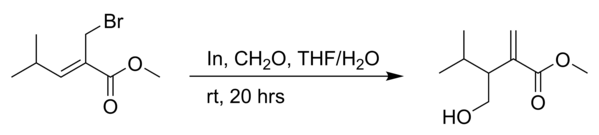 Cette réaction de Babier est accompagnée d'un réarrangement allylique vers un alcène terminal.
Cette réaction de Babier est accompagnée d'un réarrangement allylique vers un alcène terminal.
- Un autre bromure allylique dans une réaction avec le benzaldéhyde et de la poudre de zinc dans l'eau[5] :
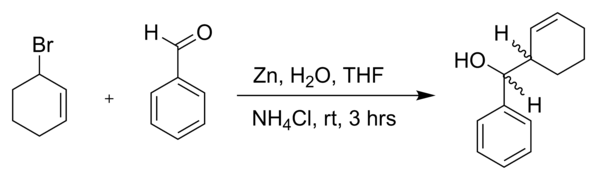 La diastéréosélectivité observée pour cette réaction est érythro : thréo = 83 : 17.
La diastéréosélectivité observée pour cette réaction est érythro : thréo = 83 : 17.
Réactions apparentées
- Réaction de Grignard
- Réaction de Nozaki-Hiyama-Kishi (en)
Références
- P. Barbier, « Synthèse du diéthylhepténol », C. r. hebd. séances Acad. sci., vol. 128, , p. 110-111 (lire en ligne).
- (en) A. Jõgi et U. Mäeorg, « Zn Mediated Regioselective Barbier Reaction of Propargylic Bromides in THF/aq. NH4Cl Solution », Molecules, vol. 6, no 12, , p. 964-968 (ISSN 1420-3049, DOI 10.3390/61200964, lire en ligne).
- (en) T. Skjæret et T. Benneche, « Preparation of oxo-substituted α-chloro ethers and their reaction with samarium diiodide », ARKIVOC, no 10, , p. 16-25 (ISSN 1551-7004, lire en ligne).
- (en) G. D. Bennett et L. A. Paquette, « Methyl 3-(hydroxymethyl)-4-methyl-2-methylenepentanoate », Org. Synth., vol. 77, , p. 107 (ISSN 0078-6209, DOI 10.15227/orgsyn.077.0107).
- (en) G. W. Breton, J. H. Shugart et al., « Use of Cyclic Allylic Bromides in the Zinc–Mediated Aqueous Barbier–Grignard Reaction », Molecules, vol. 6, no 8, , p. 655–662 (ISSN 1420-3049, DOI 10.3390/60800655, lire en ligne).