Iodure de samarium(II)
L'iodure de samarium(II), SmI2, est un solide vert composé de samarium et d'iode qui fond à 520 °C et dans lequel les atomes de samarium ont une sphère de coordination à 7 voisins dans une configuration octaèdre cappé[3]. Il peut être formé par décomposition à haute température de SmI3 qui est l'iodure de samarium le plus stable[4] - [5] - [6] mais une préparation de laboratoire plus commode est de faire réagit de la poudre de samarium avec le 1,2-diiodoéthane dans le THF anhydre[7] :
- Sm + ICH2CH2I → SmI2 + C2H4
| Iodure de samarium(II) | |
samarium(II)-3D-balls.png.webp)
| |
| Complexe de SmI2 et du THF : SmI2(THF)5 | |
| Identification | |
|---|---|
| Nom UICPA | iodure de samarium(II) |
| No CAS | [1] |
| PubChem | 141689 |
| SMILES | |
| Apparence | poudre verte |
| Propriétés chimiques | |
| Formule | SmI2 |
| Masse molaire[2] | 404,17 ± 0,02 g/mol I 62,8 %, Sm 37,2 %, |
| Propriétés physiques | |
| T° fusion | 840 °C |
| Point d’éclair | ininflammable |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le diiodométhane (CH2I2) peut être aussi utilisé. SmI2 est aussi disponible commercialement sous forme d'une solution bleu foncé 0,1 M dans le THF[8]
L'iodure de samarium est un réducteur puissant. Par exemple, il réduit rapidement l'eau en hydrogène[3].
Réactions
L'iodure de samarium(II) est devenu un réactif commun pour la formation de liaison carbone-carbone, par exemple avec une réaction de Barbier (similaire à une réaction de Grignard) entre une cétone et un halogénure d'alkyle pour former un alcool tertiaire[9] :
- R1X + R2COR3 → R1R2C(OH)R3

Les protocoles réactionnels typiques utilisent SmI2 dans le THF en présence d'iodure de nickel(II) (NiI2) en quantité catalytique.
Les esters réagissent similairement (ajout de deux groupes R) mais les aldéhydes forment des sous-produits. Cette réaction est commode du fait qu'elle est souvent très rapide (cinq minutes ou moins à froid). Bien que l'iodure de samarium(II) soit considéré comme un puissant réducteur à un électron, Il n'affiche pas une remarquable chimiosélectivité entre groupes fonctionnels. Par exemple, les sulfones et les sulfoxydes peuvent être réduits en le sulfure correspondant en présence de nombreux autres groupes carbonylés tels que esters, cétones, amides, aldéhydes, etc., la réaction sur les doubles liaisons C=O étant considérablement plus lente que celle sur les liaisons S=O. Par ailleurs, l'hydrodéshalogénation d'halogénures d'alkyle en l'hydrocarbure correspondant peut être aussi réalisée avec SmI2. Ces réactions peuvent être suivies par le changement de couleur du bleu foncé du SmI2 en solution dans le THF à un jaune pâle quand la réaction s'est produite. En fait, la couleur foncée disparaît immédiatement après le contact avec le mélange de la réaction de Barbier comme on peut le voir sur l'image ci-contre.
Le mélange réactionnel est ensuite traité avec de l'acide chlorhydrique dilué et le samarium est évacué sous forme d'ions Sm3+ aqueux.
Les composés carbonyle peuvent aussi être couplés avec de simples alcènes pour former des cycles à 5, 6 ou 8 atomes[10].
Les groupes tosyle peuvent être retirés presque instantanément des N-tosylamides et des esters tosylate en utilisant SmI2 en association à une base. Cette réaction est même effective pour la synthèse d'amines sensibles comme les aziridines[11] :
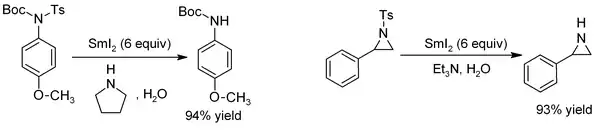 Retraits du groupe tosyle de N-tosylamides en utilisant SmI2
Retraits du groupe tosyle de N-tosylamides en utilisant SmI2
Dans la désoxygénation de Markó-Lam, un alcool peut être quasi instantanément désoxygéné par réduction de son ester toluate en présence de SmI2 :
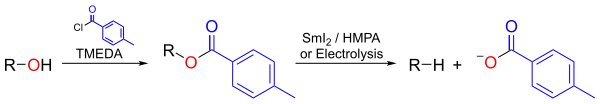 Désoxygénation de Markó-Lam utilisant SmI2
Désoxygénation de Markó-Lam utilisant SmI2
Les applications de l'iodure de samarium(II) ont fait l'objet d'articles de revue[12] - [13] - [14].
Notes
- Iodure de samarium(II) sur sigmaaldrich.com
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, (ISBN 0-7506-3365-4).
- G. Jantsch, N. Skalla, Zur Kenntnis der Halogenide der seltenen Erden. IV. – Über Samarium(II)jodid und den thermischen Abbau des Samarium(III)jodids, Zeitschrift für Allgemeine und Anorganische Chemie, 1930, 193, 391–405. DOI 10.1002/zaac.19301930132.
- G. Jantsch, Thermischer Abbau von seltenen Erd(III)halogeniden, Die Naturwissenschaften, 1930, 18(7), 155–155. DOI 10.1007/BF01501667.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 39, Band C 6, S. 192–194.
- P. Girard, J. L. Namy and H. B. Kagan, Divalent Lanthanide Derivatives in Organic Synthesis. 1. Mild Preparation of SmI2 and YbI2 and Their Use as Reducing or Coupling Agents, J. Am. Chem. Soc., 1980, vol. 102(8), pp. 2693–2698. DOI 10.1021/ja00528a029.
- Samarium(II) iodide 0.1 M in tetrahydrofuran sur sigmaaldrich.com
- Fouzia Machrouhi, Béatrice Hamann, Jean-Louis Namy, Henri B. Kagan, Improved Reactivity of Diiodosamarium by Catalysis with Transition Metal Salts, Synlett, 1996, vol. 1996(7), pp. 633–634. DOI 10.1055/s-1996-5547.
- G. A. Molander, J. A. McKiie, Samarium(II) iodide-induced reductive cyclization of unactivated olefinic ketones. Sequential radical cyclization/intermolecular nucleophilic addition and substitution reactions, J. Org. Chem., 1992, vol. 57, pp. 3132–3139. DOI 10.1021/jo00037a033
- Tobias Ankner, Göran Hilmersson, Instantaneous Deprotection of Tosylamides and Esters with SmI2/Amine/Water, Organic Letters, 2009, vol. 11, pp. 503–506. DOI 10.1021/ol802243d.
- Patrick G. Steel, Recent developments in lanthanide mediated organic synthesis, J. Chem. Soc., Perkin Trans. 1, 2001, pp. 2727–2751. DOI 10.1039/a908189e
- G. A. Molander, C. R. Harris, Sequencing Reactions with Samarium(II) Iodide, Chem. Rev., 1996, vol. 96, pp. 307–338. DOI 10.1021/cr950019y
- K. C. Nicolaou, Shelby P. Ellery, Jason S. Chen, Samarium Diiodide Mediated Reactions in Total Synthesis, Angew. Chem. Int. Ed., 2009, vol. 48(39), pp. 7140-7165. DOI 10.1002/anie.200902151
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Samarium(II) iodide » (voir la liste des auteurs).