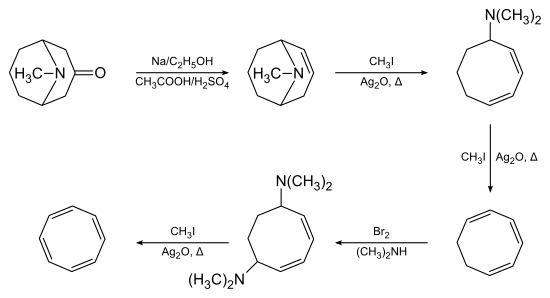
Cyclooctatétraène
| Cyclooctatétraène | |||
   |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | cycloocta-1,3,5,7-tétraène | ||
| Synonymes |
COT, [8]annulène |
||
| No CAS | |||
| No ECHA | 100.010.074 | ||
| No CE | 211-080-3 | ||
| PubChem | 637866 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaune pâle (indice de réfraction : 1,537) | ||
| Propriétés chimiques | |||
| Formule | C8H8 [Isomères] |
||
| Masse molaire[1] | 104,149 1 ± 0,007 g/mol C 92,26 %, H 7,74 %, |
||
| Susceptibilité magnétique | 53,9×10-6 cm3·mol-1[2] | ||
| Propriétés physiques | |||
| T° fusion | −5-−3 °C[3] - [4] - [5] | ||
| T° ébullition | 142-143 °C[3] - [5] | ||
| Solubilité | 77,3 mg·l-1 [4] | ||
| Masse volumique | 0,925 0 g·cm-3, liquide à 20 °C[3] 0,925 g·cm-3 à 25 °C[5] |
||
| Point d’éclair | 22 °C (coupelle fermée)[5] | ||
| Pression de vapeur saturante | 7,8 mmHg à 25 °C[4] | ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,537[5] | ||
| Précautions | |||
| SGH[5] | |||
   |
|||
| SIMDUT[6] | |||
 B2, |
|||
| NFPA 704 | |||
| Transport[5] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Cependant, contrairement au benzène C6H6, le cyclooctatétraène C8H8 n'est pas aromatique, mais il n'est pas non plus anti-aromatique. Sa réactivité est caractéristique d'un polyène ordinaire, c'est-à-dire qu'il suit des réactions d'addition. En revanche, le benzène, aromatique, suit caractéristiquement des réactions de substitution, pas d'addition.
Histoire
Le 1,3,5,7-cyclooctatétraène a été originellement synthétisé par Richard Willstätter à Munich en 1905[7] - [8].
Richard Willstätter nota que ce composé ne montrait pas l'aromaticité attendue. Entre 1939 et 1943, les chimistes américains ont essayé sans succès de synthétiser COT. Ils ont rationalisé leur manque de succès en concluant que R. Willstätter n'avait pas vraiment synthétisé ce composé mais plutôt le styrène, un isomère C8H8. R. Willstätter a répondu à ces contestations dans son autobiographie, où il a noté que les chimistes américains n'ont pas tenu compte ni été dérangés par le cyclooctane qu'il avait obtenu par réduction de son cyclooctatétraène (un produit de réaction impossible avec le styrène). En 1947, Walter Reppe à Ludwigshafen a enfin réussi à reproduire la synthèse de R. Willstätter[9].
Structure et liaison
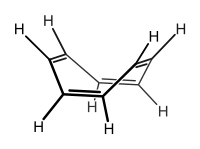
Synthèse et chimie
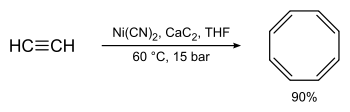
La synthèse originale de R. Willstätter qui nécessite 4 réactions d'élimination sur une structure cyclooctane, donne un rendement relativement bas. La synthèse de Walter Reppe du cyclooctatétraène qui implique de traiter de l'éthyne (acétylène) sous haute pression avec une mélange chaud de cyanure de nickel et de carbure de calcium, est bien meilleure avec un rendement proche de 90 %[9].
Parce que le COT est instable et forme facilement des peroxydes organiques explosifs, une petite quantité d'hydroquinone est habituellement ajoutée au composé commercialement accessible. Il est conseillé de tester les peroxydes avant d'utiliser une bouteille déjà ouverte auparavant. Des cristaux blancs autour du col de la bouteille peuvent être composés de peroxydes qui peuvent exploser quand ils sont sollicités mécaniquement.
Les liaisons π dans le cyclooctatétraène réagissent comme d'habitude pour des oléfines et non comme celles d'un cycle aromatique. Le mono et les poly-époxydes peut être générés en faisant réagir COT avec des acides peroxydés ou avec le diméthyldioxirane. Diverses autres réactions d'addition sont aussi connues. En outre, un polyacétylène stable a été synthétisé via la polymérisation par ouverture de cycle d'un cyclooctatétraène alkyl-substitué[14]. COT, lui-même, et aussi des dérivés avec de chaînes latérales ont été utilisés comme ligand en particulier pour les complexes sandwich en chimie organométallique.
L'anion cyclooctatétraénure

L'anion cyclooctatétraènure est le dianion dérivé du cyclooctatétraène. Il est plan et aromatique, et se lie facilement aux métaux.
Occurrence naturelle
Le cyclooctatétraène a été isolé dans certains Mycota (Fungi, champignons)[15].Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cyclooctatetraene » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », Journal of the American Chemical Society, vol. 91, no 8, , p. 1991-1998
- C8H8 sur Chemical BooK
- C8H8 sur ChemIDplus
- Fiche Sigma-Aldrich du composé Cyclooctatetraene 98%, consultée le 15/10/2016. + [PDF] Fiche MSDS
- « Cyclooctatétraène-1,3,5,7 » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- The Science and Humanism of Linus Pauling (1901-1994)',Mason, S.; Chemical Society Reviews; Fev.1997, 26, 1.
- Über Cyclo-octatetraen, Richard Willstätter, Ernst Waser; Berichte der deutschen chemischen Gesellschaft, 1911, 44(3), pp 3423–3445. DOI 10.1002/cber.191104403216
- Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen; Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel; Justus Liebigs Annalen der Chemie; 1948, 560(1), pp 1–92. DOI 10.1002/jlac.19485600102
- Johnson, A.W.. Sci. Progress;1947, 506, 35.
- The ‘Octa-Benzene’, Cyclo-octatetraene (C8H8, Bastiensen O., Hassel O., Langseth A.; Nature; 1947, 160(4056), p 128. DOI 10.1038/160128a0
- Structure of Cyclo-octatetraene, Kaufman, H. S.; Fankuchen, I.; Mark, H.; Nature, 1948, 161(4083), p 165. DOI 10.1038/161165a0
- High resolution Raman spectroscopy of gases with laser sources. XIII - the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene, Thomas, P. M.; Weber, A.; Journal of Raman Spectroscopy, 1978, 7(6), pp 353-357. DOI 10.1002/jrs.1250070614
- (en) Brevet U.S. 5198153
- An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds; Stinson, M.; Ezra, D.; Hess, W. M.; Sears, J.; Strobel, G.; Plant Science, 2003, 165, pp. 913-922.DOI 10.1016/S0168-9452(03)00299-1