Hydroquinone
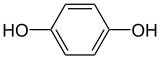
L'hydroquinone, aussi appelée benzène-1,4-diol, est un composé organique aromatique de la famille des polyphénols et des diphénols, de formule suivante C6H4(OH)2 et qui se présente sous une poudre solide dans les conditions normales de température et de pression.
| Hydroquinone | |||
| |||
| Formule semi-développée de l'hydroquinone | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | benzène-1,4-diol | ||
| Synonymes |
1,4-dihydroxybenzène, 1,4-dihydroxybenzol, eldoquin, chinol |
||
| No CAS | |||
| No ECHA | 100.004.199 | ||
| No CE | 204-617-8 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux incolores[1] | ||
| Propriétés chimiques | |||
| Formule | C6H6O2 [Isomères] |
||
| Masse molaire[2] | 110,110 6 ± 0,005 8 g/mol C 65,45 %, H 5,49 %, O 29,06 %, |
||
| Propriétés physiques | |||
| T° fusion | 172 °C[1] | ||
| T° ébullition | 286,5 °C[1] | ||
| Solubilité | dans l'eau à 15 °C : 59 g·l-1[1] | ||
| Masse volumique | 1,358 g·cm-3 [3] | ||
| T° d'auto-inflammation | 515 °C[1] | ||
| Point d’éclair | 165 °C[1] | ||
| Pression de vapeur saturante | à 20 °C : 0,12 Pa[1] | ||
| Thermochimie | |||
| Cp | |||
| Précautions | |||
| SGH[5] | |||
    Danger |
|||
| SIMDUT[6] | |||
 D1B, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[7] | |||
| Écotoxicologie | |||
| LogP | 0,59[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Sa structure comporte deux groupes hydroxyles liés à un noyau benzénique en position para.
Propriétés
L'hydroquinone est un agent réducteur.
Occurrences naturelles
Associé à du peroxyde d'hydrogène, l'hydroquinone est utilisée par le scarabée dit « bombardier » pour créer une solution explosive à haute température (100 °C). La solution est ensuite projetée sur ses prédateurs en tant que système défensif.
Extrait de la busserole (Arctostaphylos uva-ursi) ou d'autres plantes, l'arbutine est un β-glucoside d'hydroquinone utilisé en cosmétique comme dépigmentant par son action inhibitrice de la tyrosinase et en phytothérapie urinaire pour ses propriétés diurétiques et antibactériennes.
Utilisations
En médecine humaine, l'hydroquinone a été utilisée en application sur la peau pour en réduire la charge pigmentaire brune — donc éclaircir la peau. Du fait d'utilisations abusives[8], l'hydroquinone n'est maintenant disponible que sous forme de préparation magistrale prescrite par le dermatologue. Il n'y a plus en Europe (sauf en Suisse) depuis , de spécialités cosmétiques contenant de l'hydroquinone.
L'hydroquinone en solution aqueuse a de nombreuses utilisations principalement en raison de son action comme agent réducteur. C'est l'un des composants majeurs dans le développement photographique où, en présence de métol (ou 4-(méthylamino)phénol), elle réduit les sels d'argent exposés, invisibles, en argent métallique.
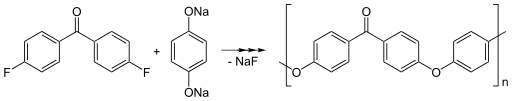
La réaction typique de synthèse du polyétheréthercétone (PEEK) inclut la 4,4'-difluorobenzophénone et le sel disodique de l'hydroquinone, qui est généré in situ par déprotonation avec le carbonate de sodium. La réaction se passe à environ 300 °C dans des solvants polaires aprotiques comme la diphénylsulfone[9] - [10].
En synthèse des polymères, elle sert aussi d'inhibiteur afin de prévenir une polymérisation prématurée du monomère, due par exemple au dioxygène de l'air (c'est un biradical qui peut amorcer la polymérisation[11].
Toxicité
Dans une perspective écologique, comme tous les produits de développement, l'hydroquinone est dangereuse pour les écosystèmes et notamment pour les eaux car elle est peu biodégradable et en partie toxique pour les poissons. Une fois utilisé, comme les huiles ou les piles usagées, ce produit doit être déposé dans une décharge spécialisée pour ne pas polluer l'environnement. Le révélateur peut faire l'objet d'un traitement thermique dans une installation chimique appropriée.
Notes et références
- HYDROQUINONE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 2, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-858-6)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Hydroquinone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Produits éclaircissants : conséquences et alternatives », sur Laboratoire In'oya
- David Parker, Jan Bussink, Hendrik T. van de Grampe, Gary W. Wheatley, Ernst-Ulrich Dorf, Edgar Ostlinning et Klaus Reinking, Polymers, High-Temperature, (ISBN 978-3527306732, DOI 10.1002/14356007.a21_449.pub3)
- (en) David Kemmish "Update on the Technology and Applications of PolyArylEtherKetones" 2010. (ISBN 978-1-84735-408-2).
- Chimie dans la maison, chapitre 23.
Voir aussi
Articles connexes
- Phénol
- Résorcine son isomére méta
- Pyrocatéchol son isomére ortho
Liens externes
- Fiche toxicologique de l'INRS
- (en) HYDROQUINONE International Occupational Safety and Health Information Centre (CIS)



