Uranium 238
L'uranium 238, noté 238U, est l'isotope de l'uranium dont le nombre de masse est égal à 238 : son noyau atomique compte 92 protons et 146 neutrons avec un spin 0+ pour une masse atomique de 238,050 79 u. Il est caractérisé par un excès de masse de 47 307,7 ± 1,5 keV et une énergie de liaison nucléaire par nucléon de 7 570,126 ± 0,006 keV[1]. Son abondance naturelle est de 99,2742 %, le reste de l'uranium naturel (0,7258 %) étant constitué d'uranium 235 (0,7202 %) et d'uranium 234 (0,0055 %).
| Présence naturelle | 99,2742(10) %[1] |
|---|---|
| Demi-vie | 4,468(6) × 109 années[1] |
| Produit de désintégration | 234Th |
| Masse atomique | 238,0507869(16) u |
| Spin | 0+ |
| Excès d'énergie | 47 307,7 ± 1,5 keV[1] |
| Énergie de liaison par nucléon | 7 570,126 ± 0,006 keV[1] |
L'uranium 238 est faiblement radioactif, avec une période de 4,468 8 milliards d'années (1,410 25 × 1017 s). Il se désintègre principalement en thorium 234 par radioactivité α (avec une énergie de désintégration de 4,270 MeV), et très minoritairement en plusieurs noyaux plus petits par fission spontanée. Un kilogramme d'uranium 238 présente ainsi une activité de 12,434 MBq (plus de douze millions de désintégrations par seconde), dont seulement 6,71 Bq (moins de sept dés./s) par fission spontanée.
L'uranium appauvri est constitué d'uranium 238 quasiment pur, tandis que l'uranium enrichi a une teneur supérieure en uranium 235. L'uranium retraité est également constitué essentiellement d'uranium 238, mais avec une proportion significative d'uranium 236 ainsi que, plus généralement, de tous les isotopes allant de l'uranium 232 à l'uranium 238 hormis l'uranium 237.
L'uranium 238 est un isotope fertile car il donne un isotope fissile — en l'occurrence, le plutonium 239 — par capture d'un neutron puis deux désintégrations β− successives avec des périodes de 1 407 secondes et 2,356 jours respectivement :
Cette réaction est mise en œuvre dans les réacteurs nucléaires ce qui permet de rendre fissile une partie de l'uranium 238 en le convertissant en plutonium 239 fissile. Ce procédé est spécialement utilisé dans les réacteurs surgénérateurs, conçus précisément pour générer leur propre combustible nucléaire fissile à partir de matériaux fertiles, l'uranium 235 étant naturellement fort peu abondant[3].
Chaîne de désintégration naturelle
Certains nucléides de la chaîne de désintégration principale de l'uranium 238 ont des modes de désintégration minoritaires, non représentés. La chaîne principale est[4] :
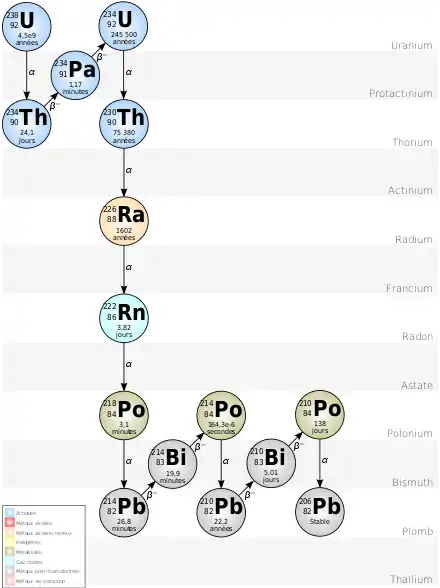
L'uranium 238 possède également d'autres modes de désintégration[5] : 5,45e–7 fissions spontanées et 2,2e–8 double désintégrations bêta par désintégration α.
Notes et références
-
(en) « Live Chart of Nuclides: 238
92U
146 », sur https://www-nds.iaea.org/, AIEA, (consulté le ). - (en) « Isotopes of Uranium: 238U », sur https://periodictable.com/ (consulté le ).
- La production de plutonium de qualité militaire en réacteur de puissance est très malcommode car le plutonium produit contient une trop forte proportion de plutonium 240. Le plutonium a usage militaire est produit en réacteurs dédiés dans lesquels le séjour du combustible cible est limité évitant la production des isotopes de rang supérieur à 239. cf, le rapport établi par l'office parlementaire d'évaluation des choix scientifiques et technologiques à l'occasion des discussions autour de la loi Bataille
- Guide pratique Radionucléides & radioprotection, D. Delacroix, J.P. Guerre et P. Leblanc.
- (en) « Isotope data for Uranium238 in the Periodic Table », sur www.periodictable.com (consulté le )
Voir aussi
Articles connexes
Lien externe
- Argonne National Laboratory Uranium
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
![{\displaystyle \mathrm {^{1}_{0}n+{}_{\ 92}^{238}U\to {}_{\ 92}^{239}U\ {\xrightarrow[{23,45\ min}]{\beta ^{-}\ 1,265\ MeV}}\ _{\ 93}^{239}Np\ {\xrightarrow[{2,3565\ jours}]{\beta ^{-}\ 0,722\ MeV}}\ _{\ 94}^{239}Pu} }](https://img.franco.wiki/i/bab5861eb0e821270ff2805ef5f0d01473f9c485.svg)
![{\displaystyle \mathrm {{}_{\ 92}^{238}U{\xrightarrow[{4,468\times 10^{9}\ a}]{\alpha }}{}_{\ 90}^{234}Th{\xrightarrow[{24,1\ j}]{\beta ^{-}\ }}{}_{\ 91}^{234m}Pa{\begin{Bmatrix}{{\xrightarrow[{1,17\ min}]{0,16\%}}{}_{\ 91}^{234}Pa{\xrightarrow[{6,7\ h}]{\beta ^{-}\ }}}\\{\xrightarrow[{1,17\ min}]{99,84\%\beta ^{-}\ }}\end{Bmatrix}}{}_{\ 92}^{234}U{\xrightarrow[{2,445\times 10^{5}\ a}]{\alpha }}{}_{\ 90}^{230}Th{\xrightarrow[{7,7\times 10^{4}\ a}]{\alpha }}{}_{\ 88}^{226}Ra{\xrightarrow[{1600\ a}]{\alpha }}{}_{\ 86}^{222}Rn} }](https://img.franco.wiki/i/a602fce8464be89e330fdbc086c5f3c5c1326336.svg)
![{\displaystyle \mathrm {{}_{\ 86}^{222}Rn{\xrightarrow[{3,8235\ j}]{\alpha }}{}_{\ 84}^{218}Po{\xrightarrow[{3,05\ min}]{\alpha }}{}_{\ 82}^{214}Pb{\xrightarrow[{26,8\ min}]{\beta ^{-}\ }}{}_{\ 83}^{214}Bi{\xrightarrow[{19,9\ min}]{\beta ^{-}\ }}{}_{\ 84}^{214}Po{\xrightarrow[{16,37\ ms}]{\alpha }}{}_{\ 82}^{210}Pb{\xrightarrow[{22,26\ a}]{\beta ^{-}\ }}{}_{\ 83}^{210}Bi{\xrightarrow[{5,013\ j}]{\beta ^{-}\ }}{}_{\ 84}^{210}Po{\xrightarrow[{138,38\ j}]{\alpha }}{}_{\ 82}^{206}Pb} }](https://img.franco.wiki/i/96b3be725fe6c334d5ad40908fd9fcb817d544aa.svg)