Polyéthylène
Le polyéthylène (sigle générique PE)[5], ou polyéthène, désigne les polymères d'éthylène. Simples et peu chers à fabriquer, les PE constituent la matière plastique la plus commune, représentant avec 100 millions de tonnes, environ un tiers de l'ensemble des plastiques produits en 2018[6] et la moitié des emballages.
| Polyéthylène | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | poly(méthylène) | |
| Synonymes |
polyéthène, |
|
| No CAS | ||
| No ECHA | 100.121.698 | |
| No E | E914 (cire de PE oxydée) | |
| SMILES | ||
| Apparence | solide de forme variable blanc[1] | |
| Propriétés chimiques | ||
| Formule | (C2H4)n | |
| Propriétés physiques | ||
| T° transition vitreuse | ~ −110 °C (transition γ) |
|
| T° fusion | 85 à 140 °C[1] | |
| Paramètre de solubilité δ | 16,2 MPa1/2[2] | |
| Masse volumique | 0,91–0,96 g·cm-3[1] | |
| T° d'auto-inflammation | 330 à 410 °C[1] | |
| Point d’éclair | 341 °C[1] | |
| Propriétés électroniques | ||
| Constante diélectrique | 2,3 (1 kHz, 23 °C)[3] | |
| Précautions | ||
| Classification du CIRC | ||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Le PE qui appartient à la famille des polyoléfines est un important polymère de synthèse de la pétrochimie avec le polypropylène (PP), le PVC et le polystyrène (PS). Sa température de transition vitreuse est très basse (voisine de −110 °C) et son point de fusion peut selon les grades atteindre 140 °C, mais sa résistance mécanique fléchit nettement dès 75 à 90 °C. Contrairement au polypropylène, la température d'utilisation ne peut excéder le point d'ébullition de l'eau. Sa nature paraffinique explique sa grande inertie chimique. Il existe différents types de polyéthylènes dont les homopolymères à basse densité (LDPE) et à haute densité (HDPE), et des copolymères (LLDPE, plastomères, par exemple).
Sa combustion dégage différents gaz (plus de 200, potentiellement[7], dont certains sont toxiques : furanes, acétaldéhyde, hydrocarbures insaturés ou aromatique (benzène), acide acétique ou propanoïque[8], mais aussi monoxyde d'azote, monoxyde de carbone et CO2, considérés comme des polluants atmosphériques[9].
Production
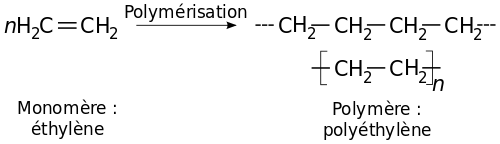
Son nom vient du fait qu'il est obtenu par polymérisation des monomères d'éthylène (CH2=CH2) en une structure complexe de formule générique -(CH2-CH2)n-.
Le polyéthylène est la seule polyoléfine qui puisse être préparée par voie radicalaire.
Le polyéthylène est surtout issu de la pétrochimie. En juin 2007, la compagnie brésilienne Braskem a annoncé la certification d'un polyéthylène vert, polymérisé à partir d'éthylène issu d'éthanol lui-même obtenu par fermentation de canne à sucre.
Classification
Les polyéthylènes peuvent être :
- linéaires ou branchés (ou ramifiés), et dès lors classés selon :
- leur densité qui dépend du nombre et de la longueur des ramifications présentes sur les chaînes moléculaires,
- leur masse molaire :
- polyéthylène à masse molaire très basse (ULMWPE ou PE-WAX, ultra low molecular weight polyethylene),
- polyéthylène à masse molaire élevée (HMWPE, high molecular weight polyethylene),
- PE-UHPM, polyéthylène de masse molaire très élevée (UHMWPE, ultra-high-molecular-weight polyethylene ou PE-UHMW selon la norme EN ISO 1043-1) ;
- réticulés : les polyéthylènes réticulés (PE-R, dits aussi PEX ou XLPE, pour cross-linked polyethylene) sont presque tous faits à partir de polyéthylène à haute densité (HDPE), on les désigne alors :
- PE-RHD, polyéthylène réticulé à haute densité (HDXLPE, high density cross-linked polyethylene).
| Nom | Sigle en français | Sigle en anglais | Abréviation selon la norme EN ISO 1043-1 | Synthèse[10] | Branchements | Masse volumique (g/cm3) |
|---|---|---|---|---|---|---|
| Polyéthylène à très basse densité | PE-TBD | VLDPE, very low density polyethylene | PE-VLD | Catalyse de Ziegler-Natta à basse pression (< 10 bar) et catalyse métallocènes (mPE-TBD) | ||
| Polyéthylène à basse densité linéaire | PE-BDL | LLDPE, linear low-density polyethylene | PE-LLD | Copolymérisation avec des oléfines par catalyse de Ziegler-Natta à basse pression (< 10 bar) | Courts | |
| Polyéthylène basse densité | PE-BD | LDPE, low-density polyethylene | PE-LD | Polymérisation radicalaire sous très haute pression | Longs et courts irrégulièrement distribués | 0,910 - 0,925[11] |
| Polyéthylène moyenne densité | PE-MD | MDPE, medium-density polyethylene | PE-MD | Catalyseur Phillips | 0,926 - 0,940[12] | |
| Polyéthylène haute densité | PE-HD | HDPE, high-density polyethylene | PE-HD | Catalyse de Ziegler-Natta et catalyse métallocène (mPE-HD) |
Le polyéthylène basse densité a été inventé en 1933 par les ingénieurs anglais E.W. Fawcett et R.O. Gibson. Le polyéthylène haute densité a été synthétisé en 1953 par le chimiste allemand Karl Ziegler et son équipe. Le polyéthylène à basse densité linéaire a été inventé pour remplacer le PE-BD en 1979.
Propriétés
Le polyéthylène est un polymère thermoplastique, translucide, chimiquement inerte (il est plus résistant aux oxydants forts que le polypropylène), facile à manier et résistant au froid.
Les trois principales familles de PE sont le HDPE (PE haute densité), le LDPE (PE basse densité) et le LLDPE (PE à basse densité linéaire)[13].
Le LDPE est plus ramifié que le HDPE, ce qui signifie que les chaînes s'assemblent moins bien entre elles. Les forces intermoléculaires de type van der Waals sont donc plus faibles. Il en résulte un taux de cristallinité moindre[14], une plus faible densité, une malléabilité et une résistance aux chocs plus élevées. En revanche, le HDPE est plus rigide.
- Le LDPE est obtenu par polymérisation radicalaire vinylique sous très haute pression, et possède une masse molaire de l'ordre de 200 000 à 500 000 g·mol-1 (mais elle peut être beaucoup plus élevée).
- Les autres PE peuvent être obtenus par une méthode de synthèse plus complexe et plus chère : la polymérisation coordinative par catalyse Ziegler-Natta.
Utilisation



Le polyéthylène est un polymère de synthèse très employé. Il compose notamment la moitié des emballages plastiques (films à usage alimentaire, agricole, etc.).
L'utilisation la plus visible du polyéthylène sont les sacs plastiques :
- Lorsque le sac se froisse facilement sous la main, avec un bruit craquant, un touché « mécanique », et revient plus ou moins spontanément à sa forme d'origine, il s'agit du HDPE (PE haute densité)
- Lorsque le toucher est plus « gras », que le plastique se froisse sans bruit, se perce facilement avec le doigt, il s'agit du LDPE (PE basse densité).
Les principales applications du HDPE sont des produits rigides : flacons (détergents, cosmétiques, etc.), bouteilles, boîtes type Tupperware, jerricans, réservoirs de carburant d'automobiles, etc.
Les principales applications du LDPE sont des produits souples : sacs, films, sachets, sacs poubelles, ruban adhésif, récipients souples (ketchup, crèmes hydratantes, etc.), etc.
Le polyéthylène réticulé (PER) montre une meilleure tenue thermique que le PE. Pour la fabrication de gaines de câbles électriques, la réticulation se fait en général après extrusion.
Le polyéthylène de masse molaire très élevée, tel le Dyneema, est utilisé pour ses hautes performances (un rapport résistance/masse 40 % supérieur à celui des aramides (Kevlar)). On le trouve dans les équipements sportifs (ski, snowboard, surf, cerfs-volants, etc.), le matériel de protection, notamment balistique (gilets pare-balles) ou moto (tenues à haute résistance à l'abrasion), les implants chirurgicaux, les plaques pour remplacer la glace des patinoires, etc. Son coût est très supérieur à celui des autres polyéthylènes.
Le polyéthylène est également un additif alimentaire (cire de polyéthylène oxydée E914).
Remarque : le poly(téréphtalate d'éthylène) souvent désigné sous son acronyme, PET, n'est pas un polyéthylène mais un polyester saturé utilisé pour la fabrication de fibres textiles, de bouteilles pour boissons, d'emballages, etc.
Commerce
En 2014, la France est nettement importatrice de polyéthylène, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 1 100 €[15].
Impact environnemental et biodégradabilité
Le polyéthylène est synthétisé à partir de l'éthylène qui est lui-même majoritairement produit à partir du pétrole ou du gaz naturel, même s'il est possible de l'obtenir à partir de ressources renouvelables. Ce plastique représente un enjeu majeur de gestion des déchets non seulement en raison de son abondance mais aussi parce qu'il est considéré comme très stable et quasiment non-biodégradable, il tend donc à s'accumuler dans l'environnement.
Cependant, en laboratoire, il est possible de partiellement biodégrader le PE par l'intermédiaire des bactéries, Enterobacter asburiae YT1 et Bacillus sp. YP1, présentes dans l'intestin de la larve d'une mite alimentaire (Plodia interpunctella)[16] : en incubant des films fins de PE durant 28 jours, des biofilms constitués par ces bactéries viables se sont formés. Ils ont réduit le caractère hydrophobe des films plastiques en les rendant poreux[16]. Des traces de puits et cavités (0,3 à 0,4 μm de profondeur) ont été observées en microscopie électronique à balayage et microscopie à force atomique à la surface de ces films de polyéthylène, et une formation de groupes carbonyle a été vérifiée[16]. Des cultures en suspension des deux souches bactériennes YT1 et YP1 (108 cellules/ml) ont dégradé à hauteur d'environ 6,1 ± 0,3 % et de 10,7 ± 0,2 % des films PE (100 mg), respectivement pour une période d'incubation de 60 jours[16]. Les poids moléculaires des films PE résiduels étaient plus faibles, et 12 sous-produits de dégradation (solubles dans l'eau) ont aussi été détectés. Les auteurs jugent leurs résultats comme prometteurs pour la biodégradation du PE dans l'environnement[16].
Produits de combustion
Au milieu des années 1970, on a commencé à chercher à évaluer la toxicité des produits des trois principales formes de dégradation thermique (Pyrolyse, thermo‐oxydation et combustion enflammée) du polyéthylène, au moyen de la chromatographie en phase gazeuse et de la spectrométrie de masse avec par exemple les travaux de Michal, Mitera & Tardon (1976)[17]. Les chimistes trouvent alors notamment des aldéhydes comme résultat de la thermo-oxydatation[18].
En 1981, Hoff & Jacobsson s’intéressent aux produits libérés par la thermo-oxydation de polyétylène basse densité (PEBD) à une relativement faible température (264 à 289 °C) en condition, donc, de faible volatilisation (+/-4 %). Dans ce cas, 44 produits produits de décomposition thermique du LDPE ont été trouvés ;« des hydrocarbures, des alcools, des aldéhydes, des cétones, des acides, des éthers cycliques, des éthers cycliques, des esters cycliques et des acides hydroxycarboxylique ». Seize composés oxygénés ont aussi été quantifiés (dont principalement des acides gras et des aldéhydes). À cette température, le polyéthylène libère principalement de l'acide formique[19].
L'amélioration des techniques de prélèvement des gaz in situ (dans le four ou à sa sortie) ont ensuite permis de mieux comprendre où et quand certains sous-produits de combustion apparaissaient ou disparaissaient (en minimisant les réactions secondaires de ces gaz avec l'air et le système de prélèvement). En 1982, des chercheurs caractérisent alors notamment des produits de dégradation pyrolytiques et issus d'oxydation. Les premiers sont une large une gamme d'hydrocarbures saturés et insaturés, des chaines de carbones allant de C2 à C23, dont le ratio de produits change peu selon les conditions. Parmi les produits plus secondaires, c'est-à-dire de dégradation par oxydation, on trouve notamment de l’acétone, de l’acétaldéhyde, de l’acide acétique et une petite quantité d’acroléine (en quantités et proportions très variable selon les conditions de la combustion)[20].
Peu après (en 1984) aux États-Unis, en laboratoire mais dans un appareil simulant les conditions du four d’un incinérateur, Hawley-Feder et ses collègues étudient la combustion de polyéthylène à haute température, en récupérant immédiatement les vapeurs et fumées (dans des pièges à froid, à azote liquide) et sur de la laine de verre pour analyse par chromatographie en phase gazeuse, et ce à quatre températures (800, 850, 900 et 959 °C)[21].
En 1994, on confirme lors d'expérimentations sur la combustion du polyéthylène que la quantité d’oxygène présent dans la chambre de combustion influe fortement sur le type de gaz qui vont de former dans la chambre de combustion (hydrocarbures aromatiques polycycliques (HAP) notamment) et sur la destruction d’imbrûlés[22].
Puis la composition chimique des vapeurs et fumées de combustion de divers types de polyéthylène (PE) a pu être affinée grâce aux progrès des matériels d’analyse, par exemple avec le GC-FID et GC-MSD utilisés par Piao & al (1999) dans un four de laboratoire avec un flux d’air réglable, à des températures allant de 600 à 900 °C ; à basse température se forment surtout des hydrocarbures, alors que des composés d'hydrocarbures aromatiques polycycliques apparaissent à plus haute température. Le matériel utilisé[23] a permis d’identifier plus de composés que lors des études précédentes[24]).
D’autres auteurs, dont Font & al, en 2004 ont publié des données sur les composés volatils et semi-volatils se formant lors de la combustion du polyéthylène (ainsi que sur leur évolution dans le four)[7], dans différentes conditions (4 cycles de combustion entre 500 et 850 °C avec 2 rapports différents échantillon/masse d'air ; et deux cycles pyrolytiques aux mêmes températures). Ici, aux environs de 500-600 °C la combustion du polyéthylène émet des α, ω-oléfines, les α-oléfines et des n-paraffines quand l’oxygène manque (décomposition pyrolytique) alors qu’en présence d’oxygène des composés oxygénés apparaissent (aldéhydes notamment) ; une forte production d’oxydes de carbone et d’hydrocarbures légers a aussi été démontrée. Ce travail a confirmé l'apparition de HAP (hydrocarbures aromatiques polycycliques) nocifs au températures plus élevées (en raison de l’évolution des houppettes pyrolytiques à l’intérieur de la chambre de combustion, si les composés semi-volatils développés ne sont pas parfaitement mélangés à l’oxygène). En tout, plus de 200 polluants chimiques ont été identifiés dans la chambre de combustion du polyéthylène. Une fois exposé à la lumière et à l'air et à l'humidité atmosphérique, ce cocktail de polluants peut encore considérablement évoluer.
En incinérateur d'ordures ménagères, le polyéthylène est souvent encré, souillé et mélangé à d’autres plastiques ou d'autres déchets (sous forme de CSR éventuellement) ; il peut aussi contenir des agents ignifugeants bromés[25] ; par exemple du phosphore rouge (en petites quantités) a été un retardateur de flamme commun du polyéthylène[26] ou d’autres additifs[27]) ; dans tous ces cas il peut alors produire d’autres gaz et microparticules ou nanoparticules d’imbrûlés que celles prévues par la théorie ou les tests en laboratoire.
Un type de CSR produits à partir de restes d’emballages en papier et en polyéthylène peut servir de combustible dans des chaudières industrielles adaptées (des briques faites de ce mélange brûlent atteignant 700 à 900 °C), mais l’introduction de plus de 30 % (en masse) de polyéthylène , selon une étude de 2004 « entraîne de très fortes émissions de HAP. De plus, pour les fractions massiques d'EP dépassant 30 %, des HAP lourds se forment majoritairement, plus toxiques que les HAP légers» )[28].
Pour toutes ces raisons, le polyéthylène ne devrait jamais être brûlé dans le jardin, en plein air ou dans une cheminée ou un insert domestique, mais uniquement dans des chaudières ou installations spéciales, équipées de filtres adaptés.
Anecdote
En 2010 Zhuo et ses collègues ont réussi à produire des nanotubes de carbone par une pyrolyse séquentielle et combustion de polyéthylène[29].
Notes et références
- POLYETHYLENE, Fiches internationales de sécurité chimique
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., relié (ISBN 978-1-4200-9084-0)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le )
- Nom et abréviation selon la norme EN ISO 1043-1, Plastiques - Symboles et termes abrégés - Partie 1 : polymères de base et leurs caractéristiques spéciales
- PlasticsEurope, « Plastics - the Facts 2018 :: PlasticsEurope », sur www.plasticseurope.org (consulté le )
- Font R, Aracil I, Fullana A & Conesa J.A (2004) Semivolatile and volatile compounds in combustion of polyethylene. Chemosphere, 57(7), 615-627 ([ https://www.sciencedirect.com/science/article/pii/S0045653504004734 résumé])
- « Plastiques, Risque et Analyse ThermIQue - Plyéthylène PE », sur inrs.fr
- Salifou Koucka Ouiminga1, Thomas Rogaume, Bila Gérard Segda1, Moussa Sougoti1 et Jean Koulidiati1, « Combustion de granulés de polyéthylène pur et de sachets plastiques à base de polyéthylène : effet de la masse et de la température sur les émissions d’oxydes d’azote et de carbone et l’évolution de l’oxygène », J. Soc. Ouest-Afr. Chim., (lire en ligne)
- Marc Carrega, « Aide-mémoire - Matières plastiques », coll. « Aide-Mémoire », Dunod/L'Usine nouvelle, 2009, 2e éd., 256 p.
- (en) J.G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.807 et 2.762.
- (en) « Polyethylene », sur plasticmoulding.ca (consulté le ).
- (en) Charles E. Wilkes, James W. Summers et Charles Anthony Daniels, PVC Handbook, Munich, Hanser Verlag, (ISBN 1-56990-379-4, lire en ligne), p. 14
- La cristallinité est plus élevée pour le second (80-90 % contre 50-70 %) car les ramifications, courtes ou longues, y sont moins fréquentes que dans le premier.
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=39012010 (consulté le )
- (en) Jun Yang et al., Evidence of Polyethylene Biodegradation by Bacterial Strains from the Guts of Plastic-Eating Waxworms, Environ. Sci. Technol., 2014, 48 (23), p. 13776–13784, DOI 10.1021/es504038a, mis en ligne le 19 novembre 2014.
- Michal J, Mitera J & Tardon S (1976) Toxicity of thermal degradation products of polyethylene and polypropylene. Fire and Materials, 1(4), 160-168 (résumé).
- Mitera, J., Michal, J., Kubát, J., & Kubelka, V. (1976). Analysis of thermo-oxidation products of polypropylene and polyethylene by gas chromatography/mass spectrometry. Fresenius' Zeitschrift für analytische Chemie, 281(1), 23-27.
- Hoff A & Jacobsson S (1981) Thermo‐oxidative degradation of low‐density polyethylene close to industrial processing conditions. Journal of Applied Polymer Science, 26(10), 3409-3423 (résumé)
- Hodgkin J.H, Galbraith M.N & Chong Y.K (1982) Combustion products from burning polyethylene. Journal of Macromolecular Science—Chemistry, 17(1), 35-44. (résumé)
- Hawley-Fedder R.A, Parsons M.L & Karasek F.W (1984) Products obtained during combustion of polymers under simulated incinerator conditions: I. Polyethylene. Journal of Chromatography A, 314, 263-273 (résumé )
- Van dell RD, Mahle NH, Hixson EM (1994) The effect of oxygen on the formation and destruction of the products of incomplete combustion from the combustion of polyethylene and o-dichlorobenzene. Combust Sci Technol ;101:261 – 83 https://books.google.fr/books?id=wdhGAQAAMAAJ&printsec=frontcover&hl=fr&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false
- Hewlett-Packard 6890GC-5973MSD
- Piao M, Chu S, Zheng M & Xu X (1999) Characterization of the combustion products of polyethylene. Chemosphere, 39(9), 1497-1512 (résumé).
- Nyden M.R, Forney G.P & Brown J.E (1992) Molecular modeling of polymer flammability : application to the design of flame-resistant polyethylene. Macromolecules, 25(6), 1658-1666.
- Peters E.N (1979) Flame‐retardant thermoplastics. I. Polyethylene–red phosphorus. Journal of Applied Polymer Science, 24(6), 1457-1464 (résumé).
- Cullis C.F (1971) The combustion of polyolefins(Polyethylene and polypropylene combustion, investigating additives and surrounding gaseous composition effects on flammability and volatile products during thermal degradation). Oxidation and Combustion Reviews, 5, 83-133.
- Salvador, S., Quintard, M., & David, C. (2004) Combustion of a substitution fuel made of cardboard and polyethylene: influence of the mix characteristics—experimental approach. Fuel, 83(4-5), 451-462.
- Zhuo C, Hall B, Richter H & Levendis Y (2010) Synthesis of carbon nanotubes by sequential pyrolysis and combustion of polyethylene. Carbon, 48(14), 4024-4034.
Annexes
Articles connexes
Liens externes
- Polyéthylène, University of Southern Mississippi
- Guillaume Latouchent et Jean-Louis Vignes, Polyéthylène, Société chimique de France,
- (fr+en) Site de l'Association des fabricants de plastique
- Coefficients de perméabilité, coefficients de diffusion et coefficients de solubilité du polyéthylène pour différents perméants
