Acroléine
L'acroléine est une substance chimique de formule brute C3H4O aussi connue sous divers noms comme propènal, prop-2-ènal, prop-2-èn-1-al, acraldéhyde, acrylaldéhyde, aldéhyde acrylique, acquinite, aqualin, aqualine, biocide, crolean, éthylène aldéhyde, magnacide, magnacide H ou slimicide.
| Acroléine | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | prop-2-énal | ||
| Synonymes |
2-propénal |
||
| No CAS | |||
| No ECHA | 100.003.141 | ||
| No CE | 203-453-4 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaune, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
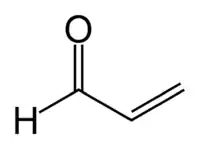
| Formule | C3H4O [Isomères] H2C=CH-CHO |
||
| Masse molaire[2] | 56,063 3 ± 0,003 g/mol C 64,27 %, H 7,19 %, O 28,54 %, |
||
| Moment dipolaire | 2,552 ± 0,003 D (cis) 3,117 ± 0,004 D (trans)[3] |
||
| Propriétés physiques | |||
| T° fusion | −88 °C[1] | ||
| T° ébullition | 53 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 200 g·l-1[1] | ||
| Paramètre de solubilité δ | 20,1 MPa1/2 (25 °C)[4] | ||
| Masse volumique | 0,8 g·cm-3[1], 1,94 (vapeur) |
||
| T° d'auto-inflammation | 234 °C[1] | ||
| Point d’éclair | −26 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 2,8–31 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 29 kPa[1] | ||
| Viscosité dynamique | 0,33cP (25 °C) | ||
| Point critique | 51,6 bar, 232,85 °C [5] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,103 ± 0,006 eV (gaz)[7] | ||
| Précautions | |||
| SGH[8] | |||
    Danger |
|||
| SIMDUT[9] | |||
   B2, D1A, E, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[10] | |||
| Écotoxicologie | |||
| LogP | 0,9[1] | ||
| Seuil de l’odorat | bas : 0,02 ppm haut : 1,8 ppm[11] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Elle se présente sous la forme d'un liquide incolore à légèrement jaunâtre avec une odeur âcre et désagréable. C'est un aldéhyde (H2C=CH-CHO) extrêmement toxique par inhalation et ingestion, elle est le constituant de la papite. Les limites d'exposition atmosphérique de l'acroléine vont de 20 ng/m3[12] à 0,4 µg/m3[13]. L'acroléine est un irritant majeur présent dans la fumée de cigarette ; sa concentration peut varier de 0,006 à 0,120 ppm en atmosphère enfumée.
Elle a pour origine l'incendie de matières plastiques, les fruits pourrissants, la décomposition de graisses. Elle se forme lorsque les acides gras présents dans les viandes se dégradent sous l’action de la chaleur (barbecues). Les acides gras à longues chaînes brisent les liens qui les liaient au glycérol, puis la molécule de glycérol perd deux molécules d’eau pour former l’acroléine. Elle contribue aussi au parfum des caramels préparés par chauffage en décomposition partielle du saccharose.
Propriétés physico-chimiques
L'acroléine possède les propriétés dues au groupement aldéhyde et à la présence de la double liaison C=C (addition d'hydracides). Elle fait partie de la famille des aldéhydes alpha-beta insaturés.
C'est un composé instable qui se polymérise facilement à la lumière pour former du disacryl (solide plastique). Elle prend naissance à chaud dans les graisses et les huiles (d'où son nom : âcre-oléine).
L'industrie pharmaceutique et chimique des matières plastiques, utilisant l'alcool allylique (CH2=CH-CH2-OH) pourrait avoir un effet hépatotoxique à la suite de la formation d'acroléine par l'ADH, cela produirait la libération du fer de la ferritine qui induirait un processus de lipoperoxydation (Lauwerijs).
Production et synthèse
Le premier procédé de production d'acroléine a été mis au point et commercialisé par Degussa en 1942. Dans ce procédé, l'acroléine était produite par la condensation en phase gazeuse d'acétaldéhyde et de formaldéhyde, réaction catalysée par le silicate de sodium à des températures entre 300 et 320 °C[14]. En 1948, Shell a développé le premier procédé industriel d’oxydation sélective de propène en acroléine en utilisant un catalyseur à base d’oxyde de cuivre supporté[15]. En 1957, la société Standard Oil of Ohio (Sohio) a découvert que des catalyseurs à base de molybdates de bismuth avaient une excellente sélectivité pour cette réaction[16].
CH2CHCH3 + O2 → CH2CHCHO + H2O
Aujourd’hui, l’acroléine est exclusivement produite par cette voie d’oxydation sélective de propène en utilisant des catalyseurs composés d’au moins 4 métaux de transition (molybdène, vanadium, niobium…) présents dans au moins deux oxydes complexes. Les procédés industriels permettent aujourd'hui d’atteindre des rendements en acroléine jusqu’à 91 %. Le procédé opère typiquement à des températures entre 300 et 400 °C et à pression atmosphérique. La charge contient 5 % à 10 % de propène, mélangé avec de l’air et un diluant (de la vapeur d’eau), ce dernier permettant de rester en dessous de la limite d’explosion.
L'acroléine peut également être préparée en passant des vapeurs de glycérol sur un agent déshydratant comme du KHSO4 chauffé de 300 à 340 °C. On l'obtient également par cultures de Bacillus amaracrylus sur du glycérol.
Utilisations
L'acroléine, le plus simple des aldéhydes insaturés, est un composé très réactif et constitue un intermédiaire polyvalent pour l’industrie chimique.
L'acroléine est utilisée pour la fabrication de matières plastiques (acide acrylique, acrylates...), de parfums, et dans de nombreuses synthèses organiques.
Elle est également utilisée comme intermédiaire réactionnel pour la préparation de la DL-méthionine, un acide aminé qui n'est pas synthétisé par les mammifères. La méthionine est donc souvent ajoutée comme supplément alimentaire dans la nourriture pour animaux.
Toxicité
Ce composé fait partie de la Liste EPA des substances extrêmement dangereuses. C'est un irritant de la peau et des muqueuses (oculaires et nasales).
Il est hautement lacrymogène. Pour cette raison, il a été utilisé comme gaz de combat durant la Première Guerre mondiale.
Il cause une diminution de la capacité respiratoire et de la fonction pulmonaire, avec hyperréactivité bronchique.
Dans le nez et le système respiratoire, si l'exposition perdure, l'irritation peut évoluer en inflammation, avec hémorragie, métaplasie, hyperplasie, œdème.
En médecine, l’acroléine est responsable d’effet indésirable à type de cystite hémorragique par toxicité de la muqueuse vésicale pour les chimiothérapies de la classe des moutardes azotées de la famille des alkylants comme la cyclophosphamide.
En 2013, l'Anses a proposé comme valeurs guides pour la qualité de l'air intérieur (VGAI)[17] :
- pour une exposition de courte durée (1 heure) : 6,9 µg/m3 d'air
- pour une exposition longue durée (plus d'un an) : 0,8 µg/m3 d'air
Références
- ACROLEINE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acroléine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Acrolein », sur hazmap.nlm.nih.gov (consulté le )
- (en) « Acrolein; CASRN 107-02-8 », sur https://www.epa.gov/iris, (consulté le )
- http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/psl2-lsp2/acrolein/acrolein-fra.pdf
- H. Schulz, H. Wagner, Synthese und Umwandlungsprodukte des Acroleins, Angewandte Chemie, (1950), Volume 62, Issue 5, 105-118 DOI 10.1002/ange.19500620502
- G.W. Hearne, M.L. Adams, Production of unsaturated carbonylic compounds, Shell Development Co., US 2,451,485 (1948)
- J.L. Callahan, R.W. Foreman, F. Veatch, Process for the oxidation of olefins, Standard Oil of Ohio, Brevet US 2,941,007 (1957)
- Anses Valeur guide de qualité d’air intérieur: l’Anses propose deux valeurs pour l’acroléine ; communiqué du 2013/06/25 consulté 2013-07-04 et Avis de l'Anses correspondant (PDF, 174 pages)



