Pyrite
La pyrite est une espèce minérale composée de disulfure de fer (FeS2), polymorphe de la marcassite ; elle contient généralement des traces de métaux précieux (argent (Ag), or (Au)), et de métaux lourds et métalloïdes toxiques nickel (Ni), cobalt (Co), arsenic (As), cuivre (Cu), zinc (Zn), thallium (Tl), sélénium (Se) et vanadium (V), et qui rendent son exploitation en tant que minerai très polluante.
| Pyrite Catégorie II : sulfures et sulfosels[1] | |
 Pyrite de la mine de Huanzala (Pérou) | |
| Général | |
|---|---|
| Nom IUPAC | disulfure de fer(II) |
| Numéro CAS | |
| Classe de Strunz | 02.EB.05a
|
| Classe de Dana | 02.12.01.01
|
| Formule chimique | FeS2 |
| Identification | |
| Masse formulaire[2] | 119,975 ± 0,012 uma Fe 46,55 %, S 53,45 %, |
| Couleur | doré pâle, terne |
| Classe cristalline et groupe d'espace | diploïdal - Pa3 |
| Système cristallin | cubique |
| Réseau de Bravais | primitif P |
| Macle | sur [110], interpénétration (croix de fer), et sur [001] |
| Clivage | faible à {100} et {110} |
| Cassure | irrégulière, parfois conchoïdale |
| Habitus | cubique, les faces peuvent être striées, mais aussi souvent octaèdre ou pyritoèdre |
| Échelle de Mohs | 6 - 6,5 |
| Trait | vert-noir à marron avec une odeur de soufre |
| Éclat | métallique, brillant |
| Propriétés optiques | |
| Transparence | opaque |
| Propriétés chimiques | |
| Densité | 4,95 - 5,10 |
| Température de fusion | 1 177 - 1 188 °C |
| Fusibilité | fond et donne une boulette magnétique |
| Solubilité | faiblement soluble dans HNO3 |
| Propriétés physiques | |
| Magnétisme | magnétique après chauffage |
| Radioactivité | aucune |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Unités du SI & CNTP, sauf indication contraire. | |

Historique de la description et appellations
Inventeur et étymologie
Le terme pyrite est attribué à Dioscoride ; il en fait la première mention connue en l'an 50. La pyrite fut remarquée des anciens pour les étincelles qu'elle produit sous les chocs. Le terme provient du grec πυρίτης / pyrítēs – λίθος / líthos, littéralement « pierre à feu ».
Topotype
Le topotype de cette espèce minérale n'est pas référencé.
Synonymes
Il existe de très nombreux synonymes pour cette espèce[4] :
- fer sulfuré (Haüy) ;
- hépatopyrite ;
- or des fous (terme commun avec la chalcopyrite)[5] ; durant la ruée vers l'or, la méconnaissance et le désespoir de bien des mineurs les menèrent à confondre la pyrite et la chalcopyrite avec l'or à cause de leur éclat et leur couleur ; paradoxalement, la pyrite contient des traces d'or (l'arsenic et l'or sont des éléments qui entrent dans la structure de la pyrite via une substitution couplée), le métal précieux prospecté dans les sédiments provenant notamment de la diffusion de son élément chimique hors du minéral de pyrite pendant des millions d'années[6] ;
- Pyrit (Haidenger) ;
- pyrites ;
- Schwefelkies (Werner) ;
- sidéropyrite ;
- tombazite ;
- xanthopyrite.
Caractéristiques physico-chimiques
Critères de détermination
Du point de vue macroscopique, les cristaux de pyrite prennent souvent des formes dodécaédriques aux faces pentagonales appelé pyritoèdres. De façon générale, la pyrite forme des cristaux d'habitus cubique, octaédrique ou pyritoédrique, dont les faces peuvent être striées.
D'éclat métallique brillant et opaque, la pyrite a une couleur dorée pâle. Son trait est vert-noir à marron et dégage une odeur de soufre.
Sa dureté est entre 6 et 6,5 sur l'échelle de Mohs. Sa cassure est irrégulière et parfois conchoïdale.
Les macles des pyritoèdres sont dites en « croix de fer ». La pyrite est souvent maclée sur [110], par interpénétration (croix de fer) et sur [001].
La pyrite est faiblement soluble dans l'acide nitrique. Elle devient magnétique lorsqu'elle est chauffée ; lors de la fusion entre 1 177 °C et 1 188 °C, elle forme une boulette magnétique.
Variétés
- Arsenian pyrite : pyrite contenant 3 % d’arsenic. Les cristaux de cette variété ont la particularité d’avoir des faces incurvées ou mal formées. Elle s’est rencontrée en France dans la mine de Salsigne dans l’Aude (gisement épuisé) et dans de nombreuses autres localités dans le monde.
- Ballesterosite : variété riche en zinc et en étain trouvée à Riego Rubio, Ribadeo, Lugo, Galice, Espagne. Cette seule occurrence mondiale suggère que cette « variété » soit en fait un simple synonyme de la pyrite.
- Bravoïte (synonyme de mechernichite) : espèce décrite par Hillebrand en 1907[7] et dédiée au minéralogiste péruvien Jose J. Bravo (1874-1928). Cette espèce est déclassée au rang de variété par l’IMA. Il s'agit d'une pyrite nickélifère de formule (Fe,Ni)S2. Il existe une sous variété : l’hengleinite, de formule (Ni,Fe,Co)S2, connue à Müsen (Allemagne). La bravoïte possède plusieurs occurrences dans le monde. En France elle est connue dans la vallée d'Aure, Beyrède-Jumet, Hautes-Pyrénées[8], à Malepeyre, Lubilhac, Haute-Loire[9] et dans plus de cinquante autres gisements.
- Cayeuxite : variété de pyrite riche en As, Sb, Ge, Mo, Ni et autres métaux, se présentant sous forme de nodules polymétaliques du crétacé inférieur. Elle est dédiée au minéralogiste français Lucien Cayeux[10].
- Cobalt-nickel-pyrite : variété contenant de 2 à 3 % de cobalt et 2 à 6 % de nickel, de formule 4[(Fe,Ni,Co)S2].
- Cobaltoan pyrite : variété cobaltifère de pyrite de formule (Fe,Co)S2. Il existe de nombreuses occurrences à travers le monde.
Cristallochimie
- Elle forme une série avec la cattiérite CoS2.
- Il existe un polymorphe de la pyrite : la marcassite.
- La pyrite sert de chef de file à un groupe de 19 espèces isostructurelles selon la classification de Strunz : le groupe de la pyrite.
| Minéral | Formule | Groupe ponctuel | Groupe d'espace |
|---|---|---|---|
| Pyrite | Fe[S2] | m3 | Pa3 |
| Cattiérite | Co[S2] | m3 | Pa3 |
| Vaesite | Ni[S2] | m3 | Pa3 |
| Penroséite | (Ni,Co,Cu)Se2 | m3 | Pa3 |
| Trogtalite | CoSe2 | m3 | Pa3 |
| Villamaninite | (Cu,Ni, Co,Fe)S2 | m3 | Pa3 |
| Fukuchilite | Cu3FeS8 | m3 | Pa3 |
| Krutaïte | CuSe2 | m3 | Pa3 |
| Hauérite | Mn[S2] | m3 | Pa3 |
| Laurite | Ru[S2] | m3 | Pa3 |
| Aurostibite | AuSb2 | m3 | Pa3 |
| Krutovite | Ni[As2] | m3 | Pa3 |
| Sperrylite | Pt[As2] | m3 | Pa3 |
| Géversite | Pt(Sb,Bi)2 | m3 | Pa3 |
| Insizwaïte | Pt(Bi,Sb)2 | m3 | Pa3 |
| Erlichmanite | OsS2 | m3 | Pa3 |
| Dzharkénite | Fe[Se2] | m3 | Pa3 |
| Gaotaiite | Ir3Te8 | m3 | Pa3 |
| Mayingite | IrBiTe | m3 | Pa3 |
voir aussi en:Pyrite group.
Cristallographie
La pyrite cristallise dans le système cristallin cubique, de groupe d'espace Pa3 (Z = 4 unités formulaires par maille), avec le paramètre de maille = 5,416 Å (volume de la maille V = 158,87 Å3, masse volumique calculée = 5,02 g cm−3)[11].
Elle est constituée d'ions fer(II) Fe2+ et d'ions disulfure S22−, autrement notés −S-S−. La structure de la pyrite est apparentée à celle de la halite NaCl. Les ions Fe2+ forment un réseau cubique à faces centrées, comme les ions Na+ de la structure NaCl. Les ions disulfure constituent des bâtonnets −S-S− dont le centre est en position intermédiaire de la maille cubique face-centrée, c'est-à-dire dans la position des ions Cl− de NaCl.
| Ion | Position de Wyckoff |
Symétrie ponctuelle |
Dans l'unité asymétrique |
Par l'application des opérations de symétrie du groupe d'espace | ||
|---|---|---|---|---|---|---|
| Fe2+ | 4a | .3. | 0 0 0 | 0 1/2 1/2 | 1/2 0 1/2 | 1/2 1/2 0 |
| −S-S− | 4b | .3. | 1/2 1/2 1/2 | 1/2 0 0 | 0 1/2 0 | 0 0 1/2 |
| S− | 8c | .3. | 0,38 0,38 0,38 (coordonnées arrondies) | 0,12 -0,38 0,88 | -0,38 0,88 0,12 | 0,88 0,12 -0,38 |
| -0,38 -0,38 -0,38 | 0,88 0,38 0,12 | 0,38 0,12 0,88 | ||||
| 0,12 0,88 0,38 | ||||||
Les bâtonnets −S-S− sont inclinés de 54,74° par rapport aux axes du cube, de telle sorte que :
- les cations Fe2+ sont en coordination octaédrique, entourés d'anions S−, avec une longueur de liaison Fe-S de 2,263 Å ;
- les ions S− (extrémité des bâtonnets d'ions disulfure −S-S−) sont en coordination tétraédrique, chaque S− étant entouré de trois ions Fe2+ à distance 2,263 Å et de l'autre ions S− du pont disulfure à distance 2,160 Å ;
- la longueur des liaisons S-S est 217 pm[12]. La variabilité de cette longueur dans la famille des pyrites est interprétée comme un écart à une structure purement ionique.
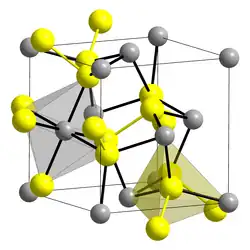 Structure de la pyrite. Jaune : S−, gris : Fe2+.
Structure de la pyrite. Jaune : S−, gris : Fe2+.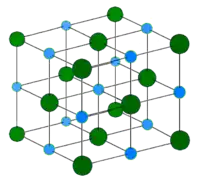 Structure de la halite. Bleu : Na+, Vert : Cl−.
Structure de la halite. Bleu : Na+, Vert : Cl−.
Gîtes et gisements
Gîtologie et minéraux associés
La pyrite peut être d'origine sédimentaire, magmatique, métamorphique ou hydrothermale. On la trouve également dans certaines météorites.
En particulier, les sols schisteux et argileux sont susceptibles de contenir des pyrites en milieu pauvre en oxygène, par action de bactéries sur de la matière organique. Le point de départ de cette minéralisation se trouve dans la production d'hydrogène sulfuré par les bactéries protéolytiques qui dégradent les protéines ou par les bactéries sulfato-réductrices qui décomposent les sulfates (produits issus de la décomposition des protéines) en hydrogène sulfuré. D'autres bactéries réduisent les hydroxydes ferriques (hydroxydes issu des roches ou de la matière organique) et libèrent les ions ferreux dans le milieu ambiant. En se combinant avec le fer, l'hydrogène sulfuré conduit à la précipitation de sulfures de fer, précurseurs de la pyrite. Lorsque la pyrite a une origine sédimentaire, elle constitue le minéral authigène caractéristique des environnements marins anoxiques riches en matière organique[13].
Gisements producteurs de specimens remarquables
- Espagne
- Belgique (Région wallonne)
- Mine du Rocheux à Theux-Oneux (fin d'exploitation en 1880).
- France
- Mines de Batère, Corsavy, Arles-sur-Tech, Pyrénées-Orientales[15].
- Carrière de talc de Trimouns près de Luzenac dans l’Ariège[16].
- Mine de Saint-Pierre-la Palud (Rhône), exploitée jusqu'en 1972.
- Italie
- Cantiere Vigneria, Miniera di Rio (Miniera di Rio Marina), Rio Marina, Île d'Elbe, Toscane[17] .
- Pérou
- Mines de Huaron, San Jose de Huayllay District, Cerro de Pasco, Daniel Alcides Carrión Province, Pasco Department.
- Slovaquie
- Banská Štiavnica baňa (ex Schemmittz), Banská Štiavnica, Banská Štiavnické rudné pole, Štiavnické vrchy, Banskobystrický Kraj[18].
Exploitation des gisements
Utilisation
- La pyrite fut plus exploitée aussi bien comme source de soufre que de fer. Cette industrie très polluante tend cependant à être remplacée par d'autres procédés. En 1985, 18 % du soufre était obtenu à partir de ce minerai. La quantité extraite est de moins de 8 % actuellement, soit 6,6 millions de tonnes extraites par an, dont 6 millions rien qu'en Chine[19]. Elle n'est pas utilisée comme source de fer pour la fabrication de l'acier car le coût d'extraction est supérieur par rapport à l'hématite (Fe2O3) ou à la magnétite (Fe3O4). L'extraction du fer à partir de la pyrite permet également l'obtention d'une fonte, qui doit cependant être soufflée à l'oxygène pour éliminer le soufre en solution. Les derniers procédés de biolixiviation ont permis l'extraction du chrome à partir de la pyrite.
- Elle reste le minerai de base de la fabrication de l’acide sulfurique par le procédé des chambres au plomb. Elle est exploitée dans beaucoup de gisements pour le traitement métallurgique des poudres (pelletisation) dans la production de l'or, du cuivre, du cobalt, du nickel…
- Le récepteur à pyrite connu sous le nom de poste à pyrite est un récepteur radio à modulation d'amplitude extrêmement simple qui historiquement permit la réception des ondes radioélectriques pendant la Seconde Guerre mondiale.
- La pyrite servit aussi comme pierre à feu, on en trouve sur la momie d'Otzi.
Problèmes sanitaires et environnementaux
- Son utilisation dans le remblai autour des fondations de diverses constructions, notamment au Québec et accidentellement comme composant pour le béton à Trois-Rivières, a été à l'origine de critiques en raison de l'affaiblissement des fondations dû aux fissures provoquées par gonflement. Ce gonflement est produit par la réaction de la pyrite avec l'eau, l'air et la chaux (Ca(OH)2) du béton. Les solides produits, hydroxyde ferrique (Fe(OH)3) et gypse (CaSO4(H2O)2), sont plus volumineux que les réactifs solides car ils incorporent les atomes des fluides réactifs ; eau (H2O) et dioxygène (O2) .
- 4 FeS2 + 15 O2 + 14 H2O + 8 Ca(OH)2 → 4 Fe(OH)3 + 8 CaSO4(H2O)2.
- Les mine de pyrites et leurs déchets miniers comptent parmi les sources les plus importantes de pollution par l'antimoine, l'arsenic et surtout le thallium[20] - [21] - [22] - [23], le plus toxique de métaux. Il est rare dans la croute terrestre mais souvent significativement présent dans la pyrite (ex : 1299 ppm en moyenne dans les pyrites de Sennari, 1967 ppm Canale della Radice et et 2623 ppm à Fornovolasco en Italie[24]. qui sont « dissous dans la matrice de la pyrite (...) dans des nanoparticules distribuées de manière homogène (...) sous la forme de Tl+, Sb3+, As3+ et As− (...) Tl+ pourrait se produire dans les défauts structuraux de la pyrite, dépourvus de tout ordre à longue distance. La nature "lâche" de Tl dans la pyrite favorise sa perte rapide lors de la recristallisation métamorphique de la pyrite et sa redistribution dans les corps minéralisés et les roches encaissantes, avec des implications importantes d'un point de vue économique et environnementaL »[24].
Galerie
France
 Pyrite - mine de Batère, Pyrénées-Orientales (17 × 11 cm)
Pyrite - mine de Batère, Pyrénées-Orientales (17 × 11 cm) Pyrite - macle en « croix de fer » - mine de Batère, Pyrénées-Orientales (7 × 5 cm)
Pyrite - macle en « croix de fer » - mine de Batère, Pyrénées-Orientales (7 × 5 cm) Pyrite - octaèdre - Trimouns, Ariège (6 × 5,8 cm)
Pyrite - octaèdre - Trimouns, Ariège (6 × 5,8 cm) Pseudomorphose ammonite en pyrite - Bully, Calvados (4 cm)
Pseudomorphose ammonite en pyrite - Bully, Calvados (4 cm)
Monde

 Pyrite - mine Ampliación a Victoria, Espagne (4 × 4 × 4 cm)
Pyrite - mine Ampliación a Victoria, Espagne (4 × 4 × 4 cm) Pyrite et sphalérite - mines de Huaron, Pérou (18 × 11 cm)
Pyrite et sphalérite - mines de Huaron, Pérou (18 × 11 cm) Pyrite et quartz - Banská Štiavnica baňa, Slovaquie (7 × 5,5 cm)
Pyrite et quartz - Banská Štiavnica baňa, Slovaquie (7 × 5,5 cm) Pyrite ; diamètre maximum 52 mm.
Pyrite ; diamètre maximum 52 mm. Pyrite avec des cristaux de hématite.
Pyrite avec des cristaux de hématite.
Références
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Pyrite » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Index alphabétique de nomenclature minéralogique » BRGM
- F. Pernot, L'or, Éditions Artémis, , 221 p. (ISBN 978-2-84416-282-3, présentation en ligne), p. 22
- (en) P Andráš, Martin Chovan, « Gold incorporation into sulphide minerals from the Tatric Unit, the Western Carpathians, with respect to their chemical composition », Journal of the Czech Geological Society, vol. 50, nos 3-4, , p. 143-156 (DOI 10.3190/JCGS.984)
- (en) W.F. Hillebrand, « Vanadium sulphide, patronite, and its mineral associates from Minasragra, Peru », American Journal of Science, vol. 24, no 140, , p. 141-151 (DOI 10.2475/ajs.s4-24.140.141)
- C. Gourault, « Indice de Beyrède-Jumet (Hautes-Pyrénées) », dans Le Cahier des Micromonteurs, vol. 2, 1998, p. 5-9
- Pierre G. Pélisson, Étude minéralogique et métallogénique du district filonien polytype de Paulhaguet (Haute-Loire, Massif Central français), thèse de doctorat, Orléans, France, 1989
- (en) Zbigniew Sujkowsrki, « The nickel bearing shales in Carpathian Flysch », dans Arch. Mineral. Warsaw, vol. 12, 1936, p. 118-138
- ICSD No. 109 377 ; (en) Milan Rieder, John C. Crelling, Ondřej Šustai, Milan Drábek, Zdeněk Weiss et Mariana Klementová, « Arsenic in iron disulfides in a brown coal from the north bohemian basin, Czech Republic », International Journal of Coal Geology, vol. 71, nos 2-3, , p. 115-121 (DOI 10.1016/j.coal.2006.07.003)
- (en) N. N. Greenwood et A. Earnshaw, Chemistry of the elements, Elsevier, , 2e éd.
- Jean-François Deconinck, Benjamin Brigaud, Pierre Pellenard, Pétrographie et environnements sédimentaires, Dunod, (lire en ligne), p. 223.
- (es) Miguel Calvo Rebollar, Minerales y Minas de España. Volumen II. Sulfuros y sulfosales, Museo de Ciencias Naturales de Álava, 2003, 703 p.
- C. Berbain, G. Favreau et J. Aymar, Mines et Minéraux des Pyrénées-Orientales et des Corbières, Association Française de Microminéralogie, 2005, p. 39-44
- Didier Descouens, P. Gatel, « Le Gisement de talc de Trimouns », in Monde et minéraux, no 78, avril 1987, p. 4-9.
- (it) P. Orlandi et A. Pezzotta, I minerali dell'Isola d'Elba. I minerali dei Giacimenti metalliferi dell'Elba orientale e delle Pegmatiti del Monte Capanne, Novecento Grafico, Bergamo, 1997, 245 p.
- (en) M. Haber, S. Jelen, E.L. Shkolnik, A.A. Gorshkov et E.A. Zhegallo, « The participation of micro-organisms in the formation of todorokite from oxidation zone (Terézia Vein, Banskà Stiavnica deposit, Slovak Republic) », dans Acta Miner. Petr., vol. 1, 2003.
- J.-L. Vignes, G. André et al., Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux, Société chimique de France, , 8e éd. (présentation en ligne)
- (en) YongHeng Chen et ChunLin Wang, « Environmental exposure and flux of thallium by industrial activities utilizing thallium-bearing pyrite », sur Science China Earth Sciences, (ISSN 1869-1897, DOI 10.1007/s11430-013-4621-6, consulté le ), p. 1502–1509
- (en) Juan Liu et Meiling Yin, « Thallium isotopic fractionation in industrial process of pyrite smelting and environmental implications », sur Journal of Hazardous Materials, (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2019.121378, consulté le ), p. 121378
- (en) Chunxia Yang et Yongheng Chen, « Distribution of natural and anthropogenic thallium in the soils in an industrial pyrite slag disposing area », sur Science of The Total Environment, (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2004.09.024, consulté le ), p. 159–172
- (en) Juan Liu et Nuo Li, « Thallium contamination in farmlands and common vegetables in a pyrite mining city and potential health risks », sur Environmental Pollution, (ISSN 0269-7491, DOI 10.1016/j.envpol.2019.02.092, consulté le ), p. 906–915
- (en) Luke L. George et Cristian Biagioni, « The speciation of thallium in (Tl,Sb,As)-rich pyrite », sur Ore Geology Reviews, (DOI 10.1016/j.oregeorev.2019.02.031, consulté le ), p. 364–380
