Nitrométhane
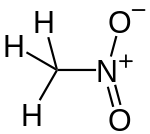
Le nitrométhane est un composé organique dont la formule chimique est CH3NO2. Il est le plus simple composé organique nitré. Il s'agit d'un liquide hautement polaire habituellement utilisé comme solvant dans les applications industrielles, comme les extractions, en tant que réactif ou solvant de nettoyage. En tant qu'intermédiaire dans la synthèse organique, il est très utilisé dans la fabrication de produits pharmaceutiques, pesticides, explosifs et fibres. Il est également utilisé comme carburant à haut potentiel pour les véhicules de course et, mélangé à des huiles, dans le modélisme.
| Nitrométhane | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Nitrométhane | ||
| No CAS | |||
| No ECHA | 100.000.797 | ||
| No CE | 200-876-6 | ||
| Apparence | liquide visqueux incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | CH3NO2 [Isomères] |
||
| Masse molaire[2] | 61,04 ± 0,001 8 g/mol C 19,68 %, H 4,95 %, N 22,95 %, O 52,42 %, |
||
| Moment dipolaire | 3,46 ± 0,02 D[3] | ||
| Diamètre moléculaire | 0,449 nm[4] | ||
| Propriétés physiques | |||
| T° fusion | −29 °C[1] | ||
| T° ébullition | 101 °C[1] | ||
| Paramètre de solubilité δ | 26,0 MPa1/2 (25 °C)[5]; 11,0 cal1/2·cm-3/2[6] |
||
| Masse volumique | 1,137 g·cm-3[7], 2.11 (vapeur) |
||
| T° d'auto-inflammation | 417 °C[1] | ||
| Point d’éclair | 35 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 7,3–60 %vol[1] | ||
| Point critique | 63,1 bar, 314,85 °C[8] | ||
| Point triple | 244,77 K (−28,38 °C) | ||
| Thermochimie | |||
| ΔfH0gaz | -81 kJ/mol | ||
| ΔfH0liquide | -113 kJ/mol | ||
| Cp | 106 J/mol.K (liquide)
| ||
| Chaleur latente de vaporisation | 34 kJ/mol | ||
| Chaleur latente de fusion | 9,7 kJ/mol | ||
| PCS | 709,2 kJ·mol-1 (25 °C, liquide)[10] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,08 ± 0,07 eV (gaz)[11] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,379[4] | ||
| Précautions | |||
| SGH[12] | |||
  Attention |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 2B : Peut-être cancérogène pour l'homme[13] | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 3,5 ppm haut : 100 ppm[14] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
Le nitrométhane peut être synthétisé par réaction du chloroacétate de sodium avec le nitrite de sodium en solution aqueuse :
- ClCH2COONa + NaNO2 + H2O → CH3NO2 + NaCl + NaHCO3
Il est extrait du mélange réactionnel par distillation.
À l'échelle industrielle, il est produit par nitration du méthane en faisant réagir en phase vapeur le méthane et l'acide nitrique.
Applications
Le nitrométhane est un solvant couramment utilisé en chimie organique[15].
Solvant
Le nitrométhane est souvent utilisé comme solvant organique dans les réactions d'alkylation de Friedel-Crafts ou de réarrangement de Fries.
Carburant
Le nitrométhane est utilisé comme carburant pour les véhicules de course, en particulier pour les dragsters, afin de fournir plus de puissance[16]. Il est également utilisé comme comburant, pour donner un apport en oxygène dans les moteurs thermiques de voitures et avions radiocommandés. Dans ces deux cas, il est souvent simplement surnommé nitro.
L'oxygène contenu par le nitrométhane lui permet de brûler avec beaucoup moins d'apport d'oxygène atmosphérique que d'autres hydrocarbures, comme l'essence par exemple. La réaction de combustion est la suivante :
- 4CH3NO2 + 3O2 → 4CO2 + 6H2O + 2N2
14,6 kg d'air sont requis pour la combustion d'un kilogramme d'essence, mais seulement 1,7 kg sont requis pour un kilogramme de nitrométhane. Comme le cylindre d'un moteur ne peut contenir qu'une quantité limitée d'air à chaque cycle, on peut donc brûler 8,7 fois plus de nitrométhane que d'essence. Cependant, le nitrométhane a une densité énergétique inférieure à celle de l'essence (11,3 MJ/kg pour le nitrométhane contre 42 à 44 MJ/kg pour l'essence). Ceci permet de déduire que le nitrométhane employé seul génère environ 2,3 fois plus d'énergie que l'essence lorsqu'il est combiné avec un volume d'oxygène donné.
Le nitrométhane peut aussi être utilisé comme monergol, car il peut se décomposer suivant la réaction :
- 4CH3NO2 → 4CO + 4H2O + 2H2 + 2N2
Explosif
Avec le nitrate d'ammonium, le nitrométhane est le constituant d'un explosif binaire appelé Kinestik.
Notes et références
- NITROMETHANE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Șerban Moldoveanu, Sample preparation in chromatography, Amsterdam/Boston, Elsevier, , 930 p. (ISBN 0-444-50394-3), p. 258
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- « Nitromethane », sur hazmap.nlm.nih.gov (consulté le )
- (en) Coetzee, J. F. and Chang, T. H., « Recommended Methods for the Purification of Solvents and Tests for Impurities: Nitromethane », International Union of Pure and Applied Chemistry, vol. 58, , p. 1541-1545 (lire en ligne)
- K. Owen and T. Coley, Automotive Fuels Reference Book - 2nd edition, Chapter 13 "Racing Fuels", (ISBN 1-56091-589-7) (1995)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nitromethane » (voir la liste des auteurs).
Liens externes
- (fr) Fiche toxicologique de l'INRS
- (en) Fiche Nitrométhane sur le WebBook de chimie du NIST




