Réarrangement de Fries
Un réarrangement de Fries, nommé d'après le chimiste allemand Karl Theophil Fries (en)[1] - [2], est une réaction de réarrangement électrophile d'esters aryliques, tels que des ester phényliques, sous catalyse par un acide de Lewis pour donner la cétone d'aryle correspondante[3] :
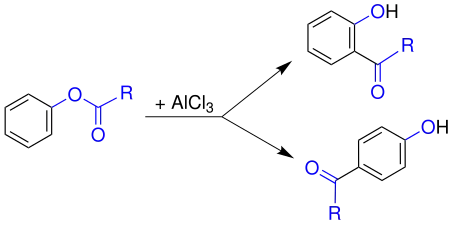 Réarrangement de Fries catalysé par AlCl3.
Réarrangement de Fries catalysé par AlCl3.
Mécanisme proposé
Malgré d'actives recherches, aucune étude concluante sur le mécanisme réactionnel de ce réarrangement n'a été publiée. Des analyses croisées ont montré l'action de processus à la fois intra et intermoléculaires. Le déroulement de la réaction dépend à la fois des substrats et du solvant. On considère généralement le mécanisme présenté ci-dessous comme représentant le plus fidèlement la réaction réelle. Dans un premier temps, l'acide de Lewis, ici le chlorure d'aluminium AlCl3, attaque l'oxygène du groupe carbonyle de l'acyle (1), plus négatif que l'oxygène phénolique et donc attaqué en premier comme base de Lewis. La liaison entre le radical acyle et l'oxygène s'en trouve polarisée (2). Le chlorure d'aluminium migre ensuitre vers l'oxygène phénolique (3), et un carbocation acylium (5) est libéré après déplacement des électrons de la liaison ester. Ce cation acylium (5) réagit avec l'anion aromatique (4) par substitution électrophile aromatique classique. Il peut se produire une attaque en position ortho ou en position para. L'orientation de la substitution dépend de la température (contrôle thermodynamique) : le produit ortho est favorisé à température élevée tandis que le produit para est favorisé à basse température, la configuration ortho formant un complexe bidentate plus stable avec l'aluminium[4]. La polarité du solvant intervient également, les solvants apolaires favorisant les substitutions ortho tandis que les solvants polaires favorisent les substitutions para[5]. Un proton est éliminé après l'attaque électrophile afin de restaurer la nature aromatique du produit, donnant la cétone ortho (7) ou para (10). La cétone obtenue demeure liée à l'aluminium sous forme d'anion. Ce composé d'aluminium est ensuite hydrolysé pour obtenir l'hydroxycétone ortho (8) ou para (11) souhaitée[6] - [7].
Réarrangement photo-Fries
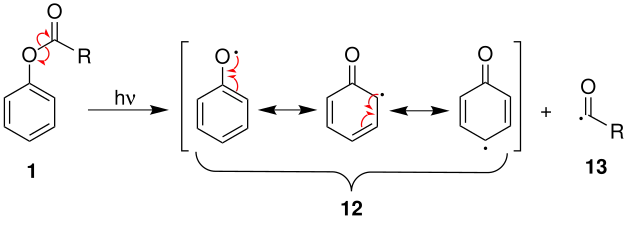
Outre la réaction d'ester phénylique décrite ci-dessus, il existe une variante de cette réaction connue sous le nom de réarrangement photo-Fries[8] - [9], parfois écrite « réarrangement de photo-Fries ». Ce réarrangement-là procède selon un mécanisme radicalaire. Il peut être mis en œuvre en présence de groupes désactivants sur le composé aromatique, mais n'a été employé qu'en laboratoire en raison de rendements généralement faibles. Si la position para du radical est occupée par un substituant, par exemple un groupe méthyle, il ne peut se former que des ortho-hydroxycétones[10] (8) ; en l'absence de substituant, la réaction conduit à la fois à des substitutions ortho (8) et para[3] (11). La réaction commence par la formation photochimique d'un radical acyle (13) et d'un radical aryloxy (12) stabilisé par mésomérie. L'orientation ortho ou para du réarrangement est conditionné par les structures de résonance limites du radical aryloxy, qui donnent l'hydroxycétone ortho ou para après relocalisation d'un proton[7].
Réarrangement de Fries anionique
Un réarrangement de Fries anionique consiste en l'ortho-métallation (en) de carbonates, de carbamates et d'esters d'aryle avec une base forte aboutissant à des ortho-carbonyles[11].
Applications
La réaction de phénols avec des halogénures d'acyle dans les conditions de l'acylation de Friedel-Crafts donne des esters phényliques mais pas les hydroxyarylcétones souhaitées, de sorte que le réarrangement de Fries est utilisé dans l'industrie pour la production de tels composés, qui sont des précurseurs importants pour la synthèse de diverses substances phramaceutiques. Le chlorure d'aluminium AlCl3 peut être remplacé dans certains cas par d'autres acides de Lewis tels que le trifluorure de bore BF3 ou le triflate de bismuth Bi3CF3SO3, ou encore des acides protiques forts tels que l'acide fluorhydrique HF ou l'acide méthylsulfonique CH3SO3H. Des recherches visent à remplacer ces catalyseurs corrosifs et écologiquement dommageables.
Notes et références
- (de) K. Fries et G. Finck, « Über Homologe des Cumaranons und ihre Abkömmlinge », Berichte der deutschen chemischen Gesellschaft, vol. 41, no 3, , p. 4271-4284 (DOI 10.1002/cber.190804103146, lire en ligne)
- (de) K. Fries et W. Pfaffendorf, « Über ein Kondensationsprodukt des Cumaranons und seine Umwandlung in Oxindirubin », Berichte der deutschen chemischen Gesellschaft, vol. 43, no 1, , p. 212-219 (DOI 10.1002/cber.19100430131, lire en ligne)
- (de) Louis Fieser et Mary Fieser, Organische Chemie, 2e éd., Verlag Chemie Weinheim, 1972, p. 926-928. (ISBN 3-527-25075-1)
- (en) Malcolm Sainsbury, Aromatic Chemistry, Oxford Chemistry Primers, 1992, Oxford University Press, p. 65. (ISBN 0-198556748)
- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, p. 181. (ISBN 0-123694833)
- (de) Thomas Laue et Andreas Plagens, Namens- und Schlagwort-Reaktionen der Organischen Chemie, 5e éd., Teubner Studienbücher Chemie, 2006, p. 124.
- (en) Zerong Wang, Comprehensive Organic Name Reactions and Reagent, vol. 1, Wiley, 2009, p. 1143. (ISBN 978-0-471-70450-8)
- (en) « photo-Fries rearrangement », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) Daniel Belluš, « Photo-Fries Rearrangement and Related Photochemical [1,j]-Shifts (j = 3, 5, 7) of Carbonyl and Sulfonyl Groups », Advances in Photochemistry, vol. 8, (DOI 10.1002/9780470133385.ch3, lire en ligne)
- (de) Jürgen Martens et Klaus Praefcke, « Organische Schwefelverbindungen, VII. Photochemische α-Spaltung von Thiobenzoesäure-S-p-tolylestern in Lösung », Chemische Berichte, vol. 107, no 7, , p. 2319-2325 (DOI 10.1002/cber.19741070716, lire en ligne)
- (en) Marcus Korb et Heinrich Lang, « The anionic Fries rearrangement: a convenient route to ortho-functionalized aromatics », Chemical Society Reviews, vol. 48, no 10, , p. 2829-2882 (PMID 31066387, DOI 10.1039/c8cs00830b, lire en ligne)