Caenorhabditis elegans
Caenorhabditis elegans (C. elegans en abrégé) est un petit ver d'un millimètre environ, transparent et non parasitaire. C'est un nématode de la famille des Rhabditidae.
| Règne | Animalia |
|---|---|
| Embranchement | Nematoda |
| Classe | Secernentea |
| Ordre | Rhabditida |
| Famille | Rhabditidae |
| Genre | Caenorhabditis |
Sous-espèces de rang inférieur
Le nom est formé des deux racine grecques caeno- (καινός (caenos), récent), et rhabditis (ῥάβδος (rhabdos), tige, bâton) et du mot latin elegans (élégant). En 1900, Maupas nomma l'espèce Rhabditides elegans, puis Osche la plaça dans le sous-genre Caenorhabditis en 1952, et en 1955, Dougherty établit Caenorhabditis au rang de genre[5].
Dougherty et Nigon établissent l'intérêt de l'étude de C. elegans en physiologie animale et en génétique en 1949[6]. Ce ver est devenu un organisme modèle en biologie, car il permet l'étude, entre autres, de l'apoptose (mort programmée de certaines cellules), du développement embryonnaire et du vieillissement.
C. elegans est un organisme modèle dans l’étude génétique. Il est, notamment, très utilisé en raison de sa transparence, son court cycle de reproduction (3,5 jours) ainsi que sa grande facilité de manipulation.
Régime alimentaire

Il se nourrit principalement de bactéries (bactérivore). Dans la nature, dans les tas de compost où on peut le trouver, il se nourrit de bactéries du sol ou de bactéries ubiquitaires telles que Bacillus subtilis.
En laboratoire, les souches sont maintenues en culture dans des boîtes de Petri, sur l'agar dont se nourrissent des bactéries Escherichia coli de la souche 'OP50', qui est une souche auxotrophe en uracile et qui ne forme pas de biofilm qui gênerait l'observation au microscope photonique car il peut être observé vivant entre lame et lamelle sur de la gélose ou fixé entre lame et lamelle.
Reproduction
La plupart des individus sont hermaphrodites (XX) et produisent à la fois des œufs et des spermatozoïdes. Des mâles (XO) peuvent aussi être produits par non-disjonction du chromosome à la méiose (à une fréquence approximative de 1/10 000) ou lors de croisements entre mâles et hermaphrodites (50% de la descendance). Les spermatozoïdes ne possèdent pas de flagelles et utilisent un mode de déplacement amiboïde[7].
À 16 ˚C, l'embryogenèse de C. elegans ne dure que 16 heures et peut être facilement observée par microscopie [8]. Après quatre jours de développement après fécondation, les individus sont capables de se reproduire. Leur durée de vie est d'environ trois semaines[9].
Lorsqu'ils sont exposés à des températures élevées, les individus sont susceptibles d'émettre une phéromone attirant les mâles, privilégiant ainsi la reproduction sexuée par rapport à l'autofécondation. Ce comportement est susceptible d'être reproduit par les générations suivantes de vers, même si ces dernières évoluent dans des conditions où ce stress thermique est absent[10].
Anatomie
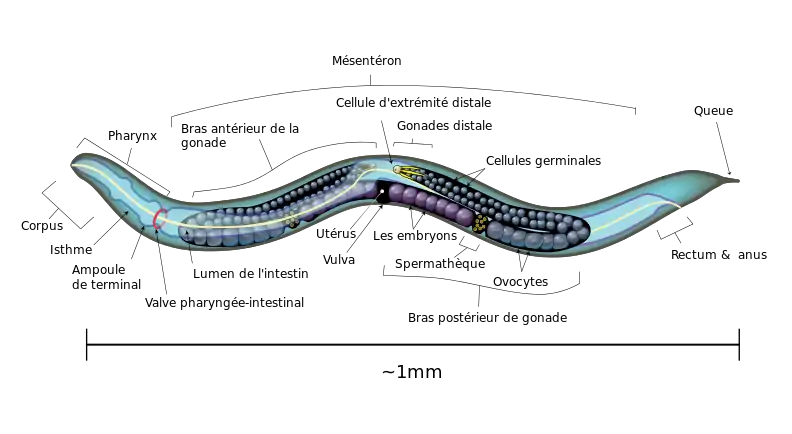
Vision des couleurs
C. elegans ne dispose d'aucun organe visuel, ni même de gènes codant une opsine. Il est néanmoins capable de distinguer certaines couleurs de son environnement, ce qui lui permet d'éviter les zones riches en bactéries toxiques. Cette vision des couleurs est due à des gènes codant des protéines sensibles aux contraintes, jkk-1 (une kinase) et lec-3 (une lectine)[11] - [12].
Animal-modèle de laboratoire

C. elegans a été introduit dans les laboratoires de génétique à la fin des années 1960 par Sydney Brenner, pour répondre au besoin d'un organisme modèle génétique pour comprendre l'élaboration d'un organisme pluricellulaire et la neurobiologie. Les « pères » du modèle Caenorhabditis elegans, Sydney Brenner, John Sulston et Robert Horvitz, ont reçu le prix Nobel de médecine en 2002[13].
Le nématode possède un nombre quasiment fixe de cellules (eutélie). En 1983, Sir John Sulston en publia les lignages cellulaires, c'est-à-dire toute la généalogie des cellules depuis l'œuf jusqu'à l'adulte, quasi-invariant d'un individu à l'autre :
- l'adulte hermaphrodite (99,5 % des individus) est composé de 959 cellules somatiques dont le lignage a pu être défini (certaines de ces cellules fusionnent entre elles à un moment du développement, formant des syncytiums) ;
- l'adulte mâle est composé de 1 031 cellules.
Au cours de la vie du ver, il y a multiplication cellulaire, et mort par apoptose de 131 cellules (1 090 cellules sont produites et il en reste 959 chez l'adulte). Chacune de ces 131 cellules se « suicide » à peu près au même moment et au même endroit dans tous les embryons.
La simplicité de ce ver s'est imposée dans l'étude du génome, de la régulation de l'expression des gènes, de la polarité cellulaire, de l'apoptose, de l'organogenèse et du vieillissement. Une partie des cellules du ver (302) sont des cellules neuronales, permettant également l'étude du système nerveux et du comportement.
Génétique et épigénétique
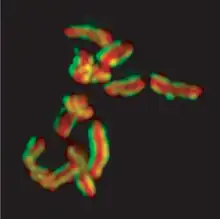
Génome
En 1998, ce ver fut le premier animal dont le génome ait été totalement séquencé : 97 millions de paires de bases réparties en six paires de chromosomes (organisme diploïde) codant 19 099 gènes. Quarante pour cent d'entre eux auraient des équivalents dans le patrimoine génétique humain. Les ancêtres de ce ver ainsi que ceux des hommes auraient divergé il y a 550 millions d'années. L'ensemble des informations génomiques concernant cet organisme sont compilées dans WormBase.
Épigénétique

En 2017 Klosin et al. ont montré qu'un stress thermique peut induire chez C. elegans l'expression de copies réprimées (de manière endogène) de gènes - parfois appelés ADN non codant ou "junk DNA", avec un effet persistant pour au moins 14 générations de vers. La chromatine est modifiée en début d'embryogénèse, avant le début de la transcription et la modification est héritée par les ovules comme par les spermatozoïdes. Dans ce cas, on observe une triméthylation altérée de l'histone H3 lysine 9 (H3K9me3) avant le début de la transcription zygotique[16].
Mort programmée
Robert Horvitz et son équipe de Boston ont pu identifier par mutagenèse au hasard les divers gènes produisant les protéines qui contrôlent la mort cellulaire programmée durant le développement de C. elegans. Ils ont trouvé des mutants chez lesquels les 131 cellules normalement destinées à disparaître par apoptose échappent à la mort programmée.
Les gènes intervenant dans les mutations ont été appelés ced (pour cell death-abnormal). Les 131 cellules qui meurent généralement survivent chez les vers dont le gène ced-3 ou ced-4 a été inactivé. Le gène ced-9 a l'effet inverse puisque l'absence de la protéine CED-9 entraîne une augmentation de l'apoptose des cellules de l'embryon.
L'étude génétique et moléculaire de ces mutations[17] a montré que les protéines CED-3 et CED-4 sont responsables du déclenchement de l'apoptose et que ced-9 restreint leur effet. Si les trois gènes ced-3, ced-4 et ced-9 sont inactivés, aucune cellule de l'embryon ne subit de mort programmée. La survie des 959 cellules de l'embryon tient donc à un jeu d'équilibre entre les exécuteurs (ced-3, ced-4) et le protecteur (ced-9). Suivant la formulation de Nicole Le Douarin[17] « chaque cellule de l'embryon produit les protéines capables de la tuer. Ne survivent que celles qui sont aptes, pour un temps, à s'opposer à la mise en œuvre du programme de mort ».
Un troisième gène provoquant la mort programmée a été découvert en 1998 par l'équipe de Robert Horvitz. Il s'agit d'egl-1 (pour egg-laying defective) qui avec ced-3 et ced-4 est nécessaire pour réaliser le développement normal de C. elegans. La mutation d'un de ces gènes se traduit par la survie de presque toutes les cellules normalement vouées à disparaître. La protéine egl-1 se lie à celle de ced-9 pour lui interdire son rôle de protecteur.
Les études génétiques de C. elegans ont conduit à l'identification de plus de deux douzaines de gènes dans la spécification des cellules destinées à mourir ou à vivre, dans l'activation du programme de suicide puis l'élimination des cellules mortes (Conradt & Xue[18], 2005). Mais ced-3, ced-4, ced-9 et egl-1 paraissent bien être les acteurs les plus importants du programme de mise à mort.
La mort de certaines cellules embryonnaires se présente dès lors comme un processus naturel activé en certains lieux, à certains moments, par l'expression du gène egl-1.
Des équivalents de ces gènes chez l'homme ont été trouvés : bax,bad,bak et bim pour l'apoptose, et bcl-2,bclxl pour la survie de cellules. Les protéines effectrices de la voie apoptotique sont des enzymes appelées caspases. Ainsi, la protéine produite par ced-3 est une caspase.
Lactation et processus destructif
Une étude parue dans la revue Nature Communications en octobre 2021[19] présente une forme de lactation primitive chez les femelles, couplée à la sénescence, par laquelle la femelle nourrit ses larves au travers de sa vulve[20], et liquéfiant certains de ses organes. Ces individus hermaphrodites pondent plus que leur propre poids en œufs, qu'elles excrètent sous forme de jaune d'œuf ou d'ovocytes encore intacts. Mais elles les fabriquent en faisant fondre leurs propres organes, notamment leurs intestins et leurs muscles. « Les vers se détruisent eux-mêmes dans le processus de transfert des nutriments à leur progéniture...tous ces œufs non fécondés sont pleins de lait, ils agissent donc comme des bouteilles de lait pour aider au transport du lait afin de nourrir les bébés » explique Carina Kern, chercheuse à l'University College London[21].
Résistance
Comme de nombreux nématodes, à certains stades de son développement, ce ver peut produire des larves dauer, plus résistantes et capables de survivre durant plusieurs mois en diapause.
On a retrouvé des spécimens d'étude de C. elegans vivants dans les débris de la navette spatiale Columbia après son accident en février 2003[22].
Pathogènes
Caenorhabditis elegans possède plusieurs pathogènes, incluant:
- des virus:
- Virus Cer1 de Caenorhabditis elegans (CelCer1V), un virus à ARN
- Virus Cer13 de Caenorhabditis elegans, un virus à ARN
- Virus d'Orsay, un virus à ARN[23]
- des champignons microsporidies:
- Nematocida parisii (le tueur de nématodes de Paris)
- des champignons Orbiliomycétes:
- Arthrobotrys oligospora, un champignon capable de capturer les nématodes du sol[24]
Notes et références
- Les modalités de la reproduction et le déterminisme du sexe chez quelques nématodes libres. Nigon V. Ann. Sci. Nat. Zool. Biol. Anim. 1949;11:1–132.
- Moerman DG, Waterston RH Spontaneous unstable unc-22 IV mutations in C. elegans var. Bergerac. Genetics, volume 108, issue 4, pages 859–77, Décembre 1984, , pmc 1224270
- Babity J. M. Tc1 transposition and mutator activity in a Bristol strain of Caenorhabditis elegans|journal=Molecular & General Genetics : Mgg volume 222, issue 1, pages 65–70
- Harris L. J. Structural analysis of Tc1 elements in Caenorhabditis elegans var. Bristol (strain N2). Plasmid, volume= 22; issue 1, pages=10–21, 1989,
- H Ferris, « Caenorhabditis elegans » [archive du ], University of California, Davis, (consulté le )
- (en) Dougherty E.C. and Nigon V., 1949. A new species of the free-living nematode genus Rhabditis of interest in comparative physiology and genetics. j. Parasitol.
- Xuan Ma, Yanmei Zhao, Wei Sun et Katsuya Shimabukuro, « Transformation: how do nematode sperm become activated and crawl? », Protein & Cell, vol. 3, no 10, , p. 755–761 (ISSN 1674-800X, PMID 22903434, PMCID 4875351, DOI 10.1007/s13238-012-2936-2, lire en ligne, consulté le )
- Scott-F Gilbert, Susan-R Singer, Sylvie Rolin (trad), Etienne Brachet (trad.), Biologie du développement, De Boeck,
- (en) L. Byerly, R.C. Cassada et R.L. Russell, « The life cycle of the nematode Caenorhabditis elegans : I. Wild-type growth and reproduction », Developmental Biology, vol. 51, no 1, , p. 23-33
- Élisa Doré, « Chez certains vers, l’influence du stress se transmet à la descendance », Pour la Science, (lire en ligne
 )
) - (en) Lauren A. Neal1 et Leslie B. Vosshall, « Eyeless worms detect color », Science, vol. 371, no 6533, , p. 995 (DOI 10.1126/science.abg5201).
- (en) D. Dipon Ghosh, Dongyeop Lee, Xin Jin, H. Robert Horvitz et Michael N. Nitabach, « C. elegans discriminates colors to guide foraging », Science, vol. 371, no 6533, , p. 1059-1063 (DOI 10.1126/science.abd3010).
- Nobelprize.org, « The Nobel Prize in Physiology or Medicine 2002 », (consulté le )
- (en) Guerra M., Cabral G., Cuacos M., González-García M., González-Sánchez M., Vega J. & Puertas M., 2010. Neocentrics and holokinetics (holocentrics): chromosomes out of the centromeric rules. Cytogenet. Genome Res., vol. 129, nos 1-3, pp. 82–96, , DOI 10.1159/000314289.
- Greer E, Maures T, Ucar D, et coll. Transgenerational epigenetic inheritance of longevity in Caenorhabditis elegans. Nature 2011, 479:365-71.
- Adam Klosin1, Eduard Casas, Cristina Hidalgo-Carcedo, Tanya Vavouri & Ben Lehner (2017) Transgenerational transmission of environmental information in C. elegans, Science News, 21 avril 2017:Vol. 356, Issue 6335, pp. 320-323 DOI: 10.1126/science.aah6412
- Nicole Le Douarin, Les cellules souches, porteuses d'immortalité, Odile Jacob,
- Barbara Conradt, Ding Xue, « Programmed cell death », WormBook, ed. The C. elegans Research Community, WormBook, (DOI 10.1895/wormbook.1.32.1)
- (en) Carina C. Kern et al., « C. elegans feed yolk to their young in a form of primitive lactation », sur nature.com, (consulté le )
- « « Improbablologie : Les vers ronds font fondre leurs organes pour gicler du lait de leurs vulves pour leurs petits.» Le journal des Sciences, La Méthode scientifique, France Culture », sur Franceculture.fr (consulté le )
- (en) « Roundworms Melt Down Their Organs to Squirt Milk From Their Vulvas For Their Young », sur sciencealert.com, (consulté le )
- (en) « Worms survived Columbia disaster », BBC News, (lire en ligne)
- (en) Félix M.-A., et al., 2011. Natural and experimental infection of Caenorhabditis nematodes by novel viruses related to nodaviruses. PLoS Biol, 9(1), page e1000586, DOI 10.1371/journal.pbio.1000586.
- (en) Varvara D.Migunova & Boris A.Byzov, 2005. Determinants of trophic modes of the nematophagous fungus Arthrobotrys oligospora interacting with bacterivorous nematode Caenorhabditis elegans. Pedobiologia, Volume 49, Issue 2, 31 March 2005, Pages 101-108, DOI 10.1016/j.pedobi.2004.08.003.
Voir aussi
Bibliographie
_(20139214309).jpg.webp)
- Maupas, « Modes et formes de reproduction des nématodes », Archives de Zoologie Expérimentale et Générale, vol. 8, , p. 463-624
Articles connexes
Liens externes
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- TAXREF (INPN)
- (cs + en) BioLib
- (en) EPPO Global Database
- (en) EU-nomen
- (en) European Nature Information System
- (en) Fauna Europaea
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) NBN Atlas
- (en) Système d'information taxonomique intégré
- (en) The Taxonomicon
- (en) World Register of Marine Species
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Référence Catalogue of Life : Caenorhabditis elegans (Maupas, 1899) Dougherty, 1953 (consulté le )
- (en) Données génomiques de Caenorhabditis elegans sur Ensembl (site visité le 12 avril 2022).