Milieu de culture
Un milieu de culture est un support qui permet la culture de cellules, de bactéries, de levures, de moisissures afin de permettre leur étude. En principe, les cellules trouvent dans ce milieu les composants indispensables pour leur multiplication en grand nombre, rapidement, mais aussi parfois des éléments qui permettront de privilégier un genre bactérien ou une famille. Ainsi, selon le but de la culture, il est possible de placer les micro-organismes dans des conditions optimales, ou tout à fait défavorables.
Il se compose d'une base (agar-agar, eau, minéraux, etc.) ainsi que d'un indicateur coloré de pH ou de réaction d'oxydoréduction pour permettre de formuler des hypothèses sur le genre.
Il existe aussi des bouillons de culture qui possèdent la même fonction, mais ces milieux ne contiennent pas d'agar-agar, ils sont donc totalement liquides.
Cet article détaille les caractéristiques des milieux de culture se rapportant à la microbiologie.
Notion de milieu minimum
Un milieu minimum ou milieu défini est un milieu comportant les éléments chimiques strictement nécessaires à la croissance bactérienne, sous une forme utilisable par des bactéries n'ayant pas d'exigence particulière.
Composition d'un milieu minimum :
- une source de carbone et d'énergie, généralement le glucose ;
- une source de potassium et de phosphore : K2HPO4 ;
- une source d'azote et de soufre : (NH4)2SO4 ;
- une source de magnésium : MgCl2 ;
- une source de calcium : CaCl2 ;
- une source de fer : on emploie le citrate de fer (le citrate a pour rôle de maintenir le fer en solution) ;
- une source d'oligo-éléments : sels de Cu, Zn, Co, Ni, B, Ti ;
- une source d'eau, indispensable à toute forme de vie : on utilise l'eau distillée (stérile) ;
- un tampon pH : il permet de maintenir un pH correct voire optimum : KH2PO4 par exemple.
En l'absence de l'un de ces composants, les bactéries ne se développent pas, car elles ne peuvent synthétiser ces produits. C'est l'adjonction de facteurs de croissance appropriés qui permet à des bactéries exigeantes de se développer.
Milieu de culture empirique
Un milieu de culture dit « empirique » est un milieu contenant des produits d'origine naturelle et dont on ne connaît pas exactement la composition.
Milieu cœur-cervelle
Dans le milieu type cœur-cervelle, il y a de l'eau, de l'agar-agar, de l'hydrolysat de cœur et de cervelle sans que l'on en connaisse les aspects qualitatifs et quantitatifs. Il sera donc utilisé uniquement pour la croissance des bactéries. Il n'a pas d'effet sélectif.
Embryon de poulet
Les premières recherches sur les virus, à partir des années 1930, utilisent comme milieu de culture l'œuf de poule embryonné. L'agent à multiplier est inoculé dans les membranes amniotiques ou allantoïques. Dans ce système ont pu être étudiés les virus de la variole, de l'herpès, de la grippe, des oreillons, de la rage, etc., ainsi que des bactéries intracellulaires comme les rickettsies[1]. Dans les années 1950, ce système a été le plus souvent supplanté, dans les laboratoires de recherche, par la culture cellulaire. Il reste utilisé pour la production du vaccin antigrippal.
Milieu de culture sélectif
Les milieux de culture dits « sélectifs » permettent uniquement la culture de certains genres de micro-organismes. Pour cela, on ajoute des éléments qui inhibent la croissance des micro-organismes indésirables comme le chlorure de sodium à forte concentration, le thiosulfate de sodium, le cristal violet ou certains antibiotiques.
Les éléments ajoutés sont sélectionnés selon les caractéristiques du micro-organisme recherché. Ces milieux sont utilisés pour l'analyse d'un prélèvement polybactérien. Ce milieu permet de sélectionner uniquement en cas de crible positif : résistance à un antibiotique, la prototrophie, etc.
Exemples de milieux sélectifs :
- milieu SS : il ne permet la croissance que des Salmonelles (Shigella s'y développe moins vite : environ 48 à 72 heures avant d'obtenir une culture exploitable) ;
- milieu de Sabouraud : il permet la pousse des mycètes ;
- gélose Kanamycine - Vancomycine, dite « Kana-Vanco » ou « KV » : elle empêche la pousse des bactéries à Gram positif (action de la vancomycine) et de la plupart des entérobactéries (action de la Kanamycine). Sur ce milieu, poussent préférentiellement des bactéries anaérobies strictes.
Milieu de culture enrichi

Les milieux de culture enrichis contiennent, outre les composants de base, des composants indispensables aux bactéries, que celles-ci ne peuvent pas synthétiser. Ce sont des milieux utilisés pour l'obtention des bactéries dites « exigeantes » et auxotrophes. Par exemple : les milieux au sang frais (le sang est riche en nutriments divers comme le fer, principal facteur de croissance des bactéries) : gélose au sang frais ou cuit. Les milieux avec du sérum, du jaune d'œuf : gélose Baird Parker ou dite « BP ».
Milieu différentiel
Le milieu de culture dit « différentiel » ou « indicateur » permet de distinguer deux types de microorganismes se développant dans un même milieu[2]. Ce type de milieu met en évidence certaines caractéristiques biochimiques des microorganismes (principalement l'aptitude à dégrader un substrat) en présence d'indicateur(s) de la réaction chimique : des indicateurs colorés de pH ou d'oxydoréduction (tels que le rouge neutre, rouge de phénol, l'éosine ou le bleu de méthylène).
On retrouve parmi les milieux différentiels :
- les géloses CLED et BCP et qui différencient la dégradation du lactose, ainsi que la dénomination indirecte d'E. coli qui sont des entérobactéries hyper-résistantes ;
- la gélose éosine bleu de méthylène (EMB), qui différencie la fermentation du lactose de celle du saccharose ;
- la gélose MacConkey (MCK), qui différencie la fermentation du lactose. De plus, cette gélose est sélective (voir plus haut) dans la mesure où elle ne permet que la croissance des bacilles à Gram négatif. La gélose Drigalski possède les mêmes propriétés ;
- la gélose Chapman (MSA), milieu sélectif des staphylocoques qui différencie la fermentation du mannitol permettant une orientation entre autres vers Staphylococcus aureus ;
- la gélose Hektoën, qui différencie la fermentation de trois glucides (lactose, saccharose et salicine) ainsi que la production de sulfure d'hydrogène. Cette gélose est sélective des bacilles à Gram négatif, elle est particulièrement adaptée à la recherche d'entérobactéries pathogènes dans les selles ;
- les géloses SS, XLD, DCL, TCBS sont aussi des milieux différentiels couramment utilisés.
Milieu chromogène (ou discriminant)
Ce milieu peut être sélectif ou non. Son principe repose sur la présence d'un ou plusieurs substrat(s) couplé(s) à une molécule chromogène. Lorsque ce substrat est métabolisé par une enzyme bactérienne spécifique, le chromogène associé prend une couleur particulière (il devient un chromophore) directement lisible sur la colonie. Si l'enzyme n'existe que chez une espèce bactérienne donnée, l'identification est immédiate.
Parmi ces milieux, on trouve :
- CPS E : milieu non sélectif adapté au diagnostic des infections urinaires. Il permet la mise en évidence de l'activité bêta-glucuronidase présente chez Escherichia coli (colonies rose-bordeaux) responsable de 80 % des cystites en France (40 % à l’hôpital) ; la mise en évidence de l'activité bêta-glucosidase chez les entérocoques (colonies bleu turquoise) et certaines entérobactéries (Klebsiella, Enterobacter, Serratia et Citrobacter : groupe KESC) (colonies vert-bleu). Le milieu permet aussi une orientation vers Proteus grâce à la mise en évidence de l'activité tryptophane désaminase (colonies entourées d'une zone de précipitation brune) ;
- SM2 : milieu sélectif des bactéries à Gram négatif qui permet la mise en évidence de Salmonella dans les selles grâce à la révélation d'une activité estérase spécifique des salmonelles ;
- CAN2 : milieu sélectif des levures qui permet la mise en évidence de Candida albicans par la mise en évidence de l'activité hexosaminidase ;
- autres milieux chromogènes : SAID pour Staphylococcus aureus, MRSA pour la recherche des SARM, ESBL pour la recherche des BLSE, STRB pour la recherche des streptocoques du groupe B.
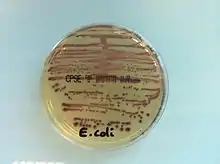 Culture d'Escherichia coli sur CPS E à partir d'une urine.
Culture d'Escherichia coli sur CPS E à partir d'une urine. Culture d'Enterococcus faecalis sur CPS E à partir d'une urine.
Culture d'Enterococcus faecalis sur CPS E à partir d'une urine. Culture de KESC sur CPS E à partir d'une urine.
Culture de KESC sur CPS E à partir d'une urine. Culture de Proteus sur CPS E à partir d'une urine.
Culture de Proteus sur CPS E à partir d'une urine.
Contrôle des milieux
Depuis 2014, la norme ISO 1133 impose des contrôles sur la performance des milieux. Ceci sont à réaliser à des fréquences régulières telles que :
- pour les fabricants : tous les lots ;
- pour les laboratoires : tous les ans pour les milieux pré-coulés et tous les trois mois ou à chaque changement de lot pour les milieux fabriqués sur place.
Articles connexes
Notes et références
- Claude Chastel, Histoire des virus, de la variole au sida, Paris, Boubée, , 413 p. (ISBN 2-85004-068-1), p. 78-79.
- (en) Washington J.A., Baron's Medical Microbiology (Baron S et al., eds.), Galveston, University of Texas Medical Branch, , 4e éd., relié (ISBN 978-0-9631172-1-2, LCCN 95050499, lire en ligne), « Principles of Diagnosis ».