Tryptophane désaminase
L'enzyme
La tryptophane désaminase (TDA) est une oxydoréductase capable de catalyser la libération du groupement amine primaire du tryptophane (W) avec production d'acide indole-pyruvique (AIP), d'ammoniac (ou d'ammonium en fonction du pH) et d'un coenzyme réduit, selon la réaction :
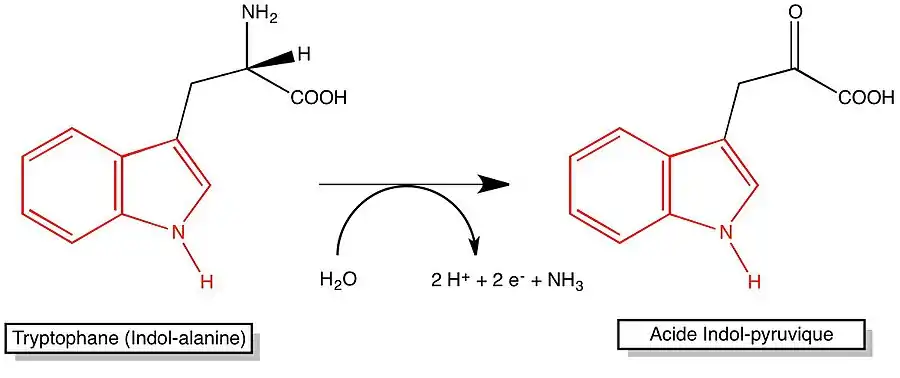
L'acide indole-pyruvique est mis en évidence par sa complexation en un composé marron foncé en présence d'ions fer III (ferriques, ).
Milieu et technique
Le milieu classique est le milieu Urée-Tryptophane (Urée-Indole) contenant le L-tryptophane, de l'urée, du rouge de phénol, un peu d'éthanol solvant du tryptophane.
Une suspension est réalisée dans ce milieu. Plus elle est dense, plus la réaction est rapide : elle peut être lue en moins de deux heures.
Pour mettre en évidence la TDA, quelques gouttes de chlorure de fer III sont ajoutées (le réactif, jaune, est en solution dans l'acide chlorhydrique pour éviter la précipitation de l'hydroxyde de fer III). Un composé marron apparait quand l'acide indol-pyruvique est présent. Une uréase +, qui alcalinise le milieu, ne gène pas la lecture à cause de l'acidification due au réactif. Quand la réaction est négative, le milieu est jaune.
En galerie API20E la lecture est identique. Le milieu ne contient que du tryptophane.

Application
La TDA comme la PDA caractérise un groupe d'Entérobactéries (Proteus, Providencia, Morganella, Tatumella).
Voir aussi
Articles connexes
Bibliographie
- Dictionnaire des techniques - Microbiologie technique - CRDP d'Aquitaine (voir www.reseau-canope.fr/) - Jean-Noël JOFFIN - Guy LEYRAL†
