Variole
La variole ou petite vérole était une maladie infectieuse d'origine virale, très contagieuse et épidémique, due à un poxvirus. Le mot variole vient du latin variola, -ae (qui signifie « petite pustule », avec l'influence du mot varius, « varié, bigarré, tacheté, moucheté »). En effet, la variole se caractérise en quelque sorte par un « mouchetage de pustules ». La variole a été responsable jusqu'au XVIIIe siècle de dizaines de milliers de morts par an rien qu'en Europe.
| Causes | Variola virus (d) |
|---|---|
| Incubation min | 7 j |
| Incubation max | 17 j |
| Symptômes | Fatigue, exanthème, céphalée, douleur abdominale, vomissement, phlyctène, pimple (en), fièvre et cicatrice |
| Médicament | Metisazone (en) et tecovirimat (en) |
|---|---|
| Spécialité | Infectiologie |
| CISP-2 | A76 |
|---|---|
| CIM-10 | B03 |
| CIM-9 | 050 |
| DiseasesDB | 12219 |
| MedlinePlus | 001356 |
| eMedicine | 830328 |
| MeSH | D012899 |
| MeSH | D012899 |
| Patient UK | Smallpox |
![]() Mise en garde médicale
Mise en garde médicale
La variole a été déclarée éradiquée en 1980[1], grâce à une campagne de l'Organisation mondiale de la santé (OMS) combinant des campagnes de vaccination massive, dès 1958, avec une « stratégie de surveillance et d'endiguement », mise en œuvre à partir de 1967. Au XXIe siècle, seuls des échantillons de ce virus sont conservés à des fins de recherche par des laboratoires habilités par l'OMS.
La variole est surnommée « petite vérole », et c'est en référence à cette maladie que la syphilis a été surnommée « grande vérole », mais les deux maladies n'ont rien en commun étiologiquement.
Étymologie
Le substantif féminin variole (prononcé [vaʁjɔl]) est un emprunt au bas latin médical variola[2] - [3] - [4], terme utilisé pour la première fois par Marius d'Avenches pour qualifier une épidémie sévissant en France et en Italie en 570[5]. Le terme variola (« maladie tachetée ») est un diminutif dérivé de varius (tacheté, varié, changeant) et varus (pustule)[5].
Description clinique

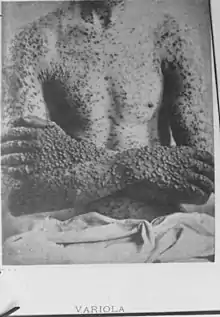
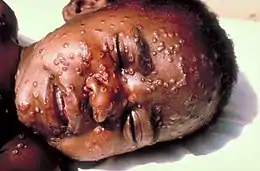
La variole se présente sous l'aspect d'une dermatose pustuleuse, qui peut ressembler à une forme grave de varicelle, mais qui évolue en une seule poussée (toutes les lésions sont identiques, étant de même âge). La variole était un fléau redouté. Elle tuait un malade sur cinq (chez les adultes, près d’un malade sur trois). Quand elle ne tuait pas, elle laissait souvent un visage grêlé, marqué à vie. Elle est toujours restée hors de portée d’un traitement efficace.
Forme classique
La forme classique ou variole régulière dite aussi ordinaire (80-90 % des cas) connaît trois sous-types : la forme confluente (éruption cutanée sur tout le corps), la forme semi-confluente (éruption cutanée presque exclusivement sur le visage) et la forme discrète (pustules très clairsemées).
Début
Silencieuse, la période d'incubation est en moyenne de 12 jours (extrêmes 7 à 17 jours).
La phase d'invasion est brutale et aiguë, durant trois jours. Elle comporte une fièvre très élevée, à 40 °C ou plus, de grands frissons, un syndrome douloureux (maux de tête, douleurs dorsales), des nausées et vomissements fréquents.
Une éruption précoce transitoire (rash) de divers types, généralisée ou localisée, peut survenir durant cette phase de début. En dehors d'un contexte épidémique, le diagnostic clinique n'est pas possible à ce stade[6].
Phase éruptive
Au début de cette phase, lors de l'apparition de l'éruption définitive, la fièvre et les autres symptômes s'atténuent le plus souvent[7].
Vers le quatrième jour de la maladie, un exanthème érythémateux (taches rouges) apparaît à la face (front et tempe) et aux extrémités des membres (notamment aux poignets). Il s'étend en une seule poussée éruptive : tous les éléments sont au même stade évolutif dans un même territoire cutané. L'extension se fait du visage et des extrémités (mains et pieds), où les éléments sont les plus nombreux, vers le tronc. Cette distribution est dite centrifuge, elle se fait en deux ou trois jours.
Cet exanthème peut s'accompagner, ou être précédé, d'un énanthème (langue, pharynx) évoluant vers des vésicules rapidement érodées avec ulcérations douloureuses[7].
Chaque élément éruptif est d'abord une macule, puis une papule de 2 à 3 mm, devenant une vésicule de 2 à 5 mm au troisième jour de l'éruption. Ces vésicules sont enchâssées dans le derme comme une « perle dans un chaton », elles sont très dures à la palpation, donnant l'impression d'un grain de plomb. Elles sont emplies d'une sérosité claire[6] - [8].
À partir du cinquième jour de l'éruption, le liquide des vésicules se trouble. Les vésicules évoluent en pustules, de 4 à 6 mm, reposant sur une base très inflammatoire. Elles tendent à se déprimer en leur centre (ombilication). Le stade de pustule ombiliquée était historiquement la phase critique, celle où la fièvre et les douleurs revenaient, et où la mort pouvait survenir[6].
Phase de dessiccation
À partir du huitième jour de l'éruption, les pustules se dessèchent, soit par rupture (croûte jaunâtre d'aspect mielleux), soit sans rupture (croûte noire ou brune). Cette phase s'accompagne d'une chute définitive de la fièvre pour se terminer entre le 15e et le 30e jour de l'éruption. La convalescence est longue. Chaque élément peut laisser une cicatrice déprimée, blanche et définitive (indélébile)[7] - [6].
L'étendue de l'éruption est variable, présumant de l'évolution (une éruption de plus grande ampleur est un critère de gravité). Les dernières lésions à persister sont celles de la paume des mains et de la plante des pieds[8].
Complications
Les complications les plus courantes étaient les surinfections bactériennes cutanées, pulmonaires et oculaires, ainsi que le sepsis généralisé.
Les principaux organes atteints étaient les reins, les articulations, le cœur (myocardite) et le système nerveux (encéphalite, neuropathies…). L'encéphalite de la variole survient dans environ 1 cas sur 500[9].
Chez la femme enceinte, la variole entraine l'avortement ou l'accouchement prématuré, l'enfant pouvant naitre infecté et porteur de lésions cutanées[9].
Les séquelles les plus communes étaient les cicatrices du visage, présentes chez 65 à 80 % des survivants, puis la cécité par atteinte oculaire (1 % des survivants), et les déformations des membres par lésion articulaire ou cutanée (2 % des enfants survivants)[8].
Autres formes
La classification de l'OMS distingue 5 formes principales[9], les trois premières survenant chez les non-vaccinés, les deux dernières pouvant se voir chez les sujets déjà vaccinés :
- Variole classique ou ordinaire : elle représentait près de 90 % des cas survenant chez les non-vaccinés, avec une létalité de 30 %.
- Variole plate ou maligne : 6 à 7 % des cas non-vaccinés, les éléments ne dépassent pas le stade vésiculeux, les autres signes restent intenses, la mort survenant dans la première semaine (taux de létalité de 97 %).
- Variole hémorragique (variole noire): 2 à 3 % des cas non-vaccinés, avec hémorragies cutanées et des muqueuses, surtout chez la femme enceinte, avec une létalité de 96 %. Les auteurs français distinguaient dans ces formes hémorragiques, la variole foudroyante mortelle avant toute éruption (présence unique d'ecchymoses), et la variole noire éruptive avec purpura extensif, de couleur lie de vin[6].
- Variole modifiée ou « varioloïde » : elle ressemble à la variole ordinaire, mais peu intense, avec une éruption plus faible, d'évolution plus courte et plus rapide, avec une létalité proche de zéro.
- Variole sans éruption, sine eruptione : l'infection n'est prouvée que par examen de laboratoire. Les sujets n'ont pas de symptômes ou alors seules la fièvre et les douleurs sont présentes. Elle pouvait se voir chez les personnes hyperimmunisées et les nourrissons encore protégés par des anticorps maternels. Cette forme n'est pas transmissible[8].
Alastrim
Ce nom vient du portugais alastrar signifiant ce qui se propage vite et fort[10].
L'alastrim ou variole mineure, variola minor est due à un virus variolique très proche de celui de la variole majeure, mais moins virulent. La maladie est moins intense, plus courte, laissant peu ou pas de cicatrices, avec une létalité inférieure à 1 %. Elle est très contagieuse, mais un malade atteint d'alastrim ne transmet que l'alastrim et jamais la variole majeure[7].
Cette forme se rencontrait surtout en Amérique du Sud et en Afrique du Sud. Elle a d'abord été observée en 1904 chez les Cafres sous le nom de variole des Cafres, variole blanche ou laiteuse (Kaffir milk-pox)[7] - [11].
Diagnostic
Positif

Le diagnostic positif était purement clinique et relativement facile en contexte épidémique. Au cours du XXe siècle, il devient plus difficile avec la rareté de la maladie (dernier cas autochtone en France en 1936). Lors de la dernière épidémie française à la suite d'un cas importé (Vannes, 1954), les premiers cas ont été considérés comme des varicelles graves, et la variole suspectée après le premier décès[12].
À partir des années 1950, le diagnostic virologique est principalement fait, de façon rapide en quelques heures par examen au microscope électronique du liquide vésiculaire, et confirmé de façon spécifique par culture du virus sur œuf embryonné (délai de 2 à 3 jours).
Au début du XXIe siècle, le diagnostic virologique se fait par techniques moléculaires de PCR, qui permet de préciser la nature exacte de la souche virale. Les tests sérologiques ne sont guère utiles dans la variole, car ils ne permettent pas de distinguer entre les différents orthopoxvirus[13].
Différentiel
Au stade pré-éruptif, peuvent se discuter une grippe, une méningite, et diverses fièvres tropicales (paludisme, arboviroses…).
Au début de l'éruption, le diagnostic différentiel doit être fait avec la varicelle. Dans le cas de la variole, la fièvre précède de quelques jours l’éruption alors que pour la varicelle, la fièvre est concomitante de l'éruption. Dans la varicelle, les lésions se font en plusieurs poussées successives, il peut y avoir en même temps les quatre types de lésions, d'âges différents dans un même territoire[14]. L'apparition des croûtes dans la varicelle est plus rapide, les éléments déjà crouteux coexistant avec des éléments jeunes. La distribution des lésions dans la varicelle est variable et désordonnée, elle n'est pas centrifuge comme dans la variole. Les vésicules de la varicelle sont superficielles, alors que celles de la variole sont enchâssées (implantées dans le derme).
Il faut aussi éliminer les autres dermatoses bulleuses[6].
Virus

Histoire et évolution du virus
Selon les données génomiques[15] disponibles, la variole humaine regroupe deux types de souches dites majeures (hautement pathogènes) et mineures.
Les virus « majeurs » semblent originaires d'Asie, certains isolats humains ayant toutefois une origine africaine[15].
Les virus mineurs proviendraient d'Amérique du Sud et d'Afrique de l'Ouest. Tous ces virus auraient divergé assez récemment (16 000 ans à 68 000 ans) à partir d'un ancêtre commun, poxvirus, dont les hôtes supposés auraient été des rongeurs africains. On ignorait encore en 2010 si le virus mineur est un mutant du virus majeur, ou si au contraire le majeur en est une forme plus pathogène apparue ensuite, ou si ces deux virus proviennent d'une autre souche disparue[15].
Sur les mêmes bases (génomique du virus), les virologues ont estimé que, d'après son taux moyen de mutation (d'environ 10−6 substitutions nucléotidiques par site et par an), selon ce chiffre, le virus humain aurait commencé à évoluer de façon indépendante il y a environ 3 400 (± 800) ans[15].
L'ancêtre commun aux orthopoxvirus actuels est inconnu, mais pourrait être apparenté aux souches actuelles de virus de la variole bovine (ou la vaccine)[15] ou cowpox.
En mars 2004, des échantillons de virus variolique furent découverts à Santa Fe dans une enveloppe insérée entre les pages d'un livre de médecine datant de la guerre de Sécession ; ces échantillons font l'objet d'analyse par le CDC pour comprendre l'histoire de la variole au cours des siècles.
En novembre 2012, le virus est détecté dans le corps gelé d'une femme morte dans les années 1730 en Sibérie. L'intérêt pour la recherche est notamment de montrer la rapide évolution du virus[16].
Variole humaine

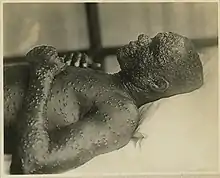
Le virus de la variole fait partie des poxvirus. Il en existe deux variantes humaines, Variola minor et Variola major (cette dernière étant communément appelée Variole classique ou encore Variole asiatique)[17] difficilement distinguables en laboratoire, mais présentant pourtant des taux de létalité très différents (respectivement 1 et 30 %) ce qui a pu faire douter de l'unicité des maladies. L'existence de deux formes de variole était pressentie depuis l'époque d'Edward Jenner au XIXe siècle, mais ce n'est qu'à partir de 1929 que le terme de Variola minor s'impose. Pour Variola minor, on distingue encore Variola alastrim, propre à l'Amérique du Sud, du Variola minor trouvé en Afrique : il fut un temps proposé d'y voir deux espèces différentes mais cela ne fut pas retenu[18]. S'il y a de légères différences de formes cliniques entre les infections par variole mineure et variole majeure, ces dernières ne peuvent être véritablement distinguées que par la constatation des taux de létalité ou par des analyses de laboratoire. La variole majeure, qui prédominait dans le monde jusqu'à la fin du XIXe siècle, laissant la place à la variole mineure, ne subsistait plus qu'en Asie en 1971. Le virus est très stable et peut subsister des années dans des croûtes. Dans la plupart des conditions naturelles toutefois, le virus, s'il subsiste, ne conserve son pouvoir pathogène guère plus que quelques semaines.
Des corpuscules furent observés par John Brown Buist en 1887[19] puis de nouveau par Enrique Paschen en 1906[19] tandis qu'Amédée Borrel avait observé des corpuscules semblables dans des tissus d'oiseaux infectés de variole aviaire en 1904. En 1903, il était encore question de « streptocoque variolique ». Eugène Woodruff et Ernest William Goodpasture montreront en 1929 que ces inclusions contenaient des virus de la variole[20].
Varioles animales
Si la variole est une maladie exclusivement inter-humaine, il existe des virus génétiquement proches (famille poxviridae, genre orthopoxviridae) affectant divers animaux, donnant des maladies de gravité variable.
- Le cowpox est relativement bénin, il touche les bovins, les rongeurs, le chat et l'homme.
- Le virus de la vaccine, duquel le mot « vaccin » est originaire, appelé aussi virus vaccinal, n'est pas un virus naturel. C'est un virus dérivé du cowpox, qui évolue de façon autonome pour son propre compte depuis près de deux siècles[21]. Il a pour origine probable des contaminations accidentelles de laboratoire (échange de gènes avec le virus de la variole) à Londres vers 1800[22]. Le vaccin a été fabriqué à l'origine à partir de lésions cutanées de vaches inoculées par la vaccine (ou cowpox en anglais). La pulpe vaccinale ainsi obtenue, broyée et tamisée, était inoculée par scarification cutanée aux patients. La toute première vache qui a permis à Edward Jenner de produire ce nouveau vaccin en 1796 était nommée Blossom. Ses cornes sont visibles au musée Edward Jenner (en) à Berkeley en Angleterre.
- Le monkeypox, orthopoxvirus simien ou virus de la variole du singe, dont le réservoir est constitué des rongeurs et écureuils des forêts ombrophiles d'Afrique centrale et occidentale, peut se transmettre occasionnellement à l'homme (en contact avec ces rongeurs). Les manifestations cliniques du monkeypox chez l'homme sont analogues à celles de la variole (éruption pustuleuse, fièvre, symptômes respiratoires), avec une mortalité de l'ordre de 3 %[21] (1 à 10 % en Afrique[23]). La transmission inter-humaine était très faible, mais est en augmentation depuis les années 2000.
- Orthopoxvirus cameli (virus de la variole des camélidés) touche les chameaux et dromadaires (camélidés de l'Ancien Monde, Afrique et Asie). La maladie humaine est bénigne (lésions cutanées aux mains), et peu fréquente (1 chamelier sur 20 000)[24].
- La variole aviaire (fowlpox) est due à plusieurs virus de cette famille, mais du genre Avipoxvirus (en).
- Le virus de l'ectromèlie[25] infectieuse ou « variole de la souris », est une maladie mortelle, épidémique et contagieuse chez les souris et qui se caractérise par la gangrène d'une patte.
Épidémiologie
Mode de transmission
Il s'agit d'une maladie exclusivement inter-humaine. Il n'y a aucun réservoir de virus animal et pas de transmission par les insectes.
La variole se transmet de personne à personne par voie respiratoire rapprochée (postillons, aérosols, etc.) à partir des voies aérodigestives supérieures des personnes infectées et par contact cutané direct à partir des lésions cutanées.
Le varioleux est contagieux dès le début de la maladie (à partir de l'apparition des premiers symptômes), le virus étant déjà présent en quantité importante dans ses voies supérieures. Cette présence est maximum durant la première semaine de la phase éruptive, le malade excrétant des virus jusqu'au 14e jour de la maladie. La transmission était particulièrement élevée au sein des familles[26] (et moins au sein d'une communauté), car la variole est une maladie qui, dès son début, force le malade à s'aliter. Il n'y a pas de transmission durant la phase d'incubation, ni de transmission par porteur sain ou sans symptômes.
Au niveau des lésions cutanées, le virus reste présent contagieux jusqu'à plus de deux semaines après le début de l'éruption, et peut se communiquer par contact direct jusqu'à la disparition totale des croûtes. La literie et les vêtements d'une personne infectée sont source d'infection et doivent être passés à l'autoclave, sinon les croûtes infectées ou les vêtements infectés pourraient être contagieux indirectement à longue distance, ou longtemps après. Toutefois cette dernière contagiosité est contestée, le virus ne pouvant survivre longtemps à l'extérieur à température ambiante habituelle[27]. Des cas de contamination à la suite de blessures provoquées par du matériel souillé ont également été constatés.
Le virus pouvait être transmis aux personnes en contact avec un sujet vacciné par variolisation, procédé abandonné en Europe au début du XIXe siècle, mais encore en usage dans les années 1970 en Afghanistan et en Éthiopie[27].
Pathogenèse
La dose infectieuse de la variole n'est pas connue, mais elle est estimée très faible, de l'ordre de quelques virions[28].
La porte d'entrée est, usuellement, celle des voies respiratoires, même si d'autres voies de contamination sont possibles. Une première réplication virale se fait au niveau de l'épithélium des bronches, sans occasionner aucun symptôme. Le virus se diffuse ensuite dans le système réticulo-endothélial, et se multiplie dans les ganglions lymphatiques. Une virémie, toujours asymptomatique, se produit au 3e jour de l'incubation, avec multiplication du virus dans la rate et la moelle osseuse.
Une deuxième virémie se produit quelques jours plus tard en provoquant les premiers signes de la maladie (forte fièvre, douleurs). La première lésion se situe fréquemment au niveau du pharynx, permettant ainsi le relargage des virus dans l'atmosphère. La phase éruptive débute lorsque la peau est atteinte par transfert du virus à ce niveau par les macrophages. Les lésions seraient plus importantes à la face et aux extrémités parce que le virus se multiplie d'autant mieux à des températures inférieures à 37 °C[9].
Les anticorps neutralisants commencent à apparaitre vers le 6e jour de la maladie. Ils persistent plusieurs années, puis une immunité à médiation cellulaire prend le relais.
La maladie, si elle ne tue pas le patient, est immunisante : toute réinfection par le même virus est impossible pendant des années voire des décennies. D'autres sources affirment que l'immunité est durable à vie[1], c'est-à-dire tant qu'il reste immuno-compétent.
Les incertitudes de pathogenèse tiennent au fait que les méthodes d'études qui permettraient de les lever n'ont été mises au point qu'à partir des années 1980-1990, c'est-à-dire après l'éradication mondiale de la variole. Ainsi, il est probable que les cas de variole maligne ou hémorragique surviennent à la suite d'un défaut de la réponse immunitaire. De même, la vaccination antivariolique est contre-indiquée chez le sujet immuno-déficient, susceptible de multiplier et excréter du virus vaccinal[28].
Létalité
La létalité était due à la réplication du virus lui-même mais aussi aux surinfections microbiennes notamment cutanées et pulmonaires.
La réplication du virus entraine une toxémie (accumulation de produits nocifs dans le sang), faite de complexes immuns circulants et d'antigènes varioliques solubles[9]. La mort survient par œdème aigu du poumon, choc septique ou collapsus cardiovasculaire.
L'antibiothérapie a permis de réduire la létalité de la variole due aux surinfections microbiennes.
La létalité dépend du virus (souche virale, dose infectieuse) et de l'état immunitaire du malade (plus ou moins immunisé, plus ou moins immunocompétent). Pour la variole mineure (alastrim) et les sujets vaccinés à jour et immunocompétents, elle était inférieure à 1 %. Pour la variole majeure et classique de 15 à 30 % au XXe siècle (près du double aux siècles précédents) et plus de 90 % pour les formes les plus graves[26].
Traitement
Il n'existait pas de traitement spécifique des personnes infectées dont, éventuellement, les symptômes peuvent être soignés.
- On a autrefois utilisé des onguents puis une méthode dite méthode ectrotique inventée par M. Serres pour la « cautérisation en masse » des boutons induits par la variole sur le visage (pour le traitement de la syphilis, à base de mercure ou d'une solution de nitrate d'argent concentré). Ces médications ont souvent été contestées, leurs détracteurs notant qu'elles posaient de graves problèmes de toxicité pour les patients (qui mouraient plus nombreux parmi ceux qui étaient traités que parmi les non-traités). Les premiers développaient souvent des symptômes dits « d'arachtinis » et parfois mouraient. Les mauvais résultats de ce traitement ont au XIXe siècle rapidement mis en question cette méthode et toutes celles faisant usage de mercure et d'arsenic[29].
- Dans les années 1950, un antiviral a été utilisé, la méthisazone, qui fut surtout utilisé pour soigner certaines complications vaccinales.
- Le traitement préventif éprouvé est la vaccination, qui s'est largement diffusée en Europe au XIXe siècle.
- La vaccination a pu également être faite en post-exposition : l'efficacité de cette pratique, qui dépend de sa précocité, fait l'objet de discussions.
La vaccination antivariolique peut entraîner des complications, ce qui représente une difficulté dans le cadre des plans de lutte contre les attaques bioterroristes[30]. Les principales complications sont : vaccine généralisée, eczéma vaccinatum, vaccine progressive, encéphalite post-vaccinale. Les complications sont graves chez les sujets immuno-déprimés ou atteints d'eczéma.
Le tecovirimat inhibe la protéine P37 fabriquée uniquement par les orthopoxvirus et permet une guérison de la plupart des formes animales de la maladie[31].
Histoire de la maladie
La maladie serait apparue de façon sporadique, dans les villages du néolithique, à partir de la domestication ou d'une proximité animale (ancêtre commun du virus humain et d'autres animaux, comme celui de la variole du singe, la vaccine (bovidés et équidés), ou la variole des camélidés)[32] - [33].
Une population minimale de 200 000 habitants serait nécessaire pour maintenir une circulation permanente de virus variolique (variole endémique ou épidémique). Cette densité humaine a été atteinte par plusieurs civilisations antiques, d'abord en Égypte et au Moyen-Orient[33].
La variole serait donc apparue vers le IVe millénaire av. J.-C. selon les données épidémiologiques et historiques[34] et il y a 3 400 ± 800 ans selon les données d'horloge moléculaire[15].
Deux origines géographiques sont possibles, l'Inde et l'Égypte[34]. L'origine égyptienne est la plus probable, les données de phylogénie indiquant qu'un orthopoxvirus ancestral devait exister chez des rongeurs africains[15]. La première mention écrite de la variole vient d'un médecin d'Alexandrie, Aaron, vers le VIIe siècle.
Antiquité
Des traces de cicatrices trouvées sur les visages de momies égyptiennes ont été considérées comme l'indice qu'une ou plusieurs formes de variole sévissaient au Moyen-Orient il y a plus de 3 000 ans[35]. La variole est probablement exportée vers l'Inde par voie commerciale au cours du premier millénaire avant J-C. La maladie aurait été introduite en Chine en l'an 49 de notre ère (selon des descriptions d'éruptions pustuleuses laissées par des auteurs chinois du IVe siècle).
Il n'existe pas de terme original grec ou latin pour désigner la variole, bien que la maladie soit très caractéristique[36]. Il est probable que les grandes épidémies qui ont frappé l'Empire romain au IIe siècle et au IVe siècle soient la variole. La peste antonine vers l'an 165 de notre ère, pourrait aussi avoir été une épidémie de varicelle ou de rougeole ou d'un type différent de la variole moins mortelle, et qui aurait depuis disparu, selon Hendrik Poinar (de l'Université McMaster d'Hamilton, au Canada)[35].
À partir du Ve siècle, des épidémies probables de variole sont signalées en Europe. Saint Nicaise, évêque de Reims, survécut à une épidémie et devint le saint patron des victimes de la variole, avant d'être martyrisé par les Huns vers 451. De telles épidémies sont mentionnées au VIe siècle par Grégoire de Tours et Marius d'Avenches[33]. Durant le même siècle, une épidémie de variole aurait décimé, près de la Mecque en 572, une armée éthiopienne conduite par le prince chrétien Abraha. La variole serait mentionnée de façon allégorique dans le Coran « Dieu envoya des volées d'oiseaux qui firent pleuvoir des pierres sur les assaillants »[33].
Dans les années 730, la variole atteint le Japon qui perd environ un tiers de sa population[37], ou de façon moins certaine dès 585, à partir de la Corée[32] - [34].
Moyen Âge
La maladie accompagne les conquêtes musulmanes en Afrique du nord et dans la péninsule ibérique. Le médecin persan Rhazes, dans son fameux traité[38], est le premier à distinguer cliniquement la rougeole et la variole vers 910. La variole est présente chez les enfants, sous forme d'épidémies saisonnière au Moyen-Orient et en Asie centrale. C'est une étape décisive dans la connaissance des fièvres éruptives[33].
Vers l'an mille, la variole s'est établie par la guerre ou le commerce, d'une part sur le littoral méditerranéen, et d'autre part dans les parties de l'Eurasie les plus densément peuplées (Route de la soie, Inde, Chine, Corée, Japon). Toutefois, il reste de nombreuses régions indemnes en Europe centrale et du nord, qui seront plus ou moins touchées après les retours des Croisades[39].

Au XVe siècle, la variole est signalée comme une maladie des enfants à Paris, en Espagne et en Italie, mais sous une forme de gravité intermédiaire entre la variole mineure et majeure. En revanche, quand la variole touche pour la première fois des populations insulaires isolées, elle peut être explosive et meurtrière, comme celle de l'Islande en 1241, qui perd près d'un tiers de sa population[39].
Europe (1500-1800)
La présence de la variole en Espagne est à la source de l'introduction de la variole en Amérique du Sud par les conquistadors.
Au XVIe siècle, un nouveau variant du virus apparait, d'origine possiblement zoonotique ou dû à une mutation dans une souche en circulation[35]. Il s'est ensuite répandu dans le monde conjointement à des formes parfois bénignes, parfois effroyablement mortelles, source d'une pandémie responsable de dizaines de millions de morts.
Une étude récente (2016) publiée dans Current Biology porte sur l'ADN viral d'une souche de variole découverte[40] dans une momie occidentale d'enfant du milieu du XVIIe siècle trouvée dans la crypte de l'église dominicaine du Saint-Esprit de Vilnius. Cet échantillon a été séquencé et c'est le plus ancien virus séquencé connu en 2016[35]. Il était génétiquement très proche des souches récentes, ce qui laisse penser que la forme la plus mortelle de la variole était le variant embarqué par les explorateurs du Nouveau Monde qui a décimé les Amérindiens[35]. Les auteurs ont construit un arbre généalogique de 49 souches modernes et anciennes connues, et retracé leur évolution depuis un ancêtre commun qui aurait surgi entre 1530 et 1654, un siècle environ avant la mort de l'enfant momifié.
C'est durant cette période que les Français appellent « grosse vérole », la syphilis, pour la distinguer de la variole dite « petite vérole ». Les Anglais font de même, la variole étant dite small pox et la syphilis great pox. Les épidémies de variole deviennent plus fréquentes avec l'urbanisation croissante. La pandémie qui démarre en Europe et au Proche Orient en 1614 est probablement responsable de l'introduction de la variole en Amérique du Nord (colonies françaises et britanniques). De la même façon, à la même époque, l'exploration et la conquête de la Sibérie par les Russes s'accompagne d'épidémies dévastatrices de variole dans les populations sibériennes[39].
À partir du XVIIe siècle, plusieurs pays européens inaugurent un système d'enregistrement statistique des cas de variole et des décès par variole. Au XVIIIe siècle, environ 95 % de la population française est touchée par cette maladie, et un décès sur dix est dû à celle-ci[41]. Les enfants en sont les premières victimes : 90 % des morts par variole en Angleterre sont âgés de moins de 5 ans, 10 % des enfants meurent chaque année de variole en Suède, un enfant sur sept meurt de variole en Russie[39].
La variole n'épargne pas les maisons royales, tuant entre autres la reine Marie II d'Angleterre, 32 ans (1694), l'empereur Joseph Ier, (33 ans) le dauphin Louis de France, 50 ans, le prince Louis de Lorraine (7 ans) et ses sœurs les princesses Élisabeth-Charlotte (10 ans) et Marie-Gabrielle (9 ans) (1711), le prince Léopold-Clément de Lorraine, 16 ans (1723) le roi Louis Ier d'Espagne, 17 ans (1724), le prince Léopold d'Anhalt-Köthen, 32 ans (1728), le tsar Pierre II de Russie, 15 ans (1730), la reine Ulrique-Éléonore de Suède, 53 ans (1741), l'impératrice Marie-Josèphe (28 ans) et sa belle-sœur l'archiduchesse Marie-Josèphe, 16 ans (1767), le roi Louis XV de France, 64 ans, (1774), ce qui incite les souverains à promouvoir la variolisation[39].
Colonies espagnoles et portugaises
Il semble démontré que la variole pénétra dans l’île de Saint-Domingue en 1516, à la suite de l’arrivée dans l’île, à bord d’un navire portugais, d’esclaves noirs infectés. Selon une théorie commune, la variole fut introduite sur le continent américain par un esclave noir de Pánfilo de Narváez, au moment où les troupes de ce dernier débarquaient au Mexique en 1520 pour y combattre Hernán Cortés. Cependant, sur le site archéologique de Tiwanaku (ou Tiahuanaco) en Bolivie, dans le temple semi-souterrain dit des Têtes, on trouve des représentations de maladies sur différents visages humains, dont une tête au visage parsemé de lésions où certains ont voulu voir les séquelles de la variole ; on relève en outre, dans plusieurs codex mexicains précolombiens, des visages couverts de lésions pouvant être imputées à la variole.
Quoi qu’il en soit, il est certain qu’on assista à un accroissement de la virulence de la maladie pendant et après la conquête espagnole. Ensuite, en 1525, le virus, véhiculé par l’expédition militaire de Pizarro, infesta l’empire inca, puis parvint entre 1558 et 1560 dans le Río de la Plata et en 1562 au Brésil.
Les sources indiquent que les épidémies de variole, dont on soulignait par ailleurs le caractère cyclique[42], frappaient plus violemment les indigènes que les Européens, non à cause d’une constitution plus faible chez les premiers, mais en raison d’une part de leurs coutumes et de leur mode de vie, propices à la propagation et à la contagion, et d’autre part de leur situation immunitaire au moment de l’arrivée du virus, les Indiens n’ayant en effet pas eu, ou peu, l’occasion de bâtir de mémoire immunitaire contre la maladie. Il en résulta une catastrophe démographique majeure : des 18 millions d’habitants que comptait le Mexique avant l’apparition des conquistadors, il ne restera vers 1600 qu’un peu plus d’un million[43]. Dans un titre de chapitre, l'historien Sheldon Watts utilise le terme d'holocauste[44].
La zone où, dans toute l’Amérique, la variole occasionna le plus de ravages fut la Caraïbe, celle-ci ayant en effet pendant longtemps joué un rôle de nœud de communication et se trouvant donc confrontée au trafic commercial le plus intense. Les Antilles étaient le centre de distribution, la plaque tournante du système commercial monopolistique espagnol, et c’était là en outre qu’accostait le vaisseau de permission concédé, aux termes du traité d'Utrecht, par l’Espagne à l’Angleterre, vaisseau qui permettait l’acheminement d’esclaves noirs vers tout le continent américain, c'est-à-dire de ceux-là mêmes qui seront identifiés comme la cause involontaire de nombre d’épidémies de variole, en particulier dans l’île de Cuba[45].
Colonies britanniques et françaises
En Amérique du Nord, la variole arrive avec les premiers colons britanniques, français et hollandais. Une première épidémie touche la côte du Massachusetts en 1617-1619, qui décime les Indiens Massachusetts. La densité de population était toutefois insuffisante (aussi bien pour les amérindiens que pour les premiers colons) pour que la variole se maintienne de façon endémique. Il y avait de long intervalles de répit (population immunisée) entrecoupées de fortes épidémies frappant les plus jeunes, nés après la dernière épidémie et lors de l'arrivée de nouveaux colons. Des épidémies à peu-près décennales frappent les ports comme Boston (1636, 1659, 1666, 1677, etc.), New York, Jamestown ou Charleston[46].
L'association entre les cas survenus à bord des navires et ces épidémies portuaires étant évidente, cela a permis de justifier la mesure des quarantaines, lesquelles iront en se généralisant au cours du XVIIIe siècle. La première quarantaine s'est effectué à Boston en 1647, à propos d'une épidémie probable de fièvre jaune. La mesure s'est ensuite appliquée contre les importations de variole.
La grande majorité des colons nés américains était faiblement immunisée par rapport aux Britanniques. Pour beaucoup de jeunes Américains, étudier en Angleterre faisait courir un grand risque de contracter la variole. La fondation des Universités en Amérique du Nord au XVIIIe siècle est liée en partie au refus de courir ce risque[46].
Les guerres intercoloniales entre Français, Anglais et leurs alliés Indiens ont été l'occasion de plusieurs épidémies de variole (voir Agent de guerre biologique). Avec la croissance urbaine du XVIIIe siècle (côte atlantique et berges du Saint Laurent), la variole devient plus fréquente et plus intense. Durant la guerre d'indépendance, lorsque les Anglais abandonnent Boston, le , George Washington ordonne que « mille hommes qui ont déjà eu la variole » s'emparent de la ville[46].
Asie et Pacifique (1500-1800)
Aux Indes, la première épidémie de variole décrite par les Européens est celle de l'enclave portugaise de Goa en 1545. Les descriptions les plus complètes sont celles du XVIIIe siècle, avec l'établissement des Britanniques, notamment dans le Bengale (épidémie de 1769-1770). Les médecins anglais notent une situation endémique avec des pics saisonniers (saison sèche de printemps), ponctuées d'épidémies sévères tous les 5 ou 7 ans[47].
En Chine et en Asie du Sud-Est, la variole est endémique dans toutes les zones très peuplées. Des peuples tribaux du nord, comme les Mongols, craignent les contacts avec les Chinois. Les empereurs de Chine mandchous de la dynastie des Qing eux-mêmes choisissent comme successeurs parmi leurs fils ceux qui ont déjà eu la variole. Certains dalaï-lama et panchen-lama ont refusé des invitations d’empereurs de Chine par crainte de la variole. En 1780, le panchen-lama Lobsang Palden Yeshe accepte une invitation et meurt de variole quelques semaines après son arrivée. Des voyageurs européens notent qu'il est difficile de trouver un Chinois adulte qui ne soit porteur d'aucune cicatrice de variole[47].
Le Japon connaît des épidémies de variole tous les 15 ans en moyenne, par introduction répétée provenant de Chine ou de Corée.
En Indonésie et aux Philippines, défavorisées aussi par la proximité de la Chine, le problème apparaît plus important encore[48]. La population est encore trop petite pour que la variole devienne endémique, mais des épidémies violentes peuvent survenir à l'occasion, apportées par navires (épidémie de Sumatra en 1780-1783)[47].
En 1788, les Britanniques installent leur première colonie en Australie, près de Sydney. Un an plus tard, des cas de variole se produisent chez des Aborigènes voisins. Toutefois, la variole ne s'établit pas, à cause du peu de contact entre Européens et Aborigènes et du faible peuplement des deux communautés. La variole réapparaît en 1829-1831. L'origine des premières épidémies australiennes n'a pas été éclaircie, mais la variole aurait joué un rôle important dans le déclin de la population aborigène (sud-est de l'Australie) dans la première moitié du XIXe siècle[49].
Afrique (1500-1900)
Après l'Afrique du nord lors de la conquête musulmane, la variole est introduite le long des côtes d'Afrique de l'est par des colonies arabes (cités portuaires comme Mombasa), probablement à partir du XIVe siècle. Les sources écrites connues apparaissent lorsque les commerçants portugais remplacent les marchands arabes. Des tribus africaines de l'intérieur attaquèrent des villes côtières, ce qui provoqua en 1589, une grave épidémie de variole frappant les Africains de tout âge, et les jeunes enfants portugais alors que les Portugais adultes restaient indemnes pour la plupart[50].
Il est probable que les relations commerciales entre l'Afrique de l'est et de l'ouest, et le pèlerinage à La Mecque, ont contribué à l'établissement de la variole en Afrique. La variole africaine aurait été déjà endémique avant le commerce d'esclaves vers les Amériques. Toutefois, en Angola, la variole est introduite à la suite de la fondation de Luanda par les Portugais en 1484[50].
En Afrique du Sud, la variole atteint Le Cap en 1713 par un navire venu des Indes. Là encore, les Hollandais adultes, nés en Europe, sont immunisés alors que des clans entiers de Khoïkhoï disparaissent. D'autres épidémies surviennent en 1755 et 1767, frappant les colons nés en Afrique, les Khoïkhoï et les Bantous.
En 1729, la variole est introduite à La Réunion, par un navire apportant des esclaves de Madagascar.
L'Afrique centrale est touchée par la variole au cours du XIXe siècle, par le commerce arabe des esclaves (par caravanes, comme en Ouganda dans les années 1840), les chasseurs d'ivoire et l'ouverture du commerce européen. Les épidémies sont très sévères dans des populations tribales (80 % de mortalité) comme dans le bassin du Congo[50].
Finalement, vers la fin du XIXe siècle, une nouvelle forme de variole est signalée, la variole mineure ou alastrim, à peu près simultanément en Afrique du Sud et en Floride.
Histoire de la prévention
L'histoire de la lutte contre la variole peut se diviser en plusieurs périodes : d'abord la phase de la variolisation, ensuite celle de la vaccination, et enfin celle de la campagne mondiale d'éradication (1958-1977).
En Orient
En Inde, la variole est décrite dans les livres ayurvédiques. Le traitement curatif ayurvédique passait par l'inoculation d'un « matériau varioleux » vieux d'un an, issu des pustules de personnes ayant contracté la variole l'année précédente.
Dès le XIe siècle, les Chinois pratiquaient la variolisation : il s'agissait d'inoculer une forme espérée peu virulente de la maladie en mettant en contact la personne à immuniser avec le contenu de la substance suppurant des vésicules d'un malade. C'est le premier ministre Wang Dan qui après la perte d'un de ses fils de la variole avait convoqué divers praticiens de toute la Chine pour mettre au point une prophylaxie. Un moine taoïste apporta la technique d'inoculation qui se diffusa progressivement dans toute la Chine. Mais ces origines précoces sont remises en cause par certains auteurs[51] - [52] et la première mention indiscutable de la variolisation apparaît en Chine au XVIe siècle[53]. Le résultat restait cependant aléatoire et risqué, le taux de mortalité pouvant atteindre 1 ou 2 %. La pratique s'est progressivement diffusée le long de la route de la soie.
En 1701, Giacomo Pylarini réalise la première inoculation à Constantinople. À partir des années 1710, les mentions concernant l'inoculation pratiquée en Orient se multiplient dans les journaux européens[54].
En Europe
La technique est importée en Occident au début du XVIIIe siècle, par Lady Mary Wortley Montagu, femme de l'ambassadeur de Grande-Bretagne en Turquie, qui l'apprend du docteur Emmanuel Timoni (v. 1670-1718)[55], médecin de l'ambassade de Grande-Bretagne à Constantinople. Diplômé de l'université de Padoue, membre de la Royal Society de Londres depuis 1703, le docteur Timoni publie en 1713 dans les Philosophical transactions de la Royal Society son traité sur l'inoculation. Son travail est publié de nouveau l'année suivante à Leipzig. À partir de cette date, les publications sur ce sujet se multiplient, Pylarino en 1715, Leduc et Maitland en 1722… L'efficacité de la méthode ayurvédique a été attestée par le médecin britannique J.Z. Holwell dans un rapport au College of Physicians à Londres en 1767.
Elle est introduite en France plus tard. Au temps de la Régence, la pratique de l'inoculation est discutée et étudiée par les cercles médicaux et en Conseil du roi ; malheureusement, des problèmes plus urgents la rejettent dans l'oubli pour presque vingt-cinq ans, en dépit d'une campagne menée par Voltaire en 1727, tandis que la pratique se diffuse lentement en Europe. Un des rares moments de paix sur le continent - entre la guerre de Succession d'Autriche et celle de Sept Ans - permet au débat de se développer et de prendre même la forme d'une vive controverse nourrie par un afflux de livres, d'articles dans les journaux, de pamphlets, d'échanges de lettres et de mémoires présentés à l'Académie. Faute de données précises sur les taux de mortalité de la petite vérole naturelle ou artificielle, les débats manquent d'un point d'appui solide. Les dangers de l'inoculation, non négligeables, sont d'ailleurs rapportés par les inoculateurs eux-mêmes, souvent prompts à dénoncer les erreurs, échecs ou abus de leurs confrères et concurrents. La technique employée consiste à placer des fils imprégnés de pus varioleux dans de profondes incisions : l'abondante suppuration ainsi provoquée devait, suivant les croyances de l'époque, drainer hors du corps le pire effet de la petite vérole (avec un bénéfice secondaire pour l'inoculateur qui se fait rémunérer pour les pansements compliqués qu'il est amené à renouveler).
Deux personnalités, les docteurs Tissot et Théodore Tronchin, s'illustrent dans les débats : n'étant pas sujets du roi de France, protestants, ils sont plus libres de leur parole tant vis-à-vis de la Sorbonne que de Versailles. S'y adjoint le mathématicien La Condamine, qui le introduit l'argument probabiliste[56] lors de son intervention remarquée en faveur de l'inoculation à l'Académie des sciences[57]. Leurs adversaires les plus notables sont De Haen, un brillant médecin, et Roncalli dont l'argumentation est surtout d'ordre moral. La première inoculation véritablement médiatisée est celle pratiquée par le docteur Théodore Tronchin en 1756 sur les enfants du duc d'Orléans[58]. En 1758 La Condamine compte à peine cent inoculés à Paris ; dix ans plus tard il n'en comptera qu'un peu plus de mille dans la France entière[59]. En 1760, lors d'un exposé devant l'Académie Royale des Sciences de Paris, Daniel Bernoulli démontre[60] que, malgré les risques, la généralisation de cette pratique permettrait de gagner un peu plus de trois ans d'espérance de vie à la naissance. Le travail de Bernoulli, qui jette les bases du modélisme épidémiologique, n'a probablement pas eu de conséquences pratiques immédiates. La variolisation continue à susciter l'hostilité de nombreux médecins[58].
Avant 1760, la pratique de la variolisation est parfois inefficace voire catastrophique : les médecins européens ont remplacé l'aiguille, qui servait en Turquie à l’inoculation, par un instrument plus « chirurgical », la lancette, qui permet de faire une incision plus profonde. À compter de 1760, l'incision superficielle préconisée par une famille de médecins du nom de Sutton, augmente la fiabilité de l'inoculation[61].
Le , le Parlement de Paris, en attendant les avis des Facultés de Théologie et de Médecine de Paris, interdit temporairement sur son territoire les inoculations urbaines hors d'enceintes spécialement affectées. Seulement après quatre ans de discussions, le , la Faculté de Médecine de Paris décrète que la pratique de l'inoculation serait « admissible ». L'avis de la Faculté de Théologie semble avoir été oublié et n'est toujours pas connu, bien que La Condamine signale la : « […] question résolue affirmativement dès 1723 par neuf docteurs de la Sorbonne consultés »[54] - [62]. La Condamine se réfère à l'épisode raconté en 1723 par le docteur M. de la Coste dans une lettre adressée à M. Dodart, conseiller d’État et premier médecin du Roy : « Puisque dans une conférence que j'eus en Sorbonne il y a environ cinq semaines avec M. le Doyen & neuf de leurs plus fameux Docteurs […] j'eus la satisfaction de les voir enfin conclure, qu'il étoit licite, dans la vûe d'être utile au public, de faire des expériences sur cette pratique»[63]
L'inoculation est accusée de contrecarrer la volonté de Dieu[64] et d'accroître l'épidémie[65] à Paris comme à Londres.
La controverse de l'inoculation atteignit son acmé en 1768 avant de s'éteindre en 1774. C'est l'année où le médecin suisse Louis Odier approfondit une correspondance avec Anton de Haen pour enquêter sur la portée réelle de la vaccination contre la variole à Londres, ville dont il extrapole les tables de mortalité grâce à des données remontant à 1661. Il entrevoit des progrès fulgurants dans l'espérance de vie et son estimation, après avoir étudié les tables de mortalité de ceux qui se sont intéressés à la maladie, Antoine Deparcieux (1746), Théodore Tronchin (1748), Pehr Wilhelm Wargentin (1749), Thomas Simpson (1752), ou Johann Peter Süssmilch (1761). Plus tard, Louis Odier dénoncera avec virulence les curés savoyards et valaisans, selon lui responsables des lenteurs de la diffusion de la vaccine aux portes mêmes de Genève[66].
En 1785, la Société royale de médecine, fondée en 1776 pour étudier le problème des épizooties, des épidémies et des eaux minérales, indique, comme moyen de lutter contre la maladie, la mise en quarantaine.
Précurseurs
Pour la première fois, des années 1770 jusqu'en 1791, au moins six personnes ont testé, chacune de façon indépendante, la possibilité d'immuniser les humains de la variole en leur inoculant la variole des vaches, présente sur le pis de la vache. Parmi les personnes qui ont fait les premiers essais, figurent en 1774, un fermier anglais au nom de Benjamin Jesty, et en 1791, un maitre d'école allemand du nom de Peter Plett[67]. En 1796, le médecin anglais Edward Jenner fera la même découverte et se battra afin que le bon résultat de l'immunisation soit officiellement reconnu.
Méthode Jenner
Le , Jenner inocule à un enfant du pus prélevé sur la main d'une fermière (Sarah Nelmes[68]) infectée par la vaccine (via le contact avec le pis de la vache infectée), ou variole des vaches (cowpox en anglais). Trois mois plus tard, il variolise l'enfant, qui ne développe aucune pustule, se révélant ainsi immunisé contre le virus. Cette pratique se répand progressivement dans toute l'Europe. Néanmoins, la variole reste endémique pendant tout le XIXe siècle et n’a progressivement disparu d'Europe qu’après la Première Guerre mondiale.
_(14578678817).jpg.webp)
La controverse resurgit à l'occasion de l'introduction de la vaccination jennérienne qui se présente à un moment où la France est en conflit avec l'Angleterre. E. Jenner a publié ses résultats en juin 1798 : dès octobre de cette année, une revue de vulgarisation scientifique éditée à Genève, La Bibliothèque britannique, en fait état.
Pour l'anecdote, la vaccination de l'époque consiste à prélever du pus directement des pustules et à infecter les hommes avec celui-ci (ne pas oublier que Louis Pasteur et l'asepsie viendront plus tard). Et plutôt que de transporter une vache infestée, il est plus simple de se déplacer avec un homme récemment « vacciné » et qui présente les pustules de la cowpox.
Cette pratique, nommée « vaccination de bras-à-bras », pose de nombreux problèmes. En effet, les populations, pour des raisons culturelles, sont parfois opposées au mélange du sang. Les réticences proviennent des populations et des médecins ; ces derniers acceptant mal d'engendrer le mal volontairement (voir tradition hippocrato-galénique). Par ailleurs, cette forme de variolisation tend à transmettre d'autres maladies, à l'instar de la syphilis, maladie terrifiante par excellence. À cela s'ajoute un autre problème : le taux de mortalité n'est pas nul, de l'ordre de 2 %. Ainsi, en France, de 1760 à 1787, il n'y a que 60 000 inoculations volontaires de la cowpox.
Vaccination jennérienne en France
En France, c'est un professeur de botanique de Rochefort, le docteur Jean-Baptiste Bobe-Moreau qui le premier promeut la vaccination jennérienne par ses écrits, puis par la pratique. Obtenant du docteur Pictet un fil imprégné de vaccin, il expérimente le procédé avec succès fin mars 1800 et entreprend ensuite la première vaccination publique.
À la même époque, le , l’École de médecine de Paris et l'Institut National (l'Académie des sciences) nomment chacun une commission d'étude, qui décident de joindre leurs efforts. Missionné par ces deux institutions, le Genevois Colladon se forme à Londres aux méthodes anglaises qui seront expérimentées, sans succès, à la Salpêtrière sous la direction de Pinel. Parallèlement, fin janvier 1800, le duc de La Rochefoucauld-Liancourt, récemment revenu d'émigration en Angleterre, fonde le Comité national de la vaccine grâce à une souscription publique[69]. En , la société des souscripteurs nomme un Comité de médecins (dont la plupart des membres sont issus des commissions de l’École de médecine et de l'Académie des sciences). Grâce à l'appui de personnalités importantes comme Lucien Bonaparte et Talleyrand, ce comité entre en contact avec des médecins de Londres qui leur envoient, le 2 juin 1800, du fluide vaccinal. À Vaugirard, le Dr François Colon vaccine trente enfants qui exhibent des signes de fausse vaccine[70]. Un médecin britannique, Woodville, est alors invité en France. Des enfants vaccinés selon ses instructions à Boulogne est extraite une lymphe qui permet de vacciner à Paris avec succès 150 enfants. Cela se sait, et conduit à un timide développement de la pratique. Instruit, fin janvier 1801, par le premier rapport du Comité de la Vaccine, le préfet de la Seine octroie le 7 février un premier établissement au Comité afin d'y procéder à des vaccinations. Dans les semaines qui suivent d'autres établissements seront confiés au Comité. En février celui-ci, avec l'appui du préfet, appelle les maires des douze arrondissements de Paris à se doter d'un centre de vaccination - gratuite - ce qui sera effectif en avril. Tous les établissements publics parisiens font vacciner leurs pensionnaires. Devant ces résultats, des comités et des centres de vaccination sont créés, rapidement, dans les principales villes de province[71].
Le , Parmentier rédige un rapport pour Chaptal, alors ministre de l’Intérieur de Napoléon, sur l’inoculation gratuite de la vaccine aux enfants des familles indigentes. Le 4 avril 1804, est fondée la Société pour l’extinction de la petite vérole par la propagation de la vaccine au sein de laquelle un comité central, présidé par le docteur Guillotin, a pour mission le développement de cette pratique dans tous les départements. En 1805 une circulaire explicative instituant l’usage de la vaccine est adressée aux préfets sans aboutir à de notables résultats. Un décret du fait obligation aux grandes villes de conserver du vaccin pour en fournir aux médecins qui en auraient besoin. La véritable campagne de vaccination débutera en 1811, lorsque Napoléon fera vacciner le roi de Rome et qu’une instruction ministérielle (du ) rendra la vaccination obligatoire dans l’armée[72].
Les ministres de l'Intérieur Chaptal puis Fouché imposent aux journaux — y compris médicaux — d'obtenir l'accord du Comité de vaccine avant toute publication sur le sujet[59]. Pour le transport, Bretonneau substitue les tubes en verre capillaire aux fils de lin imprégnés de la lymphe vaccinale.

Le Comité Central de la Vaccine créé en 1803 et rattaché à l'Académie de Médecine en 1820 ordonne les campagnes de vaccination. La circulaire du 26 août 1880 réserve l'acte vaccinal aux seuls diplômés (jusqu'alors, les prêtres, religieuses, notables, instituteurs, etc. avaient prêté leur concours). La vaccination de bras à bras restera la plus répandue jusque dans les années 1880[73]. Les autorités se plaignent du faible nombre d'enfants vaccinifères - on [Qui ?] récoltait sur leurs pustules la pulpe vaccinale servant aux vaccinations - imputé à l'opposition des familles. Cet obstacle disparaîtra dans la dernière décennie du siècle à la suite de l'adoption d'abord de la « vaccine animale » puis du procédé de conservation de la pulpe vaccinale qui permettra de s'affranchir de la présence de génisses lors des séances de vaccination. Si les vaccinations sont souvent dispensées gratuitement aux indigents, il s'en faut de beaucoup que la gratuité soit largement pratiquée. La création d'un service public de vaccination fait l'objet de débats dans lesquels le statut libéral de la médecine pèse d'un poids certain. De nombreuses voix appellent à une obligation vaccinale, seule capable de venir à bout de populations rétives et peu accessibles à quelque éducation sanitaire que ce soit. Dans les colonies, cette obligation fut instituée plus tôt qu'en métropole, ainsi en 1876 en Cochinchine. En 1843, 1858 et 1880, plusieurs projets de loi ayant en vue une obligation vaccinale échouent. Toutefois, l'obligation est imposée à différentes catégories de la population : les enfants placés en nourrice et leur gardienne en 1874, les conscrits en 1876, les écoliers en 1882, les lycéens et collégiens en 1883, les étudiants en médecine et pharmacie en 1891.
Expédition Balmis
La variolisation, confrontée au scepticisme des milieux médicaux, et en l’absence d’encouragement officiel, n'est introduite en Espagne que tardivement et, si elle finit par être appliquée, sa diffusion est moindre qu’en Grande-Bretagne par exemple, où l'on estime que 200 000 personnes sont inoculées entre 1766 et la fin du siècle[74]. Quelques années après la découverte de la vaccination jennérienne, les autorités médicales du pays conçoivent l’idée d’une campagne de vaccination de masse dans tout l’Empire espagnol (y compris les Philippines) ; soutenu par le roi Charles IV, le projet prend corps et, entre 1803 et 1814, l’expédition Balmis (ainsi nommée d’après son directeur, le médecin et homme de science Francisco Javier Balmis) accomplit un voyage autour du monde, d’abord conjointement, puis, après la scission décidée au Venezuela, en deux équipes distinctes, l’une desservant l’Amérique centrale et le Mexique, et de là les Philippines, l’autre se dirigeant vers le sud pour apporter la vaccine en Nouvelle-Grenade, à Quito, au Pérou, dans le Haut-Pérou (Bolivie actuelle), et jusqu’au Chili. Concomitamment, des structures administratives sont mises en place pour perpétuer l’œuvre des expéditionnaires et garantir notamment, par une chaîne ininterrompue et bien organisée d’enfants vaccinifères, la disponibilité de lymphe vaccinale sur plusieurs générations. Globalement, l’expédition est un succès, même si les guerres d’indépendance ne laisseront quasiment rien subsister de l’œuvre de Balmis.
En Allemagne
Certains soldats prussiens ayant contracté la variole en France pendant la guerre de 1870 sont à l'origine d'une épidémie, une fois de retour en Allemagne. Les autorités sanitaires de l'Empire allemand imposent une vaccination obligatoire à travers le Reichsimpfgesetz du 8 avril 1874 (mais qui ne sera effective que le ).
Vaccinations modernes (XXe siècle)
En 1899, la découverte par Saint-Yves Ménard du maintien de l’activité du virus conservé dans la glycérine permet les vaccinations en série, et à distance de la génisse[75].
En Allemagne
En Allemagne, l'obligation portant sur la première immunisation, chez les jeunes enfants donc, est levée le 31 janvier 1975. Le 31 mai 1976, une loi limite l'obligation vaccinale à quatre catégories de la population. L'obligation prend totalement fin en 1983.
En France
Le , la Loi sur la protection de la santé publique, en son article 6, rend la vaccination antivariolique obligatoire au cours de la première année de vie ainsi que les re-vaccinations des 10e et 21e années[76].
En 1917, André Fasquelle met au point, avec Lucien Camus, la dessiccation sous vide de la pulpe vaccinale congelée, ce qui en permettra le conditionnement et l’emploi dans les pays tropicaux[75].
La dernière épidémie de variole date de l'hiver 1954-1955 à Vannes et Brest. Le sergent Roger Debuigny est rapatrié dans le Morbihan après la fin de la guerre d'Indochine, bien que vacciné, il a contracté la variole. Il y a 20 morts sur 98 cas à Vannes et à Brest[77] - [78].
La vaccination n'est plus obligatoire en France depuis 1979 et les rappels ne sont plus obligatoires depuis 1984, mais il existe un Plan national de réponse à une menace de variole (2006)[79]. C'est pourquoi la majorité de la population est considérée comme vulnérable à tous les orthopoxvirus (virus de la famille variole), à l'occasion de l'épidémie de variole simiesque de 2022[80].
Éradication totale

En 1950, l'Organisation Sanitaire pan américaine (OSPA), s'appuyant sur un nouveau procédé développé par le virologue Leslie Collier, entreprend d'éradiquer la variole des Amériques (ce résultat sera atteint en 1967, sauf au Brésil)[81]. L'Union soviétique propose à l'Organisation mondiale de la santé, en 1958, d'éradiquer entièrement la variole, qui faisait alors 2 millions de victimes par an dans le monde[82]. La stratégie initiale, prévue pour l'éradication dans les pays du Tiers-Monde, estimait qu'un taux de vaccination de 80 % au moins (seuil de l'immunité grégaire) était nécessaire pour éradiquer le virus[82]. La campagne de vaccination se révèle ardue à mettre en œuvre[82].
Le rapport final de la Commission mondiale pour la certification de l'éradication de l'OMS note :
« Les campagnes d'éradication reposant entièrement ou essentiellement sur la vaccination de masse furent couronnées de succès dans quelques pays mais échouèrent dans la plupart des cas. […] En Inde, cinq ans après une campagne nationale d'éradication entreprise en 1962 (55 595 cas), le nombre de notifications était plus grand (84 902 cas) qu'il ne l'avait jamais été depuis 1958. Il eût été extrêmement coûteux et logistiquement difficile, sinon impossible, d'atteindre des niveaux beaucoup plus élevés de couverture. Avec les moyens disponibles, il fallait absolument changer de stratégie[83]. »
L'OMS change alors de stratégie en 1967, mettant en œuvre la « stratégie de surveillance et d'endiguement », qui consiste à isoler les cas et à vacciner tous ceux qui vivaient aux alentours de foyers d'épidémie. Une équipe internationale est constituée sous la direction de l'Américain Donald Henderson.
La campagne d'éradication se heurte d'abord au problème d'identification des foyers d'infection, tous n'étant pas nécessairement recensés. Le contexte social, culturel et politique joue aussi un rôle important. Ainsi, en Inde et au Bangladesh, beaucoup d'Hindous s'opposent à la vaccination par peur d'offenser Shitala Devi, la déesse associée à la variole. Des prêtres bénissent toutefois des lots de vaccin. En outre, une année, les pluies violentes lors de la mousson rompent les barrages et les digues, forçant la population à fuir, ce qui a pour effet d'étendre à nouveau le foyer d'infection, lequel sera éradiqué au bout d'un an d'efforts.
Le Soudan, lui, est plongé en pleine guerre civile, exposant à des risques accrus les équipes de santé (qui n'auront néanmoins aucune victime à déplorer).
En Europe, un foyer d'infection se déclare en Suède (mai-juillet 1963), éradiqué via des mesures de quarantaine et de vaccination[84].
La dernière grande épidémie européenne de variole a lieu en 1972 en Yougoslavie. Un jeune Kosovar revenant d'un pèlerinage à la Mecque et en Irak déclare la variole. L'épidémie frappe 38 personnes, dont 6 meurent[85]. Le régime titiste déclare alors la loi martiale, impose la quarantaine et entreprend une campagne massive de re-vaccination de la population, avec l'aide de l'OMS et de l'équipe de Henderson. L'épidémie est endiguée en deux mois.
Le dernier cas spontané de la forme la plus grave de variole (Variola major) est enregistré au Bangladesh, en , chez une petite fille de deux ans, Rahima Banu[86]. À partir de cette date, la variole est considérée comme éradiquée de la quasi-totalité du globe, à l'exception de la Corne de l'Afrique. En effet, la pauvreté des infrastructures sanitaires et routières d'Éthiopie et de Somalie rendent très difficile la vaccination de masse qui est un succès ailleurs. S'y ajoutent les conflits armés, les famines et les migrations de réfugiés qui compliquent encore la tâche.
Néanmoins, par une intensification des mesures de vaccination, de surveillance, de confinement, au début de 1977, le dernier cas de variole contracté de manière naturelle est diagnostiqué à Merca en Somalie, le [87].
L'éradication globale[88] de la variole est certifiée par une commission d'experts le et déclarée officiellement par l'OMS le dans la résolution WHA33.3[89] - [90]. À la suite de ce succès, la vaccination systématique n'est plus appliquée, elle n'est employée aujourd'hui que dans les forces armées et les laboratoires.
Ère post-éradication et recherches
Laboratoires détenant des stocks de virus
À partir de 1976, l'éradication mondiale étant imminente, le nombre de laboratoires détenant des virus varioliques est réduit. Dans le monde, il passe de 75 en 1975 à 7 en 1979, puis à 4 en 1981 (Afrique du Sud, URSS, Royaume-Uni, États-Unis). Ce processus a été accéléré par l'accident de laboratoire survenu en 1978[91].
Épidémie de Birmingham en 1978
Dix mois après la détection du dernier cas de variole dans le monde (Somalie, 1977), en , Janet Parker, photographe de l'École de Médecine de l'Université de Birmingham se présenta à l'hôpital avec des symptômes de variole. Les analyses sérologiques et la microscopie électronique confirmèrent son état[92] et elle mourut le 11 septembre de la même année des suites de la maladie. Le professeur Henry Bedson (en), responsable des recherches sur la variole dans ce laboratoire, tomba malade le 2 septembre, après une apparente tentative de suicide, et mourut le 7 septembre[93].
Janet Parker, 40 ans, avait été vaccinée en 1966 et n'avait pas voyagé récemment, ni été en contact avec une personne revenant de l'étranger. 290 personnes ayant été en contact avec Janet Parker durant sa maladie furent identifiées, vaccinées ou revaccinées, et isolées à leur domicile. Le père de Janet Parker développa une fièvre et mourut subitement le 5 septembre d'un arrêt cardiaque. La mère de Janet Parker, 70 ans, tomba malade le 7 septembre et la variole fut confirmée, mais elle se rétablit et put sortir de son isolement le 22 septembre.
L'enquête révéla que le laboratoire de photographie où travaillait Janet Parker se trouvait immédiatement au-dessus du laboratoire de virologie où se trouvaient les cages d'animaux d'expériences. La voie de contamination la plus probable aurait été la voie aérienne par le conduit contenant les câbles téléphoniques d'un étage à l'autre[93].
Cet épisode représente la dernière épidémie de variole dans le monde, et la mère de Janet Parker le dernier cas mondial connu de variole.
Destruction des stocks
Dès lors, il fut décidé en 1980 que tous les stocks connus de ce virus seraient détruits ou transférés à l'un des deux laboratoires habilités par l'OMS, l'un à Atlanta (les CDC - Center for Disease Control, ou Centres pour le contrôle et la prévention des maladies - aux États-Unis), l'autre à Moscou (Institut de recherches virologiques en URSS), tous deux de haute sécurité. Ce dernier a été transféré en 1982 au Centre national de recherche en virologie et biotechnologie (Vector) de Koltsovo, en URSS.
En 1986, l'OMS recommanda finalement la destruction totale de tous les stocks de ces virus pour la date du 30 décembre 1993. Mais après un premier ajournement au 30 juin 1995, puis comme « dernier délai fixé par l'OMS »[94] au 30 juin 1999, cette décision fut reportée jusqu'en 2002. En effet, la décision de destruction totale ne faisait plus consensus lors de la 52e Assemblée mondiale de la santé en 1999, même si la destruction totale des stocks diminuait le risque d'un accident menant à une nouvelle éruption de la maladie. Plusieurs États-membres, dont les États-Unis, arguèrent que ces virus pourraient se révéler utiles pour la recherche biomédicale (poursuite du séquençage du génome du virus de la variole) comme pour le développement de nouveaux vaccins, de médicaments antiviraux, etc.[95]
La désintégration de l'URSS, l'importance de sa recherche virologique militaire et le départ des scientifiques ex-soviétiques vers des pays abritant des groupes terroristes ont joué un rôle dans ces décisions de report[96].
Vaccins et anti-viraux
Au lendemain des attentats du 11 septembre 2001 et des attaques au bacille du charbon aux États-Unis en 2001, la question de l'usage possible de la variole en tant qu'arme biologique a pris de l'ampleur. En 2003, la probabilité d'une action bioterroriste utilisant le virus de la variole a été qualifiée de mineure par le professeur François Bricaire[97].
En 1999, un comité de l'OMS avait indiqué que les réserves de vaccins disponibles (évaluées mondialement à 90 millions de doses en 1998[89]), étaient trop limitées et qu'il fallait relancer la production de vaccins. Dès lors, les États-Unis et d'autres pays sous l'égide de l'OMS relancèrent la reconstitution de stocks et la recherche sur de nouveaux vaccins contre la variole[98].
En France, le plan national de réponse à une menace de variole[99], institué par le décret no 2003-313 du [100], prévoit diverses mesures à prendre en cas d'attaque bioterroriste (plan Biotox). Ces mesures sont graduées selon le niveau de menace et d'alerte, pouvant aller au maximum (épidémie échappant à tout contrôle, et en dernier recours) jusqu'à un dispositif de vaccination de l'ensemble de la population[101]. Un stock de vaccin est d'ores et déjà constitué. Ce plan (dernière version en 2006) est en cours de révision[102], et en 2016, ces travaux sont couverts par le secret de la défense nationale[103].
Pour l'OMS, la vaccination mise en œuvre pour combattre une flambée éventuelle doit se limiter aux personnes en contact étroit avec les malades et aux intervenants de première ligne[95].
En 2016, le stock actuel détenu par l'OMS est de 2,4 millions de doses en Suisse, et 32 millions dans des pays donateurs. À cela s'ajoutent les stocks nationaux, gérés par chaque pays, qui représentent 600 à 700 millions de doses à l'échelle mondiale, ce qui, selon l'OMS, est suffisant pour faire face à une épidémie[95].
Recherches
Ainsi, pour faire face à toute menace variolique (bioterrorisme, accident de laboratoire…), la recherche de moyens thérapeutiques continue. La mise au point d'un nouveau vaccin est la principale voie empruntée. Les antiviraux font également l'objet de recherche. En 2010, un laboratoire a redécouvert une plante carnivore, Sarracenia purpurea L. /oreille de cochon, ayant une activité anti-orthopoxvirus[104].
Depuis la reconnaissance de l'éradication de la variole en 1980, en attendant qu'il y ait consensus scientifique mondial sur la disparition du risque sanitaire lié à une réapparition naturelle du virus (jugée de moins en moins plausible) ou à un usage illicite, la recherche se poursuivra sans doute encore après l'éventuelle « destruction des stocks existants de virus variolique » vivants.
Elle est pluridisciplinaire et se fait dans des conditions très encadrées de « sûreté biologique » et de biosécurité sous l'égide de l'OMS, d'un comité consultatif OMS de la recherche sur le virus variolique[105] » (ACVVR) et d'un groupe consultatif d’experts indépendants (AGIES)[106], comprenant des représentants de tous les secteurs de la recherche et du développement dans le domaine des orthopoxvirus (OPV), supposés indépendants (ayant rempli et signé une déclaration d'intérêts et issus d'un domaine autre que la recherche variolique »[95]) et agréés par le comité précédent et l'OMS.
En 2010, L’AGIES a conclu qu'au vu des données disponibles et des progrès techniques, « les virus varioliques vivants ne sont pas nécessaires à la poursuite du développement des tests de diagnostic ni à leur validation sur le plan technique », mais qu'il faut par d'autres moyens « poursuivre les tentatives en vue de mettre au point des vaccins qui soient plus sûrs et au moins aussi efficaces que les vaccins originaux et/ou les vaccins antivarioliques actuellement homologués » (page 9/44 du rapport AGIES2010[106]).
En 2014, l'Assemblée mondiale de la santé a demandé à des groupes d'experts d'analyser les conséquences des derniers progrès réalisés en biologie de synthèse. La conclusion est que le risque de réémergence de la variole a globalement augmenté depuis le début des années 2000. La synthèse de virus variolique est devenue « plus aisée et moins coûteuse, susceptible d'être réalisée par des laboratoires de petite taille dont les conditions de sûreté et de sécurité biologiques sont insuffisantes »[95].
En 2016, la situation de la recherche sur la variole et les contre-mesures médicales est la suivante[95] :
- la génomique du virus variolique : le séquençage de 50 isolats est quasi complet. Il est considéré comme suffisant car on observe très peu de diversité entre eux.
- le modèle animal et la pathogénèse : Il n'existe aucun modèle animal permettant d'imiter la variole humaine ; des modèles de substitution chez l'animal sont étudiés à des fins d'approbation par les autorités de règlementation.
- les produits de diagnostic : ils détectent soit le virus, soit son acide nucléique (tests par PCR, les plus développés dans les années 2000-2010[106]), soit des anticorps dirigés contre le virus (tests sérologique), soit des protéines virales spécifiques. La maladie était autrefois assez facilement diagnostiquée, mais elle peut parfois être confondue avec d'autres maladies exanthématiques (comme une forme grave de varicelle) et la plupart des médecins contemporains n'ont jamais vu de cas de variole, ou très peu. Ces tests restent donc nécessaires au cas où la maladie réapparaîtrait. Ils sont homologués ou validés par les autorités réglementaires. Les plus sensibles et spécifiques sont les tests par PCR.
- les vaccins antivarioliques : ceux de première génération, à base de vaccine (comme le NYCBH-Dryvax, Lister-Elstree ou Tian-Tan), sont très efficaces, mais avec des effets secondaires indésirables graves pour un nombre significatif de vaccinés, car produits pour la plupart dans le tissu cutané d'animaux vivants[106]. Ils restent utilisables si nécessaire. Trois nouveaux vaccins ont été homologués : un de deuxième génération (ACAM2000) et deux de troisième génération (LC16m8 et MVA). Selon l'OMS, ils sont à privilégier[95].
- les antiviraux antivarioliques : deux antiviraux sont à un stade avancé d'homologation aux États-Unis. Le CMX001 (brincidofovir) et le ST-246 (técovirimat). Le premier est un dérivé du cidofovir (analogue nucléosidique fait d'une petite molécule inhibant spécifiquement l'ADN polymérase virale), biodisponible par voie orale. Le second inhibe une protéine essentielle à la duplication virale, et présente dans l'enveloppe des orthopoxvirus, sans effets secondaires détectés (en 2010)[106]. Ces médicaments génèrent cependant in vitro des phénomènes de résistance[106]. Des médicaments encore plus efficaces doivent donc encore être recherchés.
- la sûreté de la conservation et utilisation de virus variolique et de l'ADN viral : elle se fait sous la responsabilité de deux centres collaborateurs de l’OMS. Les mesures de précaution pour le futur ont aussi fait l'objet de propositions ; révision des règles de l'OMS de sécurité et de sûreté biologique ; inspection biennales de sécurité biologique des deux conservatoires mondiaux de virus variolique ; renforcement des règlementations nationales dans tous les pays.
Selon l'OMS, il convient de se préparer, mondialement et nationalement, à un évènement variolique de toute nature (réémergence naturelle, accident de laboratoire, bioterrorisme). Les mesures de santé publique prévues étant applicables de manière générale à tous les autres agents pathogènes dangereux. « Un niveau de préparation mondiale élevée contre les maladies infectieuses émergentes représente un investissement indispensable pour tous les États membres[95] ».
Agent de guerre biologique
Histoire
Durant le siège de Fort Pitt, au cours des guerres intercoloniales (1754–1763), les Britanniques se proposèrent d’utiliser la variole contre leurs adversaires indiens[107]. S’il n’est pas établi que ce dessein fut avalisé officiellement, un certain William Trent, négociant local, écrivit le 24 juin 1763 qu’« en signe d’égard pour eux (= les émissaires des assaillants indiens), nous leur donnâmes deux couvertures et un mouchoir provenant d’un hôpital de varioleux. J’espère que cela aura l’effet désiré »[108] - [109] - [110]. Les historiens ne s’accordent pas sur le point de savoir si cette tentative de disséminer la maladie réussit. Jeffery Amherst aurait également évoqué cette forme d'empoisonnement collectif, contre les Lenapes. Il a également été affirmé que la variole fut utilisée comme arme pendant la Guerre d'indépendance des États-Unis (1775–1783)[111] - [112].
Selon une théorie exposée dans Journal of Australian Studies (JAS) par un chercheur indépendant, des troupes d’infanterie de marine britanniques utilisèrent en 1789 la variole contre des tribus aborigènes en Nouvelle-Galles du Sud[113] ; ce même événement avait déjà été évoqué dans Bulletin of the History of Medicine[114], puis par David Day dans son ouvrage Claiming a Continent. A New History of Australia[115]. Dès avant l’article du JAS, cette théorie avait du reste déjà fait l’objet de discussions entre certains universitaires[116]. Le professeur Jack Carmody objecta qu’il est plus probable que l’épidémie en question ait été provoquée par la varicelle qui, à cette époque, était parfois identifiée comme une forme bénigne de variole. Cependant, si l’on avait tout d’abord souligné qu’il n’y eut aucun cas signalé de variole parmi les colons lors du voyage de huit mois de la « Première flotte », ni au cours des quatorze mois suivants, et qu’il est improbable, compte tenu que la période d'incubation de la variole est de 10 à 12 jours, que des germes de la maladie aient été emportés par ladite Première flotte, l’on sait aujourd’hui en revanche que des flacons de virus variolique détenus par les médecins de la Première flotte furent la source probable, et qu’il y eut bien, en réalité, un cas signalé de variole chez les colons, chez un matelot nommé Jefferies.
Pendant la Seconde Guerre mondiale, des scientifiques du Royaume-Uni, des États-Unis et du Japon (plus précisément l’Unité 731 de l’armée impériale japonaise) menèrent des recherches visant à produire une arme biologique à base de variole[117]. Toutefois, la production à grande échelle ne fut jamais décidée car la disponibilité universelle d’un vaccin rendait l’arme peu efficace[118].
En 1947, l’Union soviétique érigea une usine de fabrication d’armements à base de variole dans la ville de Zagorsk, à 75 km au nord-est de Moscou[119]. En 1971 éclata une épidémie de variole dont le virus responsable provenait d’armes biologiques en phase d’essai dans une installation sur une île de la mer d'Aral. Le général et professeur Peter Burgasov, ancien médecin militaire en chef dans l’armée soviétique et cadre supérieur du programme soviétique d’armements biologiques, décrivit ainsi l’incident :
« Sur l’île de Vozrojdénia, dans la mer d’Aral, l’on était en train de tester les préparations varioliques les plus puissantes. Soudain, l’on m’informa qu’il y avait de mystérieux cas de décès à Aralsk. Un navire de recherche de la flotte d’Aral était venu à 15 km de l’île (il était interdit de s’en approcher à moins de 40 km). La technicienne de labo de ce navire prélevait des échantillons de plancton deux fois par jour depuis le pont supérieur. La préparation variolique — dont 400 g avait explosé sur l’île — « l’avait saisie » et elle en avait été infectée. À son retour à Aralsk, elle avait contaminé plusieurs personnes, y compris des enfants. Tous moururent. J’en soupçonnais la raison et appelai le chef d’état-major du ministère de la Défense et le sollicitai d’interdire que le train Alma-Ata — Moscou fît arrêt à Aralsk. De la sorte, on empêcha une épidémie dans la région. J’appelai Andropov, qui à l’époque était chef du KGB, et l’informai de la préparation variolique exclusive obtenue sur l’île de Vozrojdénia[120] - [121]. »
D’autres auteurs inclinent cependant à penser que la première patiente contracta la maladie lorsqu’elle visita Uyaly ou Komsomolsk, dans l’Oust-Ourt, le bateau ayant fait escale dans ces deux villes côtières[122] - [123].
En 1991, cédant aux pressions internationales, le gouvernement soviétique autorisa une équipe conjointe d’inspecteurs américains et britanniques à effectuer une tournée d’inspection dans quatre des principaux sites de Biopreparat. Les inspecteurs furent confrontés à des réponses évasives et à des dénégations de la part des scientifiques soviétiques, pour s’entendre finalement donner l’ordre de quitter l’installation[124]. En 1992, le défecteur soviétique Ken Alibek affirma que le programme soviétique d’armements biologiques à Zagorsk avait produit un vaste stock — quelque vingt tonnes — de variole à usage militaire (utilisant peut-être un virus génétiquement manipulé capable de résister aux vaccins, selon ce qu’ajouta Alibek), en même temps que des ogives réfrigérées pour diriger le produit vers sa cible. Toutefois, les assertions d’Alibek sur les activités autour de la variole menées dans le cadre de l’ancien projet soviétique n’ont jamais pu être vérifiées de façon indépendante.
En 1997, le gouvernement russe annonça que tous ses échantillons de variole restants allaient être transférés à l’institut Vector à Koltsovo[124]. Après l’effondrement de l'Union soviétique et la mise au chômage de nombreux scientifiques naguère actifs dans les programmes d’armement, des représentants du gouvernement américain se dirent préoccupés à l'idée que le virus de la variole et le savoir-faire permettant de le conditionner à un usage militaire puissent tomber entre les mains d’autres gouvernements ou de groupes terroristes désireux d’utiliser des virus comme agents de guerre biologique[125]. Les allégations spécifiques faites à l’encontre de l’Irak à cet égard se sont toutefois révélées fausses[126].
Données actuelles (XXIe siècle)
En , les experts de l'AGIES (Advisory Group of Independant Experts), ou Groupe consultatif indépendant de l'OMS sur la recherche variolique, ont exprimé leurs préoccupations sur les progrès réalisés en biologie de synthèse permettant à des laboratoires de petite taille de manipuler le virus, voire de le recréer à partir de génomes numérisés (informations sur les séquences de l'ADN viral dans les banques de données)[95]. En effet, l’insertion, dans des orthopoxvirus existants, d’ADN variolique synthétique pourrait permettre de reconstituer le virus[127], ce qui augmente les risques d'accident de laboratoire et d'utilisation à des fins bioterroristes ou militaires. La première étape dans la réduction de ce risque devrait, selon certains, consister à détruire les stocks de virus restants, de sorte que toute détention ultérieure du virus puisse être criminalisée sans ambiguïté[128].
La mise en circulation délibérée d'un aérosol de virus variolique entraînerait une vaste dissémination compte tenu de la grande stabilité du virus dans l'environnement et de sa faible dose infectieuse. La survie du virus dans le milieu extérieur est inversement proportionnelle à la température et à l'humidité (favorisée par le froid et le sec). Selon ces conditions, le virus resterait viable de 6 heures (en été humide) à un peu plus de 24 heures (hiver sec)[28].
En France, le Haut Conseil de la santé publique estime que la mortalité induite serait de 30 à 50 % chez les malades non vaccinés. Le risque de développer la maladie chez les sujets contacts serait de 95 % chez les non-vaccinés, de 12 % chez les anciens vaccinés (plus de 10 ans), et de 4 % chez ceux à jour de leur vaccination. En 2012, il existait une absence totale d'immunité chez les moins de 35 ans, les rendant plus sensibles à la variole, mais aussi aux complications des vaccins de première génération[13].
Divinités, saints et héros associés à la variole

L'importance de la variole se traduit par l'existence de nombreux cultes visant à s'en protéger.
En Europe médiévale, le saint protecteur de la variole est saint Nicaise, évêque de Reims, guéri de la variole mais décapité par les Huns en 452[129].
En Inde, la déesse de la variole est Shitala Devi. Divinité populaire ancienne, son association avec la variole serait plus récente (XVIIIe siècle). Elle est représentée dans de nombreux temples et lieux de pèlerinage dans toute l'Inde. Ce rôle est amené à évoluer avec l'éradication de la variole[129]. En Inde du sud, chez les Tamouls, la divinité de la variole est Mariamman.
En Chine, la sainte de la variole est T'ou-Shen Niang-Niang, une religieuse bouddhiste qui aurait introduit la variolisation en Chine au XIe siècle. Au XIXe siècle, son culte est des plus populaires, car suivi par les chinois quelle que soit leur religion (temples dédiés dans toute la Chine)[129].
Au Japon, l'archer héros Tametomo du XIIe siècle est réputé pour avoir terrassé le démon de la variole. Son effigie peinte en rouge (couleur associée à la variole et supposée faciliter la guérison) était accrochée dans les salles de malades atteints de la variole[129].
En Afrique, Sakpata (nombreuses variantes, comme « Sopona ») est le dieu de la variole parmi les Yorubas (Royaume d'Oyo, royaume du Dahomey...) et leurs proches voisins du Nigeria, Togo et Bénin. Au XVIIIe siècle, le culte de Sakpata est assuré par des « féticheurs » qui proposent aussi pèlerinage et variolisation. Ce culte est transmis au Brésil par le commerce des esclaves (de langue ou population yoruba), le dieu changeant de nom pour devenir Omolu ou Obaluaye[129].
Médias
Personnalités
Plusieurs personnages historiques ont contracté la variole (voir catégorie « mort de la variole ») :
On pense que le pharaon Ramsès V (-1150 à -1145) en serait mort, car des lésions cutanées évocatrices sont présentes sur le visage de sa momie ; de même les empereurs chinois Kangxi (1654-1722), Shunzhi (1638-1661) et peut-être Tongzhi (1856-1875) ; le daimyo (seigneur) japonais Date Masamune (1567-1636), qui perdit un œil à la suite de la maladie. Guru Har Krishan, 8e gourou des sikhs en 1664 ; le maharajah Ranjît Singh, « Lion du Pendjab », qui en perdit la vision de l’œil gauche. Cuitláhuac, dixième tlatoani (souverain) aztèque est mort de la variole en 1520, peu après que celle-ci eut été introduite en Amérique. L'empereur inca Huayna Capac en est mort de la variole en 1527. Pierre II fut victime de la maladie le à l'âge de 14 ans. Le prince-électeur Maximilien III Joseph de Bavière est mort de la variole en 1777.
En Europe, les conséquences de la variole ont souvent changé l’ordre des successions dynastiques : Louis XV succède à son arrière-grand-père Louis XIV à la suite de la mort des premiers en la ligne de succession et il meurt lui-même de cette maladie en 1774. Le seul fils survivant d'Henri VIII, Édouard VI, est probablement mort de complications peu de temps après avoir guéri de la maladie. Ses successeurs immédiats furent des femmes.
Guillaume III d'Angleterre perd sa mère de la maladie alors qu'il n'a que dix ans en 1660, et son oncle Charles devient son tuteur légal. Son épouse et cousine Marie II meurt elle aussi de la variole en 1694. Cela déclenche une chaîne d’évènements qui aboutit à l'éviction permanente de la lignée des Stuart du trône britannique.
Mirabeau et Danton, ainsi que Mozart et Beethoven, ont contracté et survécu à la maladie étant enfants ; tous les quatre étaient porteurs de cicatrices visibles au visage. Goethe en revanche, qui contracta la maladie dans la décennie 1750, n’en garda aucune séquelle, ce qu'il relata ainsi :
« Je venais de m’acheter le Fortunatus avec sa bourse et son chapeau magique, lorsque je fus pris de malaise et de fièvre, par lesquelles s’annonçait la variole. L’inoculation de celle-ci était encore considérée chez nous comme très problématique, et quoique des auteurs en vue l’eussent recommandée de manière intelligible et insistante, les médecins allemands étaient hésitants devant une opération qui leur semblait usurper la nature. Des Anglais spéculateurs vinrent donc sur le continent et inoculaient, contre un honoraire considérable, les enfants de ceux qui étaient à la fois fortunés et exempts de préjugés. La majorité cependant était toujours exposée à l’ancien fléau ; la maladie faisait rage à travers les familles, tuait et défigurait nombre d’enfants, et peu de parents s’enhardissaient à avoir recours à un remède dont le probable bénéfice avait pourtant déjà été corroboré par le succès qu’on en avait obtenu à de multiples occasions. Le mal frappa à présent aussi notre maison et s’empara de moi avec une violence particulière. Mon corps tout entier était parsemé de vésicules, mon visage en était recouvert, et je restai allongé pendant plusieurs jours, rendu aveugle, et dans de grandes souffrances. L’on essaya sur moi tous les soulagements possibles et l’on me promettait monts et merveilles, si je voulais bien garder mon calme et ne pas aggraver le mal en me frottant et me grattant. Je pus me maîtriser ; entre-temps, en accord avec un préjugé qui régnait alors, l’on nous tint chaud autant que possible, par quoi l’on ne fit qu’exacerber le mal. Finalement, au terme d’un laps de temps écoulé tristement, cela me tomba du visage comme un masque, sans que les vésicules laissassent une trace visible sur la peau ; mais la conformation en avait sensiblement changé. J’étais moi-même satisfait, ne serait-ce que parce que je revoyais la lumière du jour et perdais peu à peu la peau tachetée ; mais d’autres étaient assez impitoyables pour me rappeler à maintes reprises mon ancien état ; (…)[130]. »
Les deux présidents des États-Unis George Washington et Abraham Lincoln contractèrent la maladie et en guérirent. Joseph Staline, qui fut durement marqué par la maladie tôt dans sa vie, a souvent fait retoucher des photos pour rendre ses cicatrices moins apparentes.
Le criminel Lucky Luciano contracta la maladie en 1907 à l'âge de dix ans, avant d’émigrer à New York depuis la Sicile. L’actrice indienne Geeta Bali est morte de la variole en 1965. Le poète turc Âşık Veysel Şatıroğlu fut rendu aveugle par la variole à l'âge de sept ans. Sehzade Mehmet, le fils de Soliman le Magnifique et de son épouse Hurrem sultan Roxelane, meurt de la variole en 1543 à l'âge de 21 ans.
Bibliographie
- Yves-Marie Bercé, Le chaudron et la lancette, croyances populaires et médecine préventive 1798-1830, Paris, Presses de la Renaissance, 1984. (ISBN 2-85616-283-5).
- (en) Frank Fenner et Donald Henderson (épidémiologiste), Smallpox and its eradication, Geneve, WHO, , 1460 p. (ISBN 92-4-156110-6, lire en ligne).
 Ouvrage monumental de référence sur l'histoire universelle de la variole, par les responsables de l'éradication, avec toutes les statistiques historiques, en accès libre, mais en anglais.
Ouvrage monumental de référence sur l'histoire universelle de la variole, par les responsables de l'éradication, avec toutes les statistiques historiques, en accès libre, mais en anglais. - Pierre Darmon, La Longue Traque de la variole. Les pionniers de la médecine préventive, Paris, Perrin, 1986.
- Jean-François Saluzzo, La variole, Paris, PUF, collection « Que sais-je ? » no 3690, 2004. (ISBN 2-13-053409-0)
 .
. - Catriona Seth, Les rois aussi en mouraient. Les Lumières en lutte contre la petite vérole, Paris, Desjonquères, 2008.
- Élise Fontenaille, L'Enfant rouge, Paris, Éditions Grasset et Fasquelle, 2002, 240 p. (ISBN 978-2246606512) - roman
- François de Gourcez, Qoëlet, Robert Laffont, 2006 - roman
Filmographie
- Outbreak: Anatomy of a Plague, documentaire québécois de Jefferson Lewis, 2010.
- Série X-Files : Aux frontières du réel, thème récurrent des saisons 1 à 9
- The unit, saison 2 épisode 1 – En territoire ennemi (2006)
- Dr House, saison 7, épisode 7 : En quarantaine (2010), suspicion de variole chez une jeune femme ayant récupéré un bocal dans une épave. Il s'agira finalement d'une rickettsialpox
- The Big Bang Theory, saison 5 épisode 13 : Bernadette annonce avoir accès à des armes biologiques et cite la variole.
- Série Urgences, saison 8 épisode 22 – « Épidémie » (2002) : suspicion de variole chez deux jeunes enfants ayant séjourné en Centrafrique.
- Deadwood, saison 1 épisode 6 : épidémie de variole au sein de la population.
- Helix saison 1 épisode 3 : les chercheurs du centre disposent d'un troisième échantillon de variole, pour le test d'un vaccin universel
- Les Aventures du jeune Indiana Jones, saison 1 épisode 6 : rencontre entre un village congolais décimé par la variole et la troupe militaire d'Indiana Jones.
- L'échange des princesses, film de Marc Dugain (2017), évoque la mort du roi Louis Ier d'Espagne et de son épouse, de la variole.
- American Horror Stories, saison 2 épisode 4, l'histoire se déroule au milieu des années 1700, aux États-Unis, dans un village qui subit une épidémie de variole.
Notes et références
- Article au sujet de la variole sur le site Doctissimo.
- Informations lexicographiques et étymologiques de « variole » (sens A) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales [consulté le 29 novembre 2016].
- Entrée « variole » (sens 1), dans Émile Littré, Dictionnaire de la langue française, t. 4 : Q – Z, Paris, Hachette, 1232 p., gr. in-4o (BNF 30824717, lire en ligne [fac-similé]), p. 2425 (lire en ligne [fac-similé]) [consulté le 29 novembre 2016].
- Entrée « variole », dans Dictionnaires de français, Larousse (lire en ligne) [consulté le 29 novembre 2016].
- J-F. Saluzzo, La variole, Paris, PUF, coll. « Que-sais-je ? » (no 3690), , 127 p. (ISBN 2-13-053409-0), p. 16Le texte porte « Marius, évêque d'Avranches », le contexte indiquant clairement qu'il ne peut s'agir que de Marius d'Avenches.
- B. Dupont, « Variole », La Revue de Médecine, nos 4-5, 24-31 janvier 1977, p. 233-238
- M. Gentilini, Médecine Tropicale, Paris, Flammarion, , 928 p. (ISBN 2-257-14394-9), p. 397-401
- (en) J.G. Breman et D.A. Henderson, « Diagnosis and Management of Smallpox », The New England Journal of Medicine, vol. 346, no 17, , p. 1300-1307
- (en) D. A. Henderson, Smallpox and Vaccinia, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), p. 775-778Dans Vaccines, fifth edition, S. Plotkin.
- Garnier Delamare, Dictionnaire des termes de médecine, Maloine, (ISBN 2-224-02381-2), p. 24
- M. Duvoir, « Alastrim » (fascicule 8049), Encyclopédie Médico-Chirurgicale, maladies infectieuses, , p. 1-5
- F. Goursolas, « Une épidémie de variole en Bretagne 1954-1955 », Histoire des Sciences Médicales, vol. XXXVIII, no 1, , p. 99-107 (lire en ligne)
- Haut Conseil de la santé publique (2012), Avis relatif à la révision du plan de lutte contre la variole publié le 21/12/2012 (PDF, 753 ko).
- Harrison, Principes de médecine interne, 16e édition, p. 285, 1042.
- OMS/Groupe consultatif d’experts indépendants chargé d’examiner le programme de recherche sur la variole (2010), Observations relatives à l'Analyse scientifique de la recherche sur le virus variolique, 1999-2010 ; Alerte et action au niveau mondial - ref : WHO/HSE/GAR/BDP/2010.4 ; décembre 2010, PDF, 44p, consulté 2013-07-20 (voir chapitre l'évolution de la variole pages 16 et suivantes).
- Yves Miserey « Le virus de la variole détecté dans un corps gelé en Sibérie », Le Figaro.fr, 22 novembre 2012.
- (en) Ryan KJ, Ray CG (editors), Sherris Medical Microbiology, McGraw Hill, , 4e éd. (ISBN 978-0-8385-8529-0, LCCN 2003054180), p. 525–8.
- (en) Orthopoxviruses Pathogenic for Humans, New York, Springer Science & Business Media, , 425 p. (ISBN 978-0-387-25300-8, lire en ligne).
- (en) John R Brown et Donald M McLean « Smallpox — A Retrospect » Canad Med Ass J. 1962;87:765-7.
- (en) Raymond W. Beck, A chronology of microbiology in historical context, ASM Press, 2000, (ISBN 1-55581-193-0 et 978-1-55581-193-8).
- J-M Hureaux, Traité de virologie médicale, Paris, ESTEM, , 699 p. (ISBN 2-84371-203-3), p. 262
- C. Chastel, Histoire des virus : de la variole au SIDA, Paris, éditions Boubée, , 413 p. (ISBN 2-85004-068-1), p. 150
- INVS, « Monkey Pox, Congo (Brazzaville) », Points épidémiologiques,
- Franck Fenner Donal Henderson, p. 1316.
- à ne pas confondre avec l'ectromèlie, au sens de malformation congénitale, par arrêt du développement d'un ou plusieurs membres, le sujet atteint étant dit ectromèle.
- J-F Saluzzo 2004, op. cit., p. 51-56.
- D.A. Henderson 2008, op. cit., p. 778-779.
- (en) D.A. Henderson, « Smallpox as a Biological Weapon, Medical and Public Health Management », The Journal of American Medical Association, vol. 281, no 22, , p. 2127-2137
- Gabon (1825), Nouvelle bibliothèque médicale, augmentée d'un recueil de médecine vétérinaire, et bulletin de l'Athénée de médecine de Paris, volume 9 (livre numérique Google), voir page 290, 292, 448, 450.
- http://www.invs.sante.fr/publications/variole_2001/variole_vf.pdf.
- Grosenbach DW, Honeychurch K, Rose EA et al. Oral tecovirimat for the treatment of smallpox, N Engl J Med, 2018;379:44-53
- (en) A.W Crosby, Smallpox, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 1008-1013dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- J-F. Saluzzo 2004, op. cit., p. 7-20.
- Franck Fenner Donald Henderson, p. 210-217.
- Gibbons Ann (2016) Virus found in child mummy suggests recent rise of deadly smallpox, ScienceMag ; news posté dans ArchaeologyBiologyHealth ; DOI: 10.1126/science.aal0487, publié 2016-12-08 ; consulté 2016-12-10
- D.A. Henderson 2008, op. cit., p. p.773-775.
- Sam Zylberberg, « Histoire des pandémies », sur JeRetiens, (consulté le )
- « Traité de la Variole, de Rhazès »
- Franck Fenner Donald Henderson, p. 229-232.
- Duggan A.T. & al. (2016) 17th Century Variola Virus Reveals the Recent History of Smallpox, Current Biology ; (ISSN 0960-9822) ; publié en ligne 2016-12-08, consulté 216-12-10
- Pierre Miquel, Mille ans de malheur : Les grandes épidémies du millénaire, Éditions Michel Lafon, , 285 p. (ISBN 978-2-7028-3832-7), p. 124-126, 129-130.
- Ainsi p.ex. Alexander von Humboldt, qui nota dans son Voyage aux régions équinoxiales du Nouveau Continent, fait en 1799-1804 : « En 1766, la population de Caracas et de la belle vallée dans laquelle cette ville est située, avait souffert immensément d’une cruelle épidémie de variole. La mortalité s’éleva dans la ville à six ou huit pour mille : depuis cette époque mémorable, l’inoculation s’est généralisée, et je l’ai vue pratiquer sans l’aide de médecins. Dans la province de Cumaná, où les communications avec l’Europe sont moins fréquentes, l’on avait plus eu depuis quinze ans un seul cas de variole, tandis qu’à Caracas cette cruelle maladie était crainte continuellement, car elle s’y montrait toujours sporadiquement, en plusieurs endroits à la fois ; je dis sporadiquement, car en Amérique équinoxiale, où les changements de l’atmosphère et les phénomènes de la vie organique apparaissent sujets à une périodicité notable, la variole, avant l’introduction si bénéfique de la vaccination, n’exerçait ses ravages (si l’on peut ajouter foi à une croyance très répandue) que tous les 15 ou 18 ans. ».
- E. Balaguer Perigüell et R. Ballester Añon, En el nombre de los Niños, p. 21.
- (en) Sheldon Watts, Epidemics and History : Disease, Power and Imperialism, New Haven/London, Yale University Press, (ISBN 9780300080872), chap. 3 (« Smallpox in the New World and in the Old : From Holocaust to Eradication, 1518 to 1977 »)
- E. Balaguer Perigüell et R. Ballester Añon, En el nombre de los Niños, p. 80.
- Franck Fenner Donald Henderson, p. 235-240.
- Franck Fenner Donald Henderson, p. 217-228.
- E. Balaguer Perigüell et R. Ballester Añon, En el nombre de los Niños, p. 81.
- Franck Fenner Donald Henderson, p. 240-241.
- Franck Fenner Donald Henderson, p. 233-235.
- Guide illustré des médecines d'Asie, collectif 1998 (ISBN 2-88086-195-0).
- Needham, Joseph. (1999). Science and Civilization in China: Volume 6, Biology and Biological Technology, Part 6, Medicine, Cambridge, Cambridge University Press, p. 154.
- Une histoire des microbes p. 206, Patrick Berche, 2007 (ISBN 2-7420-0674-5).
- Jean-Pierre Peter, « Les médecins français face au problème de l'inoculation variolique et de sa diffusion (1750-1790) », Annales de Bretagne et des pays de l'Ouest, no 86, , p. 251–264 (DOI 10.3406/abpo.1979.2980, lire en ligne)
- Marie de Testa & Antoine Gautier, Une grande famille latine de l'Empire ottoman : les Timoni, médecins, drogmans et hommes d'église, in Drogmans et diplomates européens auprès de la Porte ottomane, éditions ISIS, Istanbul, 2003, p. 235-255.
- Collectif La Recherche, Les grandes controverses scientifiques, Paris, Éditions Dunod, , 166 p. (ISBN 978-2-10-071033-1), p. 27
- Évelyne Lever Philippe Égalité, Fayard, 1996, p. 49.
- Catriona Seth, Les Rois aussi en mouraient. Les Lumières en lutte contre la petite vérole, Paris, Desjonquères, 2008.
- Jean-Baptiste Fressoz, « Comment sommes-nous devenus modernes ? Petite histoire philosophique du risque et de l'expertise à propos de l'inoculation et de la vaccine, 1750-1800 » [PDF], sur insee.fr,
- Bernoulli présente, le 16 avril 1760, en lecture publique son travail intitulé Essai d’une nouvelle analyse de la mortalité causée par la petite vérole, & des avantages de l’inoculation pour la prévenir ; l’encyclopédiste Jean Le Rond d'Alembert critique le travail de Bernoulli, qui n'a pas été encore publié (il le sera en 1765 seulement), lors d'une séance de l'Académie Royale des Sciences le . L'analyse de Bernoulli ne sera réhabilitée qu'au XXe siècle.
- Nicolas Dreyer et Jean-Pierre Gabrie, « Daniel Bernoulli et la variole », Bulletin de la Société des Enseignants Neuchâtelois de Sciences, no 39, (lire en ligne).
- Hervé Bazin, L'Histoire des vaccinations, Paris, J. Libbey Eurotext, (ISBN 978-2-7420-0705-9 et 2742007059, OCLC 470968279), p. 41-44
- M. de la Coste, Lettre sur l'inoculation de la petite vérole, comme elle se pratique en Turquie et en Angleterre, Paris, (lire en ligne), p. 26
- « Les hasards de la variole », par Jean-Marc Rohrbasser, sur Asterion.
- L'Histoire des vaccinations par Hervé Bazin, page 40.
- Yves-Marie Bercé « Le clergé et la diffusion de la vaccination » Revue d'histoire de l'Église de France 1983 .
- Sudhoffs Archiv, vol. 90 (2) p. 219-232, 2006, Stuttgart, Allemagne.
- Jean-Pierre Goubert, Initiation à une nouvelle histoire de la médecine, Paris, Ellipses, , 128 p. (ISBN 2-7298-9830-1), p. 96
- il fit pratiquer dès cette année dans son château de Liancourt et ses environs les premières vaccinations publiques d'après : André Eyquem, J. Alouf, A. Chippaux, Manuel des vaccinations et d'immunoprévention, éditions Piccin, 1998, (ISBN 88-299-1461-4).
- Le docteur Colon, la vaccine, et le château des deux girouettes. Résumé d'un article de Philippe Virat in Bull. Soc. hist. & arch. du XVe arrondt de Paris – no 41.
- Biraben Jean-Noël. La diffusion de la vaccination en France au XIXe siècle. In: Annales de Bretagne et des pays de l'Ouest. Tome 86, numéro 2, 1979. La médicalisation en France du XVIIIe au début du XXe siècle. p. 265-276.
- « Propagation de la vaccine, 1805-1813 ».
- Dès les années 1864, l'Institut Chambon, un établissement privé, fournit médecins de ville et Assistance Publique en pulpe animale. Afin d'éviter la transmission de la syphilis en 1884, l'Armée s'inspire de cet Institut et fonde l'institut Vaccinogène. Voir La Philosophie du remède par Jean-Claude Beaune, J. Azéma.
- E. Balaguer Perigüell et R. Ballester Añon, En el nombre de los Niños, p. 23.
- http://www.academie-medecine.fr/userfiles/file/Fonds_patrimoniaux/Fonds%20Fasquelle,%20Robert.pdf.
- Claudine Marenco, « "Majeur et vacciné": idéologie et prévention », Sciences sociales et santé, no 2, , p. 135–165 (DOI 10.3406/sosan.1984.985, lire en ligne)
- « Pavillon 10 : l’épidémie de variole vannetaise portée à l’écran », En Envor, consulté le 18 septembre 2013.
- « Il y a 50 ans, Vannes en proie à la variole devient « pestiféré », Libération, .
- [Plan national de réponse à une menace de variole] – Ministère de la santé et des solidarités, août 2006 Le 21/12/2012 Avis relatif à la révision du plan de lutte contre la variole.
- Questions Réponses « Pour les personnes qui ont été vaccinées avant 1980, il est établi que ce vaccin contre la variole induit une réponse immunitaire contre l’ensemble des orthopoxvirus et peut protéger contre le Monkeypox. Cependant, la persistance d’un titre d’anticorps suffisant pour protéger de l’infection, au-delà de 20 ans après la primo-vaccination, n’est pas garantie. »
- (en) Donald A. Henderson et Bernard Moss, « Smallpox and Vaccinia », sur ncbi.nlm.nih.gov, Saunders,
- Patrick Berche, L'histoire secrète des guerres biologiques: Mensonges et crimes d'État, éditions Robert Laffont, 5 mai 2011, 334 p.
- Rapport final de la Commission mondiale pour la Certification de l'Éradication.
- International Notes—Quarantine Measures Smallpox—Stockholm, in MMWR, 1996, vol. 45, no 25, pages 538-545, Suède, 1963.
- W. Ehrengut, Smallpox in Yugoslavia in 1972, Med. Klin, n22 (69), 1974, p. 350-235, op. cité par Patrick Berche dans L'histoire secrète des guerres biologiques. Mensonges et crimes d'État. Robert Laffont, 2009, p. 300.
- Franck Fenner Donald Henderson, p. 844-845.
- Franck Fenner Donald Henderson, p. 1062-1063.
- L'éradication correspond à la disparition de l'agent étiologique, ce qui la distingue de l'élimination qui désigne la disparition de la maladie alors que l'agent étiologique continue à circuler. L'éradication est possible grâce à la conjonction de plusieurs facteurs : la maladie n'a pas de réservoir extra-humain, de formes infra-cliniques et de portage asymptomatique ; la vaccination est particulièrement efficace grâce à une longue mémoire immunitaire protectrice. cf. Philippe Sansonetti, Vaccins, Odile Jacob, , p. 87
- Smallpox sur le site de l'OMS.
- http://whqlibdoc.who.int/smallpox/WORLD_HEALTH_MAY_1980_fre.pdf.
- Franck Fenner Donald Henderson, p. 1274-1276.
- OMS (1978) Relevé épidémiologique hebdomadaire de l'OMS, no 35, p. 265-266[PDF].
- Franck Fenner Donald Henderson, p. 1097-1098.
- OMS/Groupe consultatif d’experts indépendants chargé d’examiner le programme de recherche sur la variole (2010), Observations relatives à l'Analyse scientifique de la recherche sur le virus variolique, 1999-2010 ; Alerte et action au niveau mondial - ref : WHO/HSE/GAR/BDP/2010.4 ; décembre 2010, PDF, 44 p., consulté 2013-07-20 (voir page 16/44).
- « La variole dans l'ère postéradication », Relevé épidémiologique hebdomadaire, , p. 257-264 (lire en ligne).
- J-F. Saluzzo 2004, op. cit., p. 102-106.
- Hôpital Claude Bernard. Journées (46th : 2003 : Paris, France), Les infections virales émergentes : enjeux collectifs, Les Ulis, Editions EDK, , 111 p. (ISBN 978-2-7598-0742-0 et 2-7598-0742-8, OCLC 760884136)
- J-F. Saluzzo 2004, op. cit., p. 123.
- « Plan variol final aout 2006 ».
- Décret no 2003-313 du déterminant les mesures propres à empêcher la propagation d'une épidémie de variole en France.
- « plan variole 2006 »
- « Révision du plan de lutte contre la variole », sur hcsp.fr (consulté le )
- « État d'avancement de la révision du plan variole », sur senat.fr (consulté le )
- Comité consultatif OMS de la Recherche sur le Virus variolique, Rapport de la douzième réunion, Genève, Suisse, 2010, référence WHO/HSE/GAR/BDP/2010.5, 60 pages (lire p. 12)[PDF].
- Observations de l’AGIES relatives à l’analyse scientifique de la recherche sur le virus variolique, 1999-2010 Genève, Suisse, décembre 2010.
- OMS/Groupe consultatif d’experts indépendants chargé d’examiner le programme de recherche sur la variole (2010), Observations relatives à l'Analyse scientifique de la recherche sur le virus variolique, 1999-2010 ; Alerte et action au niveau mondial - ref : WHO/HSE/GAR/BDP/2010.4 ; décembre 2010, PDF, 44p, consulté 2013-07-20.
- Peckham, Indian Uprising, p. 226 ; Anderson, Crucible of War, 809n ; Grenier, First Way of War, p. 144 ; Nester, Haughty Conquerors, p. 114–15.
- Colonial Germ Warfare, Harold B. Gill, Jr., CW Journal: Spring 04.
- Anderson, Crucible of War, p. 541–42.
- Jennings, Empire of Fortune, p. 447, note 26.
- « BBC – History – Silent Weapon: Smallpox and Biological Warfare » (consulté le ).
- Elizabeth A. Fenn. « Biological Warfare in Eighteenth-Century North America: Beyond Jeffery Amherst, » The Journal of American History, vol. 86, no 4 (mars 2000), p. 1552–1580.
- Warren, Christopher « Smallpox at Sydney Cove – who, when, why? », Journal Of Australian Studies, http://www.tandfonline.com/doi/abs/10.1080/14443058.2013.849750#preview.
- "Smallpox and Cowpox Under the Southern Cross: The Smallpox Epidemic of 1789", Vol. 83 pt. 1, p. 37-62.
- Harper Collins Publishers, Sydney, 2001, p. 42f.
- « Chicken pox or smallpox in the colony at Sydney Cove in April, 1789 », sur Radio National,
- « USAMRIID's Medical Management of Biological Casualties Handbook » [PDF] (consulté le ).
- (en) « BBC – History – Silent Weapon: Smallpox and Biological Warfare » (consulté le ).
- Kenneth Alibek et S. Handelman, Biohazard : The Chilling True Story of the Largest Covert Biological Weapons Program in the World—Told from Inside by the Man Who Ran It, New York, Delta, (ISBN 0-385-33496-6).
- (en) D. Shoham et Z. Wolfson, « The Russian biological weapons program: vanished or disappeared? », Crit. Rev. Microbiol., vol. 30, no 4, , p. 241–61 (PMID 15646399, DOI 10.1080/10408410490468812, lire en ligne).
- (ru) « Smallpox – not a bad weapon », Interview with General Burgasov, Moscow News (consulté le ).
- (en) M. Enserink, « Biowarfare. Did bioweapons test cause a deadly smallpox outbreak? », Science, vol. 296, no 5576, , p. 2116–7 (PMID 12077372, DOI 10.1126/science.296.5576.2116).
- (en) Michael Bellomo et Alan P. Zelicoff, Microbe : are we ready for the next plague?, New York, American Management Association, , 273 p. (ISBN 978-0-8144-0865-0), p. 101.
- (en) Richard Preston, The Demon in the Freezer, Fawcett, , 292 p. (ISBN 978-0-345-46663-1 et 0-345-46663-2), p. 105–115.
- History and Epidemiology of Global Smallpox Eradication, extrait du cours de formation intitulé Smallpox: Disease, Prevention, and Intervention. CDC et Organisation mondiale de la santé. Diapos 16–17.
- Oliver Burkeman (19 septembre 2003). "No evidence of smallpox". The Guardian. Consulté le 10 mai 2012.
- The Genetic Engineering of Smallpox. WHO’s Retreat from the Eradication of Smallpox Virus and Why it Should be Stopped A BRIEFING PAPER BY THE SUNSHINE PROJECT. 2002.
- Smallpox Virus Stocks at the 64th WHA – Implementing the Conclusions of the Major Review Third World Network, Briefing Paper par Edward Hammond, page 8.
- Franck Fenner Donald Andersson, p. 219.
- Dichtung und Wahrheit (Poésie et Vérité), Première Partie, Livre premier, éd. Insel Verlag, vol. 5, Francfort-sur-le-Main 1970, p. 34 ; traduction par nos soins. On peut y ajouter la description saisissante faite par Casanova de la variole contractée vers 1735 par la fillette de sa famille adoptive à Padoue : « La pauvre fille fut tellement couverte de cette peste que le sixième jour on ne voyait plus sa peau dans aucune partie de son corps. Ses yeux se fermèrent, et l’on désespéra de sa vie lorsqu’on s’aperçut qu’elle en avait la bouche et le gosier tellement remplis qu’on ne pouvait plus lui introduire dans l’œsophage que quelques gouttes de miel. On n’apercevait plus en elle d’autre mouvement que celui de la respiration. […] Cette pauvre personne était devenue quelque chose d’affreux ; sa tête avait grossi d’un tiers ; on ne lui voyait plus de nez, et on craignait pour ses yeux lors même qu’elle en réchapperait. Ce qui m’incommodait le plus, mais que je persistai à vouloir supporter, c’était l’odeur de la respiration. » (Mémoires, tome I, chap. III, p. 109-110 de l’éd. Le Livre de Poche).
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ICD9Data.com
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « La plus grande tueuse de tous les temps » historia.fr, 15 avril 2020
- « Variole, le retour ? » La Méthode Scientifique, France Culture, 27 septembre 2018
- (en) Eurosurveillance
- (en) Z Moore, J Seward, J Lane, « Smallpox » Lancet 2006;367:425–35.