Variole du singe
La variole du singe, variole simienne, orthopoxvirose simienne, infection à virus monkeypox ou désormais « mpox » selon la terminologie adoptée le par l'Organisation mondiale de la santé (OMS), est une zoonose due à un virus de la famille des Poxviridae. Ce virus appartient au même genre Orthopoxvirus que celui de la variole humaine, maladie qui a été déclarée éradiquée par l'OMS depuis 1980.

| Causes | Virus de la variole du singe[1] |
|---|---|
| Transmission | Transmission aéroportée (d), transmission par contact (d), contamination par les sécrétions respiratoires (d) et transmission par surface contaminée (d) |
| Incubation min | 4 j |
| Incubation max | 20 j |
| Début habituel | 5-21 j post exposition |
| Durée | 2-5 semaines |
| Symptômes | F°, céphalée, myalgies, éruption vésiculeuse, adénopathies[2] |
| Diagnostic | Sérologie virale[3] |
|---|---|
| Différentiel | Varicelle, (variole éradiquée)[4] |
| Prévention | Vaccin contre la variole humaine (en) |
| Traitement | Prise en charge des symptômes |
| Médicament | Cidofovir |
| Spécialité | Infectiologie |
| Fréquence | Rare, en augmentation |
|---|---|
| Prévalence | Sporadique voire endémique dans des régions de l’Afrique de l’Ouest et centrale, près des forêts tropicales humides |
| Mortalité | 1 % à 3,6 % pour le clade ouest-africain, jusqu’à 10 % pour le clade centre-africain |
| CISP-2 | A76 |
|---|---|
| CIM-10 | B04 |
| CIM-9 | 059.01 |
| eMedicine | 1134714 |
| MeSH | D045908 |
![]() Mise en garde médicale
Mise en garde médicale
Elle est endémique principalement dans les forêts du centre de l'Afrique tropicale. Le virus, enzootique dans les forêts ombrophiles d'Afrique centrale et occidentale, peut se transmettre à l'humain et causer un syndrome dont les manifestations cliniques sont analogues à celles de la variole (éruption pustuleuse, fièvre, symptômes respiratoires…), mais moins graves.
La maladie peut être sévère dans certains cas, causant des décès chez 1 à 3,6 % (clade ouest-africain) ou 10 % (clade centrafricain) des malades en Afrique[5] - [6], la plupart chez les enfants, qui sont plus sensibles à la maladie, et les personnes immunodéprimées.
La plupart des patients se rétablissent avec des soins appropriés. La vaccination contre la variole humaine confère une protection efficace contre l'infection, allant jusqu’à 85 %[7], y compris après avoir été exposé au virus[8]. Les deux maladies peuvent être confondues et il n'existe pas de diagnostic clinique de certitude. Seule l'analyse en laboratoire permet de déterminer le virus à l’origine de l’infection[9].
Les chercheurs supposent que la transmission initiale se fait par contact direct ou indirect avec du sang, des liquides biologiques ou des lésions cutanées ou muqueuses de singes ou de rongeurs sauvages infectés. La consommation de gibier insuffisamment cuit est également considérée comme un risque possible. Entre humains, la transmission peut résulter de contacts étroits avec des sécrétions infectées des voies respiratoires, des lésions cutanées d’un sujet infecté, d’objets récemment contaminés par des liquides biologiques ou des matières provenant des lésions d’un patient. Selon l’OMS, la transmission se produit principalement par les particules des gouttelettes respiratoires et nécessite en général un contact face à face prolongé. Elle peut également survenir par inoculation ou par voie placentaire (orthopoxvirose simienne congénitale)[9].
Les premiers cas humains ont été décrits en 1970 en République démocratique du Congo. Le nombre de cas et d'épidémies semble augmenter en Afrique depuis 2000, vraisemblablement du fait de l’interruption de la vaccination antivariolique qui assurait une protection croisée contre la variole du singe.
En 2022, plusieurs milliers de cas sont détectés en Europe et en Amérique du Nord, ce qui est très inhabituel pour cette maladie. La maladie se transmet d'humain à humain, notamment par voie sexuelle. En août 2022, une transmission de maître à chien, est relevée à Paris.
Un nom controversé
La maladie a été nommée « variole du singe » car le virus, apparenté à celui de la variole, a été isolé chez un singe. Mais ce nom est inapproprié car la maladie n'est pas spécifique au singe et le réservoir animal du virus se situe plus vraisemblablement chez les rongeurs. Par ailleurs, pour une zoonose causant des épidémies humaines, ce nom a une connotation péjorative et donc stigmatisante, ce qui pourrait pousser certains patients à dissimuler leur maladie plutôt que de consulter et de prendre les mesures appropriées pour limiter les contagions.
Le , l'OMS s'est engagée à renommer la maladie[10]. Le , la ville de New York presse l'OMS de ne plus utiliser le nom de « Monkeypox »[11]. L'OMS a émis le la recommandation d'utiliser le nom « Mpox » à la place[12] - [13]. Ce nouveau nom s'applique pour l'anglais pour le moment, les décisions sur les traductions dans chaque langue prennent plus de temps, mais l'OMS indique que le nom peut être utilisé dans d'autres langues[14].
Historique
Découverte chez le singe
Le virus de la variole du singe a été découvert et isolé au Danemark en 1958, à partir des lésions d'une éruption généralisée survenue chez des macaques crabiers en captivité. Ces singes en provenance de Singapour étaient destinés au Statens Serum Institut (en) (Institut d'État de sérologie) de Copenhague. Une longue enquête de surveillance a été menée par l'OMS en Europe et aux États-Unis, car la découverte de ce virus fait peser une menace vis-à-vis de l'éradication de la variole humaine et un risque de zoonose[15] - [16].

On a pu ainsi observer une dizaine d'épidémies de variole du singe chez les singes en captivité (animalerie de laboratoire et zoo) surtout chez les macaques (de l'espèce Macaca cynomolgus ou fascicularis), les orangs-outans étant très sensibles (décès avant l'éruption)[15]. La plus importante fut celle du zoo de Rotterdam en 1964-1965[17]. La première épidémie détectée en France l'a été en 1968 dans une animalerie de l'Institut Pasteur chez des chimpanzés importés de Sierra Leone[15] - [18].
Ces épidémies ont cessé après 1968, avec l'amélioration des conditions de transport des singes importés, et une plus grande utilisation en laboratoire des singes nés en captivité. Les singes malades étaient importés d'Asie, mais les études révèlent qu'ils ont dû être infectés durant le transport, en contact avec d'autres singes ou autres animaux sauvages importés, et que l'habitat naturel du virus se trouve plutôt en Afrique[15] - [17].
En 1969, un colloque international de virologie tenu à Moscou définit le virus monkeypox comme une espèce distincte du virus de la variole humaine[17].
Découverte chez l'humain
Le premier cas humain a été découvert en 1970, à l'hôpital de Basankusu (Zaïre, aujourd'hui République démocratique du Congo). Il s'agissait d'un enfant d'un village de la région. L'hôpital de Basankusu couvre une large zone rurale dont la population était estimée à 62 000 habitants en 1970, en majorité petits agriculteurs et chasseurs-cueilleurs regroupés en petits villages situés à la lisière de forêt tropicale humide. Ce cas a été détecté dans des échantillons biologiques étudiés dans le cadre de la surveillance OMS de la variole (réseau international de laboratoires de référence, en l'occurrence celui de Moscou)[19].
En Afrique

D'autres cas surviennent dans les années qui suivent en Afrique de l'Ouest (Liberia, Sierra Leone, Nigeria, Côte d'Ivoire…). De 1981 à 1988, on compte de 300 à 400 cas survenus en Afrique centrale et de l'ouest, presque tous des cas isolés[20] - [21]. La plupart des épidémies décrites l'ont été en République démocratique du Congo (RDC) où des foyers naissent régulièrement depuis les années 1980 avec un premier cas en 1970 (1 malade) dans la région de l'Équateur, une épidémie (41 malades) en 1971-1980 et une autre (338 malades) en 1986. Les autres pays africains sporadiquement touchés sont : Cameroun, Gabon, Nigeria, République centrafricaine et Sierra Leone, qui ont connu quelques cas dans les années 1990[5] - [22].
Jusqu'alors, la variole du singe reste une maladie rare en Afrique, particulière à des petites localités en bordure forestière, et paraissant épargner les grandes villes, ce qui la distingue radicalement de ce que fut la variole[23].
La majorité des épidémies connues surviennent régulièrement en République démocratique du Congo, dans deux provinces (Kasaï Oriental et Équateur) dont celle de 1996-1997 (519 cas), puis en 1999 dans la région de Mbuji-Mayi avec 315 malades, encore une fois la province de l'Équateur en 2001 et 2002 avec respectivement 23 et 293 malades et enfin dans la région de Kabinda en 2005 avec 311 personnes malades[22]. En 2005, 19 cas ont été signalés au Sud Soudan dans la région de Bentiu[5] - [22].
Mi-2007, des épidémies ont encore sévi au Congo-Brazzaville dans la région de Likouala déjà touchée en 2003 (nord-est du pays – frontalière de la RDC), de à fin , avec presque 80 cas humains[5] - [22].
Depuis les années 2010, par rapport aux années 1980, le nombre de cas suspects, probables et confirmés a été multiplié par dix, ce qui reflèterait une réelle augmentation de la maladie et non une amélioration du système de surveillance considéré comme stable depuis 2008[24].
De 2017 à 2019, plus de trois mille cas ont été notifiés au Nigeria, en République démocratique du Congo et en Centrafrique[25] - [26].
En 2022, à la date du 8 juin, huit pays africains ont signalé à l'OMS 59 cas confirmés, 1 536 cas suspects et 72 décès. La République démocratique du Congo est le pays le plus touché avec 10 cas confirmés, 1 356 cas suspects et 64 décès[27].
Épidémie de 2003 (États-Unis)

La première épidémie non africaine de variole du singe est survenue en 2003 aux États-Unis où elle a été importée depuis le Ghana par plusieurs espèces de rongeurs sauvages, dont les rats de Gambie (nouveaux animaux de compagnie). Ceux-ci auraient contaminé des chiens de prairies dans des animaleries, eux-mêmes à l'origine de l'épidémie humaine[28].
Selon le CDC, le , 71 cas (dont 35 confirmés) ont concerné six États ; Wisconsin (39 cas), Indiana (16 cas), Illinois (12 cas), Missouri (2 cas), Kansas (1 cas), Ohio (1 cas)[22]. Le bilan final est de 82 personnes touchées, dont 47 cas confirmés. Tous les patients ont été en contact avec un chien de prairie malade. Il n'y a eu aucun décès et aucune transmission interhumaine, mais la maladie était similaire à celle existant en Afrique[5] - [29].
Les autorités fédérales de santé américaines ont alors interdit l'importation de tout rongeur africain (vente, distribution et transport), ainsi que le lâchage de chien de prairie domestique dans la nature. Outre le rat de Gambie, d'autres espèces africaines de rongeurs ont été interdites de lâchage : écureuil, porc-épic à queue en brosse, souris rayée, souris de la famille des gliridés[30]. En 2015, le rat de Gambie reste considéré comme un réservoir potentiel et un agent de transmission possible[31] - [32].
Cas en 2018 (Royaume-Uni, Israël, Singapour)
En 2018, trois cas humains sont signalés au Royaume-Uni, dont deux en provenance du Nigeria, le troisième étant un agent hospitalier contaminé (chargé du nettoyage de la literie), c'est le premier cas confirmé de transmission interhumaine hors d'Afrique[33]. D'autres cas importés ont été signalés en Israël (1 cas en 2018, un Israélien revenant du Nigeria) et à Singapour (1 cas en 2019, un Nigérian venu à Singapour)[33].
Cas en 2021 (Royaume-Uni, États-Unis)
En 2021, trois membres d'une même famille revenant du Nigeria sont touchés au Royaume-Uni. La même année deux cas importés sont signalés aux États-Unis, l'un au Texas, l'autre dans le Maryland[34].
Cas en 2022
Au , 1 285 cas confirmés en laboratoire sont détectés dans 28 pays non endémiques. Les pays qui signalent le plus de cas sont le Royaume-Uni (321 cas confirmés), l'Espagne (259 cas), le Portugal (191 cas), l'Allemagne (113 cas) et le Canada (110 cas)[27].
Au , 183 cas de variole du singe ont été confirmés en France[35].
Pour l'année 2022, sur l'ensemble du monde (pays endémiques et non endémiques), 83 943 cas confirmés en laboratoire et 75 décès ont été signalés à l'OMS par 110 pays[36].
Virus

| Royaume | Varidnaviria |
|---|---|
| Règne | Bamfordvirae |
| Embranchement | Nucleocytoviricota |
| Classe | Pokkesviricetes |
| Ordre | Chitovirales |
| Famille | Poxviridae |
| Sous-famille | Chordopoxvirinae |
| Genre | Orthopoxvirus |
L'agent causal de la variole du singe, l'Orthopoxvirus simien (MPxV) est un virus de la famille des poxviridae, sous-famille des Chordopoxvirinae, infectant les vertébrés, et du genre orthopoxvirus, un genre très important qui regroupe les virus de la variole humaine et des autres varioles animales[16] - [37].
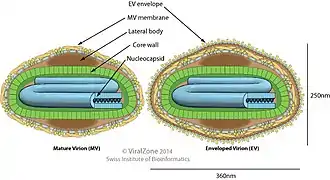
Comme les autres poxvirus, la capside du virion de la variole du singe se présente au microscope électronique sous une forme ovale biconcave ou « en petite brique ou en savonnette » entourée de « deux corps latéraux » de fonction inconnue[38] mais qui serait un artefact de fixation[37]. C'est un virus d'assez grande taille de 200 à 250 nm, avec deux enveloppes constituées de lipoprotéines, l'une interne entourant la capside, l'autre externe couverte de microtubules pour s'attacher à la surface des cellules[37].
Le génome du virus de la variole du singe est constitué d'un ADN linéaire à deux brins de 197 kb. Le cycle viral s'effectue dans le cytoplasme des cellules infectées. Toutes les protéines nécessaires à la réplication virale sont codées par la région centrale du génome viral tandis que celles qui interfèrent avec l'hôte sont codées par les régions terminales. Les nouveaux virions sont libérés lors de la mort de la cellule[37].
Les virus de la variole du singe se répartissent en une arborescence à deux clades principaux et deux sous-clades :
- clade hMPxV I (ex centrafricain) ;
- clade hMPxV II :
Le clade II est associé avec une moindre gravité et une faible létalité (moins de 1 %). Toutefois, plus d'études sont nécessaires[33].
Le virus de la variole du singe est classé au niveau 3 sur 4, sur une échelle de danger biologique[5].
Réservoir
Le réservoir du virus est représenté par les rongeurs, pangolins, écureuils des forêts tropicales humides d'Afrique centrale et de l'Ouest. Le réservoir exact n'a pas été identifié, parmi les candidats probables se trouvent les écureuils Funisciurus anerythrus[37] et Heliosciurus sp[21]. Il est possible aussi qu'il n'existe pas un réservoir naturel unique, mais une circulation virale, naturelle et occasionnelle, dans une large gamme d'espèces sauvages[37].
La maladie affecte les primates et d'autres mammifères (comme les gazelles et antilopes), essentiellement par contact avec les rongeurs sauvages, et occasionnellement l'humain (chasseur-cueilleur en forêt). Dans les années 1980, les Pygmées qui chassent dans les forêts reconnaissent la maladie sur photo et lui donnent un nom, alors que les Bantous qui vivent en communautés agricoles disent n'en avoir jamais vu[42].
Le maintien et la dynamique du virus circulant entre ces espèces sont mal connus. Le virus de la variole du singe est difficile à retrouver en milieu naturel, il n' a été isolé que deux fois dans la vie sauvage (chez un écureuil africain et chez un singe mangabey)[43].
Transmission
En principe, les cas humains surviennent de façon sporadique ou isolée, la transmission interhumaine étant considérée comme rare, mais les données épidémiologiques récentes suggèrent qu'elles sont en réalité plus importantes. Lors de l'épidémie qui a sévi en République démocratique du Congo en 1996 et 1997, 28 % des gens en contact direct avec un malade au cours de sa période d'incubation étaient touchés. Et en 2003, jusqu'à six « générations de transmission interhumaine » ont été décrites au Congo[22], mais ces chaînes de transmission sont en général courtes d'une à trois générations[33].
La transmission de l'animal à l'humain se fait par contact direct avec une lésion chez l'animal, par ses sécrétions respiratoires ou encore par contact indirect (litière contaminée)[44] ; en Afrique, par la capture, le dépeçage, la préparation et la consommation de gibier (animaux sauvages forestiers contaminés)[45] - [46].
La transmission d'une personne à l'autre est possible par :
- contact physique direct non protégé avec la peau lésée ou les fluides biologiques : actes de soin, contacts intimes… Selon une étude réalisée sur 16 pays en avril-juin 2022, et publiée en , 95 % de ces cas récents de contamination résultent d'un contact sexuel [47] - [48].
- contact indirect (partage d'instruments de toilette, contact avec vêtements, literie) ; une transmission par l'alimentation contaminée n'est pas exclue[49] ;
- par transmission aéroportée (gouttelettes respiratoires) à courte distance, mais prolongée en face à face non protégée. Par exemple voisins de transport, de bureau, salle de classe, de sport, de danse[9] - [50]… comme les grands rassemblements en extérieur de plusieurs heures[51].
La transmission de l'humain à l'animal n'a pas été signalée (à la date de 2020)[37]. En août 2022, une transmission de maitre à chien, relevée à Paris, fait craindre une transmission de la maladie, notamment par les rongeurs[52].
En l'état actuel des connaissances (2019-2022), la plupart des experts estiment que des épidémies humaines de variole du singe ne peuvent se développer en l'absence de réintroduction virale provenant d'une source animale proche[53]. Cependant, une transmission interhumaine ne doit pas être sous-estimée, ce qui nécessite une surveillance internationale accrue avec détection précoce des cas[24].
Clinique
Chez l'animal
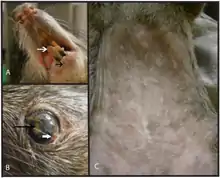
Chez le chien de prairie et d'autres rongeurs, la variole du singe débute par une léthargie, perte d'appétit, adénopathies, puis une inflammation oculaire et nasale évoluant vers une pneumonie[44].
Chez le singe, le plus souvent, aucun signe n'apparaît avant l'éruption. Cette éruption débute par des papules sur tout le corps, particulièrement à la paume des mains et la plante des pieds. Elles se transforment en vésicules et pustules croûteuses qui tombent en 7-10 jours en laissant des petites cicatrices[15].
La gravité de la maladie est variable selon les espèces de singes. Les plus sensibles sont l'orang-outan (Pongo pygmaeus), le macaque crabier (Macaca fascicularis), le mangabey fuligineux (Cercocebus atys) et le chimpanzé commun (Pan troglodytes)[16].
Les singes ne sont que des hôtes occasionnels par contact avec des rongeurs sauvages et, contrairement à sa dénomination d'origine, la variole du singe n'est pas liée spécifiquement aux singes, mais aux rongeurs sauvages[16].
Incubation et début
Chez l'humain, la variole du singe se présente cliniquement de façon similaire à la variole humaine, mais de gravité moindre. L'incubation est de l'ordre de 7 à 14 jours (extrêmes 5-21 jours)[54].
Le début est une fièvre élevée, des maux de tête avec douleurs musculaires et grande fatigue. Un caractère distinctif est la plus grande fréquence d'adénopathies le plus souvent localisées à la mâchoire et au cou, évocateur mais insuffisant toutefois pour un diagnostic clinique de certitude[38].
Éruption
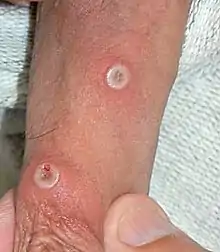
Dans les deux jours qui suivent (extrêmes 0-5 jours), une éruption caractéristique apparaît. Elle débute par un énanthème, lésions des muqueuses buccales parfois génitales, rapidement suivi par un exanthème d'abord à la face et aux extrémités (paume des mains et plante des pieds). Cette éruption s'étend ou non au reste du corps, selon une répartition centrifuge (prépondérance à la face et aux extrémités)[50].
L'éruption dure de 2 à 4 semaines. Elle est constituée d'éléments maculaires (tache) qui évoluent en papules puis en vésicules (chaque stade durant en moyenne 2 jours) et enfin en pustules. La plupart des pustules ont un diamètre de 5 mm (2-10 mm). Selon l'âge et l'état immunitaire du sujet, l'éruption peut être minime (quelques éléments) ou massive (plusieurs milliers). À la différence de la varicelle, l'éruption de la variole du singe se fait en une seule poussée, tous les éléments évoluent de façon synchrone en étant de même âge[50].
Le stade des pustules dure de 5 à 7 jours. Puis les pustules se dessèchent et deviennent croûteuses, annonçant la guérison spontanée, elles desquament et tombent. Quand toutes les croûtes sont tombées, le patient n'est plus considéré comme contagieux[50].
Il peut y avoir des séquelles éruptives : cicatrices ou taches hypopigmentées qui s'atténuent au fil du temps[55].
Nouvelles données 2022
En ce qui concerne l'épidémie de 2022 en pays non-endémiques, les cas surviennent principalement dans les réseaux homosexuels (patients signalant avoir eu une infection sexuellement transmissible l'année passée, ou avoir eu dix ou plus de partenaires sexuels dans les trois derniers mois)[56]. Alors qu'en Afrique, les catégories les plus à risques de formes graves sont les enfants, les femmes enceintes et les personnes immunodéprimées[57].
La répartition des lésions est inhabituelle par rapport à ce qui était connu. Elles sont plus fréquentes sur les zones génitales, la région anale et péri-anale. Le taux d'hospitalisation est estimé de 5 à 10 %[56]. Il se pourrait que ces lésions correspondent à des sites d'inoculation, en ayant un aspect similaire à d'autres infections sexuelles comme la syphilis primaire[57].
L'ADN du virus Mpox a été détecté dans les fluides sexuels des personnes infectées, mais ce n'est pas encore suffisant pour affirmer une transmission sexuelle stricto sensu [56] - [57].
Complications
Chez l'humain, la variole du singe se distingue de la variole par une gravité relativement moindre (létalité estimée entre 1 et 10 % en Afrique[22]) et une épidémiologie très différente (survenue sporadique, en cas isolés, en zone forestière). La plupart des décès surviennent chez les très jeunes enfants.
Les autres complications des formes graves sont :
- surinfections bactériennes de la peau ;
- déshydratation ;
- pneumonie ;
- cécité par infection de la cornée (kératite) ;
- sepsis ;
- encéphalite.
Diagnostic
L'aspect clinique et le contexte épidémiologique permettent d'évoquer le diagnostic[26].
Le diagnostic différentiel doit se faire avec la variole, la varicelle, la rougeole, les infections bactériennes cutanées, la gale, la syphilis et les allergies médicamenteuses.
En laboratoire, les méthodes immunologiques (titrage ELISA, recherche d'antigènes) ne permettent qu'un diagnostic d'orientation : elles indiquent la présence ou l'exposition à un orthopoxvirus, sans préciser lequel[37]. Le diagnostic de confirmation se fait par PCR et isolement du virus en culture cellulaire à partir de biopsie cutanée[26].
Traitement et prévention
Il n'existe pas de médicament spécifique. Le traitement est symptomatique[9]. Et ce, car les symptômes du virus Monkeypox se dissipent tous seuls. Par conséquent, le médecin traitant pourra prescrire divers médicaments afin de calmer les symptômes : antipyrétiques, analgésiques, anesthésique local (lidocaïne), etc.[58]
Il est toutefois possible, pour les cas les plus graves, de se voir prescrire un traitement par immunoglobines ou un antiviral, notamment le Tecovirimat (en).
Les anti-inflammatoires quant à eux sont interdits car ils provoquent de graves complications.
Des mesures au niveau de l’hygiène de vie sont également à adopter : l’hydratation, bien manger, dormir suffisamment, garder le contact avec ses proches, etc.[58]
Traitement de l’éruption cutanée
Il est essentiel de nettoyer les lésions afin d’éviter toute complication (surinfection). Les lésions cutanées seront nettoyées avec des bains au sel d’Epsom et bicarbonate de soude, un antiseptique, de l’eau stérilisée, etc. Quant aux lésions buccales, les bains de bouche à l’eau salée sont parfaitement indiqués.
Il est préférable de laisser les lésions à l’air libre, s’il n’y a aucun risque de contamination. Dans le cas contraire, un bandage devra impérativement les recouvrir[58].
La vaccination
La vaccination contre la variole donne une protection croisée contre la variole du singe (efficacité de 85 %)[9] ou une forme très atténuée de la maladie. L'arrêt des vaccinations à partir de 1980 pourrait expliquer une plus grande ampleur des transmissions interhumaines en Afrique. Le personnel soignant s'occupant de patients atteints de variole du singe devrait envisager une vaccination antivariolique. Dans tous les cas, le risque doit être réduit par l'évitement de contact physique avec le patient, le port d'un équipement protecteur (masque chirurgical et gants étanches), la désinfection des surfaces[59], la non-consommation d'aliments préparés par une personne symptomatique[49].
La prévention de la maladie pourrait passer par l'interdiction ou restriction du commerce des petits mammifères et singes africains. Les animaux en captivité ne doivent pas être vaccinés contre la variole (risque de vaccines animales). Les animaux suspects doivent être isolés et mis en quarantaine[9].
Le vaccin antivariolique de 3e génération MVA-BN (Modified Vaccinia Ankara de Bavarian Nordic (en) (IMVANEX en Europe, JYNNEOS aux États-Unis ou IMVAMUNE au Canada) est efficace contre la variole du singe. Il est administré par voie sous-cutanée. Le schéma vaccinal en primovaccination est de deux doses de 0,5 mL espacées d'au moins 28 jours. Les personnes vaccinées avec le vaccin de première génération n'auront que la dose de rappel[60].
Facteurs d'émergence
Premières hypothèses
Au début des années 1990, les spécialistes des poxvirus comme Frank Fenner considéraient la variole du singe comme une maladie sporadique rare, liée à la forêt tropicale humide africaine, circulant chez des mammifères arboricoles de la canopée, non reconnue car « masquée » par la variole épidémique. La variole du singe se serait ainsi dévoilée lors de l'éradication de la variole, en lien avec les modifications écologiques à la lisière de la forêt ombrophile (début de déforestation, proximité de communautés villageoises agricoles remplaçant les chasseurs-cueilleurs)[61].
Fenner envisageait deux processus contraires : la conversion de la forêt primaire en forêt secondaire augmente d'abord les contacts entre les humains et les animaux sauvages, tout en créant un habitat favorable à des espèces hôtes réservoirs comme les écureuils funisciurus chassés pour leur viande. D'un autre côté, le développement agricole réduit la nécessité de la chasse comme source de protéines animales. Il envisageait comme possible que la variole du singe, maladie émergente, devienne une maladie « en voie de disparition »[61].
Fenner considérait aussi que le concept théorique de niche écologique ne s'appliquait pas aux microorganismes en général (du moins à l'échelle macroenvironnementale), et aux poxvirus en particulier. Il s'opposait à l'hypothèse selon laquelle l'éradication de la variole et l'arrêt de sa vaccination pourraient créer une « niche vacante » susceptible d'être réoccupée par des virus voisins, comme celui de la variole du singe. Cette hypothèse paraissait d'autant plus improbable que des études montraient une faible transmission interhumaine de la variole du singe avec une reproduction de base inférieur à 1 (< 1)[33] - [62].
Le pronostic optimiste de maladie émergente appelée à disparaître a été invalidé après les émergences de variole du singe de 1996-1997 en République démocratique du Congo, l'extension aux États-Unis en 2003, et surtout après celle de 2017-2018 au Nigéria où il n'y avait plus de cas depuis 39 ans. Il s'avère désormais que la variole du singe n'est plus géographiquement limitée, mais qu'elle constitue une menace de santé globale[25].
Facteurs en discussion
Dès lors les facteurs d'émergence ou de réémergence de la variole du singe sont ceux qui favorisent une plus grande interface entre les humains et le monde animal domestique et sauvage (apparition ou développement de zoonoses) associés à une baisse de l'immunité collective envers les orthopoxvirus. Les principaux facteurs en discussion sont[5] - [33] :
_in_the_Democratic_Republic_of_the_Congo_2000-2012.jpg.webp)
- Changement climatique et déforestation. Les pluies excessives et les inondations (comme les grandes sècheresses) occasionnent des rassemblements humains et animaux. L'exploitation de la forêt tropicale favorise les contacts fréquents et prolongés entre hommes et animaux avec perturbation des écosystèmes (déplacement d'espèces animales, réduction de la biodiversité avec espèces envahissantes), ce qui favorise la circulation enzootique du virus de la variole du singe avec franchissement de la barrière des espèces[16] - [63].
- Conflits armés civils et militaires. Ils provoquent pauvreté et réfugiés qui peuvent s'abriter dans la forêt en étant contraints à consommer du gibier sauvage, ou à se déplacer en disséminant la maladie[63].
- Commerce international d'animaux sauvages, légal ou illégal (animaux de laboratoires, de compagnie…) qui favorise la promiscuité entre espèces différentes et l'extension de zoonoses. En Afrique, l'urbanisation croissante n'a pas fait disparaitre la consommation de gibier sauvage (bush meat ou « viande de brousse ») qui peut se maintenir pour des raisons culturelles[53].
- Baisse de l'immunité collective contre les orthopoxvirus. Depuis l'éradication de la variole et l'arrêt de la vaccination antivariolique, cette immunité grégaire décroît, puisque les personnes nées après 1980 ne bénéficient plus d'une immunité croisée (les orthopoxvirus étant très proches, l'immunité contre l'un protège aussi des autres). Il y aurait dès lors une « niche immunologique vacante » pour le virus de la variole du singe[16] - [37].
- Démographie et mobilité mondiales. La croissance démographique, l'urbanisation de zones rurales, la facilité et la rapidité des voyages intercontinentaux favorisent la dissémination d'infections virales jusqu'alors rares et localisées[16].
Notes et références
- (en) « About Monkeypox », sur www.cdc.gov, (consulté le ).
- (en) « Signs and Symptoms », sur www.cdc.gov, (consulté le ).
- (en) « 2003 United States Outbreak of Monkeypox », sur www.cdc.gov, (consulté le ).
- (en) « academic.oup.com » (consulté le ).
- (en) Nikola Sklenovská et Marc Van Ranst, « Emergence of Monkeypox as the Most Important Orthopoxvirus Infection in Humans », Frontiers in Public Health, vol. 6, (ISSN 2296-2565, DOI 10.3389/fpubh.2018.00241/full, lire en ligne, consulté le ) :
« Two genetic clades of Monkeypox virus have been characterized including the West African and the Central African clade. These two clades are geographically separated and have defined epidemiological and clinical differences. The West African clade demonstrates a case fatality rate (CFR) <1 %, and no human-to-human transmission was ever documented. In comparison, the Congo Basin clade (also known as the Central African clade) show a CFR up to 11 % (14), and documented human-to-human transmission up to 6 sequential events was observed. »
- (en) OMS, « Multi-country monkeypox outbreak in non-endemic countries », sur www.who.int, (consulté le ).
- (en) CDC, « Monkeypox - Treatment », (consulté le ).
- « Variole du singe : les États-Unis veulent vacciner les cas contacts », Sud Ouest et AFP, (ISSN 1760-6454, lire en ligne, consulté le ).
- OMS, « Orthopoxvirose simienne », sur www.who.int (consulté le ).
- Marc Gozlan, « « Variole du singe » : il est urgent de changer le nom du virus et de la maladie », sur Le Monde, (consulté le ).
- « Variole du singe : la ville de New York demande à l’OMS de ne plus utiliser ce nom « stigmatisant », Le Monde.fr, (lire en ligne, consulté le )
- Agence France-Presse, « L'OMS change le nom officiel de la variole du singe », sur TVA Nouvelles (consulté le )
- « Mpox : le nouveau nom en anglais pour la variole du singe pour éviter stigmatisation et commentaires racistes », sur Newsendip, (consulté le )
- (en) « WHO recommends new name for monkeypox disease », sur www.who.int (consulté le )
- Fenner 1988, p. 1288-1289.
- Natalia Ingrid Oliveira Silva, Jaqueline Silva de Oliveira, Erna Geessien Kroon et Giliane de Souza Trindade, « Here, There, and Everywhere: The Wide Host Range and Geographic Distribution of Zoonotic Orthopoxviruses », Viruses, vol. 13, no 1, , E43 (ISSN 1999-4915, PMID 33396609, PMCID 7823380, DOI 10.3390/v13010043, lire en ligne, consulté le ).
- Morse 1993, p. 176-177.
- Chastel 2006, p. 166.
- Fenner 1988, p. 923-925.
- Fenner 1988, p. 1292-1293.
- J-F Saluzzo, La variole, Paris, PUF, coll. « Que sais-je ? » (no 3690), , 127 p. (ISBN 2-13-053409-0), p.39-40.
- INVS, « Monkey Pox, Congo (Brazzaville) », Points épidémiologiques, ().
- Fenner 1988, p. 1311.
- (en) Eveline M. Bunge, Bernard Hoet, Liddy Chen et Florian Lienert, « The changing epidemiology of human monkeypox-A potential threat? A systematic review », PLoS neglected tropical diseases, vol. 16, no 2, , e0010141 (ISSN 1935-2735, PMID 35148313, PMCID 8870502, DOI 10.1371/journal.pntd.0010141, lire en ligne, consulté le ).
- (en) Adesola Yinka-Ogunleye, Olusola Aruna, Mahmood Dalhat et Dimie Ogoina, « Outbreak of human monkeypox in Nigeria in 2017–18: a clinical and epidemiological report », The Lancet Infectious Diseases, vol. 19, no 8, , p. 872–879 (ISSN 1473-3099 et 1474-4457, PMID 31285143, DOI 10.1016/S1473-3099(19)30294-4, lire en ligne, consulté le ).
- CMIT E. Pilly et C. Rapp, Maladies infectieuses et tropicales, Paris, Alinéa plus, (ISBN 978-2-916641-68-3), chap. 103 (« Poxviroses »), p. 499..
- (en) « Multi-country monkeypox outbreak: situation update », sur www.who.int (consulté le )
- Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Versailles, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), I. Biodiversité, écologie et maladies infectieuses, chap. 2 (« Quel est l'impact des espèces introduites sur l'émergence des maladies ? »), p. 33-34, accès libre.
- Chastel 2006, p. 172-174.
- (en) K.D. Reed, « The Detection of Monkeypox in Humans in the Western Hemisphere », The New England Journal of Medicine, nos 350 ; 4, , p.342-349.
- Christina L. Hutson, Yoshinori J. Nakazawa, Joshua Self et Victoria A. Olson, « Laboratory Investigations of African Pouched Rats (Cricetomys gambianus) as a Potential Reservoir Host Species for Monkeypox Virus », PLoS Neglected Tropical Diseases, vol. 9, no 10, (ISSN 1935-2727, PMID 26517724, PMCID 4627651, DOI 10.1371/journal.pntd.0004013, lire en ligne, consulté le ).
- Elizabeth A. Falendysz, Juan G. Lopera, Faye Lorenzsonn et Johanna S. Salzer, « Further Assessment of Monkeypox Virus Infection in Gambian Pouched Rats (Cricetomys gambianus) Using In Vivo Bioluminescent Imaging », PLoS neglected tropical diseases, vol. 9, no 10, , e0004130 (ISSN 1935-2735, PMID 26517839, PMCID 4627722, DOI 10.1371/journal.pntd.0004130, lire en ligne, consulté le ).
- (en) Karl Simpson, David Heymann, Colin S. Brown et W. John Edmunds, « Human monkeypox - After 40 years, an unintended consequence of smallpox eradication », Vaccine, vol. 38, no 33, , p. 5077–5081 (ISSN 1873-2518, PMID 32417140, DOI 10.1016/j.vaccine.2020.04.062, lire en ligne, consulté le ).
- (en-US) « Monkeypox in the United States | Monkeypox | Poxvirus | CDC », sur www.cdc.gov, (consulté le )
- « Cas de variole du singe : point de situation au 16 juin 2022 », sur www.santepubliquefrance.fr (consulté le )
- Andrea M. McCollum, « Epidémiologie de la variole simienne chez l'humain », Relevé épidémiologique hebdomadaire, vol. 98, no 3, , p. 39-40. (lire en ligne)
- (en) Emmanuel Alakunle, Ugo Moens, Godwin Nchinda et Malachy Ifeanyi Okeke, « Monkeypox Virus in Nigeria: Infection Biology, Epidemiology, and Evolution », Viruses, vol. 12, no 11, , E1257 (ISSN 1999-4915, PMID 33167496, PMCID 7694534, DOI 10.3390/v12111257, lire en ligne, consulté le ).
- J-M Huraux, Traité de virologie médicale, Paris, ESTEM, , 699 p. (ISBN 2-84371-203-3), p. 257 et 262.
- « Variole du singe: L'OMS veut renommer la maladie... Voici comment il faut désormais appeler les variants du monkeypox », sur L'Indépendant, .
- (en) « Monkeypox: experts give virus variants new names », sur OMS, .
- https://virological.org/t/urgent-need-for-a-non-discriminatory-and-non-stigmatizing-nomenclature-for-monkeypox-virus/853
- Fenner 1988, p. 1303.
- Mary G. Reynolds, Sarah Anne J. Guagliardo, Yoshinori J. Nakazawa et Jeffrey B. Doty, « Understanding orthopoxvirus host range and evolution: from the enigmatic to the usual suspects », Current Opinion in Virology, vol. 28, , p. 108–115 (ISSN 1879-6265, PMID 29288901, DOI 10.1016/j.coviro.2017.11.012, lire en ligne, consulté le ).
- Danielle M. Tack et Mary G. Reynolds, « Zoonotic Poxviruses Associated with Companion Animals », Animals: an open access journal from MDPI, vol. 1, no 4, , p. 377–395 (382-383) (ISSN 2076-2615, PMID 26486622, PMCID 4513476, DOI 10.3390/ani1040377, lire en ligne, consulté le ).
- Morse 1993, p. 182.
- Chastel 2006, p. 167.
- (en) John P. Thornhill, M.D., Ph.D., Sapha Barkati, M.D., Sharon Walmsley, M.D. et al., Monkeypox Virus Infection in Humans across 16 Countries — April–June 2022, nejm.org, 21 juillet 2022
- La majorité des cas récents de variole du singe transmis lors de relations sexuelles La majorité des cas récents de variole du singe transmis lors de relations sexuelles, lefigaro.fr, 22 juillet 2022
- https://www.anses.fr/fr/content/variole-du-singe-quel-risque-de-transmission-par-l%E2%80%99alimentation
- Marlyn Moore et Farah Zahra, « Monkeypox », dans StatPearls, StatPearls Publishing, (PMID 34662033, lire en ligne).
- Deidre McPhillips CNN, <ex.html « Monkeypox case reported in man whose 'primary risk factor' was close, nonsexual contact at a crowded outdoor event », sur CNN (consulté le )
- https://www.francetvinfo.fr/sante/maladie/variole-du-singe/variole-du-singe-l-oms-appelle-a-la-vigilance-apres-la-contamination-d-un-chien-par-la-variole-du-singe_5313019.html
- (en) Mary G. Reynolds, Jeffry B. Doty, Andrea M. McCollum et Victoria A. Olson, « Monkeypox re-emergence in Africa: a call to expand the concept and practice of One Health », Expert Review of Anti-Infective Therapy, vol. 17, no 2, , p. 129–139 (ISSN 1744-8336, PMID 30625020, PMCID 6438170, DOI 10.1080/14787210.2019.1567330, lire en ligne, consulté le ).
- (en-US) « Signs and Symptoms | Monkeypox | Poxvirus | CDC », sur www.cdc.gov, (consulté le ).
- Fenner 1988, p. 1297-1298.
- Antoine Gessain, Emmanuel Nakoune et Yazdan Yazdanpanah, « Monkeypox », The New England Journal of Medicine, vol. 387, no 19, , p. 1783–1793 (ISSN 1533-4406, PMID 36286263, DOI 10.1056/NEJMra2208860, lire en ligne, consulté le )
- Oriol Mitjà, Dimie Ogoina, Boghuma K. Titanji et Cristina Galvan, « Monkeypox », Lancet (London, England), vol. 401, no 10370, , p. 60–74 (ISSN 1474-547X, PMID 36403582, PMCID 9671644, DOI 10.1016/S0140-6736(22)02075-X, lire en ligne, consulté le )
- « Variole du singe : conseils et prise en charge à Bruxelles », sur https://www.ddg-gastro.be/
- https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-transmissibles-de-l-animal-a-l-homme/monkeypox/documents/depliant-flyer/info-monkeypox-fiche-conseil-a4
- https://ansm.sante.fr/uploads/2022/05/30/20220527-monkeypox-protocole-utilisation-note-info-pds-26-05-2022.pdf
- Morse 1993, p. 181-183.
- James O. Lloyd-Smith, « Vacated niches, competitive release and the community ecology of pathogen eradication », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 368, no 1623, , p. 20120150 (ISSN 1471-2970, PMID 23798698, PMCID 3720048, DOI 10.1098/rstb.2012.0150, lire en ligne, consulté le ).
- Nicolas Berthet, Stéphane Descorps-Declère, Camille Besombes et Manon Curaudeau, « Genomic history of human monkey pox infections in the Central African Republic between 2001 and 2018 », Scientific Reports, vol. 11, no 1, , p. 13085 (ISSN 2045-2322, PMID 34158533, PMCID 8219716, DOI 10.1038/s41598-021-92315-8, lire en ligne, consulté le ).
Voir aussi
Bibliographie
- (en) Frank Fenner, D. A Henderson, I. Arita, Z Jezek et I.D. Ladnyi, Smallpox and its Eradication, Genève, WHO, , 1460 p. (ISBN 92-4-156110-6, lire en ligne), chap. 29 (« Human monkeypox and other poxvirus infections of man »).
- (en) Stephen S. Morse (dir.) et Frank Fenner, Emerging Viruses, New York/Oxford, Oxford University Press, , 317 p. (ISBN 0-19-507444-0), chap. 16 (« Human Monkeypox, A Newly Discovered Human Virus Disease »).
- Claude Chastel, Virus émergents : Vers de nouvelles pandémies ?, Paris, Vuibert, (ISBN 978-2-7117-7198-1), chap. 12 (« Le monkeypox s'épidémise et franchit l'atlantique (2003) »).
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « Monkeypox », sur www.santepubliquefrance.fr (consulté le )
- (en-US) « Monkeypox | Poxvirus | CDC », sur www.cdc.gov, (consulté le )
- (en) « Monkeypox », sur www.who.int (consulté le )
- « La variole du singe : faut-il craindre une épidémie ? », La Méthode scientifique, France Culture, 13 juin 2022.

