Espèce envahissante
Une espèce envahissante, espèce envahissante exogène[2] ou espèce exotique envahissante (EEE)[3] - [4] ou encore espèce introduite envahissante[5] est une espèce vivante exotique (ou allochtone, non indigène, exogène ou étrangère), un néozoaire s'il s'agit d'un animal, qui devient un agent de perturbation nuisible à la biodiversité autochtone des écosystèmes naturels ou semi-naturels parmi lesquels elle s’est établie. Son explosion démographique peut se traduire par une invasion biologique.





Le terme d’espèce invasive est un anglicisme répandu qui a le même sens, mais il est peu utilisé dans les documents officiels en français[6] - [7]. L'espèce proliférante est, quant à elle, une espèce qui présente des pullulations dans une zone déterminée, ces proliférations pouvant survenir pour des espèces autochtones ou allochtones (par exemple celles à l'origine de bloom algal ou bactérien).
De 2000 à 2017, les invasions biologiques ont continué à se développer[1], à cause du commerce international notamment[8]. Elles sont selon l’ONU devenues la seconde cause de régression de la biodiversité[8] (avec la pollution, la fragmentation écologique des écosystèmes et la surexploitation des espèces, des milieux et ressources naturelles).
« Le qualificatif d'espèce envahissante désigne une espèce, une sous-espèce ou une entité de niveau taxonomique inférieur présente hors de son aire de répartition ou de son aire de dispersion potentielle (c'est-à-dire hors de la zone géographique qu’elle occupe naturellement ou peut occuper sans intervention humaine par introduction volontaire ou involontaire) et est applicable à toute partie d’un individu (gamète ou propagule) susceptible de survivre et de se reproduire[9]. »
En réalité, il faudrait parler de population envahissante et non d'espèce envahissante, et chez certaines espèces, seules quelques sous-espèces sont devenues envahissantes (ex. : Codium fragile ssp. tomentosoides, au sein des Codium). En Europe, on appelle parfois néophyte une espèce apparue après la découverte de l'Amérique (ou à partir de 1500)[10].
La biodiversité, lorsqu'elle n'est pas perturbée est en soi un facteur de résilience et de limitation de l'invasivité de nombreuses espèces introduites[11] - [12]. L'artificialisation d'un milieu est facteur d'invasivité d'espèces qui ne le seraient pas ailleurs[13]. L'ONU, l'UICN[14] et les scientifiques estiment que parallèlement à la dégradation, fragmentation et disparition des habitats, l’introduction d'espèces animales ou végétales (voire de fonge) exogènes et les dégâts liés à leur extension sont devenus l'une des causes majeures de régression de la diversité biologique, dans le monde comme en France[15].
Apparition de la notion et définitions
La notion écologique d'espèce envahissante est récente. Pour la comprendre, il faut savoir que les équilibres entre espèces au sein des écosystèmes, à échelle de temps humaine au moins, sont relativement bien établis. Sans intervention humaine, les phénomènes d'extension brutale de l'aire de répartition d'une espèce (dite envahissante) sont extrêmement rares (voir chorologie). L'homme, depuis qu'il a développé la chasse, l'agriculture et l'élevage, et plus encore depuis qu'il dispose de moyens techniques lui permettant d'être présent et de se déplacer rapidement sur tous les continents, est devenu le principal vecteur de déplacements d'espèces, volontairement ou accidentellement. Certaines sont devenues envahissantes lorsque la chasse a fait disparaître leur prédateur ou lorsque l'homme leur a offert une alimentation facile ou de nouveaux milieux faciles à coloniser (par exemple pour le sanglier qui bénéficie de cultures et forêts monospécifiques notamment ou encore de l'agrainage). Parfois, elles colonisent simplement l'aire de répartition et la niche écologique d'espèces que l'homme a fait disparaître ou a affaibli.
Beaucoup d'espèces introduites l'ont été involontairement ; le ballastage et déballastage des navires de commerce, le transport par les coques de péniches et de navires par exemple, est un vecteur d'introduction d'espèces qui a d'abord été ignoré, puis sous-estimé, et contre lequel peu de mesures sont prises. Certains comme Charles-François Boudouresque préfèrent parler d'espèces introduites pour marquer ce fait, mais toutes les espèces introduites ne se naturalisent pas, ni ne produisent une invasion biologique. Certaines demeurent très dépendantes des conditions artificielles provoquées par l'homme. La majorité des plantes exotiques sont stoppées par les changements de l'écosystème et par les interactions avec les populations indigènes.
Dans un environnement présentant une forte biodiversité, les ressources sont rares, elles sont déjà utilisées par les populations indigènes. En outre, une forte biodiversité induit la présence d’un prédateur efficace pour éradiquer la plante envahissante. En d’autre terme, une espèce étrangère a la possibilité d’envahir un écosystème pauvre en espèces si elle arrive sans maladies, parasites et/ou consommateurs (théorie d'allocation des ressources : hypothèse de l'accroissement de la compétitivité des espèces non indigènes (en)[16] versus hypothèse de libération des ennemis (en) naturels[17]).
Les populations naturalisées échappent souvent au contrôle humain, mais toutes ne deviennent pas envahissantes. Williamson (en) a défini la règle des 3 x 10 (appelée aussi la « règle des 10 % »)[18] en 1996 (nombre de taxons invasifs dix fois inférieur au nombre de taxons naturalisés, lui-même dix fois inférieur au nombre de taxons exotiques fugaces qui correspondent au dixième des espèces introduites[19] qu'environ une espèce introduite sur mille devient envahissante, c'est-à-dire induit un impact écologique (Cf. définition) mais cette notion a tout d'abord été une notion anthropique parce ce sont les impacts économiques ou sociaux sérieux que les humains ont remarqué en premier lieu.
Éléments de définition
Le terme de « plantes transformatrices » (de l'anglais transformers) désigne des plantes envahissantes causant des dommages avérés et importants sur le fonctionnement des écosystèmes[20].
En Europe
Des définitions officielles ont été publiées en 2010 :
Espèce exotique
tout spécimen vivant d'une espèce, d'une sous-espèce ou d'un taxon de rang inférieur d'animaux, de végétaux, de champignons ou de micro-organismes introduit en dehors de son aire de répartition naturelle, y compris toute partie, gamète, semence, œuf ou propagule de cette espèce, ainsi que tout hybride ou toute variété ou race susceptible de survivre et, ultérieurement, de se reproduire ;
Espèce exotique envahissante
une espèce exotique dont l'introduction ou la propagation s'est révélée constituer une menace pour la biodiversité et les services écosystémiques associés, ou avoir des effets néfastes sur la biodiversité et lesdits services ;
Espèce exotique envahissante préoccupante pour l'Union
une espèce exotique envahissante dont les effets néfastes ont été jugés de nature à exiger une action concertée au niveau de l'Union en vertu de l'article 4, paragraphe 3 ;
Espèce exotique envahissante préoccupante pour un État membre
une espèce exotique envahissante autre que les espèces exotiques envahissantes préoccupantes pour l'Union, pour laquelle un État membre considère, en s'appuyant sur des données scientifiques, que les effets néfastes de sa libération et de sa propagation, même s'ils ne sont pas pleinement démontrés, sont lourds de conséquences pour son territoire, ou une partie de celui-ci, et requièrent une action au niveau de l'État membre concerné.
Impacts des espèces envahissantes
Impacts sur la biodiversité
Les plantes envahissantes déjà présentes peuvent déstabiliser le milieu et favoriser l’implantation d’autres végétaux étrangers. Au fur et à mesure que l’écosystème se dégrade à cause des invasions biologiques, la réussite invasive des organismes suivants augmente.
Certaines plantes ou espèces (animal, champignon) introduites, devenues très invasives, ont des impacts considérables sur la biodiversité, soit par la concurrence qu'elles exercent pour l'espace où elles croissent (ex : Caulerpa taxifolia en Méditerranée, appelée algue tueuse par les médias), soit indirectement par des substances écotoxiques ou inhibitrices qu'elles émettent pour d'autres espèces, ou simplement parce qu'elles ne sont pas consommables par les herbivores natifs ou d'autres animaux autochtones. Elles posent de graves problèmes de pollution génétique, par hybridation avec des espèces parentes. Elles peuvent aussi être sources d'épidémies (zoonoses et parasitoses en particulier). Elles sont, selon l'évaluation des écosystèmes pour le millénaire (2005), la seconde cause de régression de la biodiversité et elles ont causé la moitié des disparitions identifiées depuis 400 ans, ce qui en fait une menace pour de nombreuses autres espèces et pour certains services écosystémiques dans le contexte du changement global[21]. Usher estimait déjà en 1988 qu'aucune zone n'était épargnée, sauf peut-être l'Antarctique[22]. Les zones humides, qui ont toujours été des couloirs de migration pour l'homme, et des couloirs de dispersion via les cours d'eau et les crues y sont très vulnérables (Moyle and Light, 1996 ; van der Velde et al., 2006). Elles ne couvrent plus que 6 % environ de la surface de la terre, mais on y trouve 24 % (8 sur 33) des plantes classées comme étant les plus envahissantes au monde (Zedler and Kercher, 2004).

À titre d'exemple, la renouée du Japon, envahisseuse des berges de cours d'eau et de certains talus d'infrastructure, fait significativement reculer la biodiversité là où elle s'étend en taches très monospécifiques. Il était visible que sa progression se faisait toujours au détriment de la flore locale (herbacées notamment), mais une étude récente a montré que la diversité en vertébrés et surtout en invertébrés en pâtissent aussi : l'abondance totale des invertébrés chute en moyenne d’environ 40 % sur les cours d'eau inventoriés, tandis que le nombre de leurs groupes (taxons) chute lui de 20 à 30 %. Secondairement — comme d'autres plantes envahissantes —, la renouée fait reculer les populations d’amphibiens, reptiles, et oiseaux ainsi que de nombreux mammifères des habitats ripicoles, car ces derniers dépendent directement ou indirectement des espèces herbacées autochtones et/ou des invertébrés associés pour leur survie[23]. De plus, la renouée s'installe plus facilement sur des néo-sols et milieux dégradés, pauvres en biodiversité.
Selon Jacques Tassin[24], les invasions biologiques sont un peu facilement implicitement accusées « d’appauvrir les milieux naturels, alors qu'elles ne sont souvent que les révélatrices de dégradations liées à l’Homme ».
Impacts écoépidémiologiques
On sait que, de manière générale, un nombre élevé d'espèces natives (biodiversité) limite les risques de grandes épidémies[25] - [26].
Le risque de persistance d'une maladie varie néanmoins selon les relations prédateur-proie et de compétition entre espèces[27]. Le nombre d'espèces-hôtes pour un pathogène ou parasite a également une importance[28].
Les espèces envahissantes présentent des dynamiques de population très particulières, qui modifient parfois fortement la dynamique des agents pathogènes enzootiques, en cassant les équilibres écoépidémiologiques en place[29]. Leur contribution à la diffusion de pathogènes et de maladies émergentes pourrait avoir été sous-estimée, tant au sein de l'humanité (pour des maladies émergentes telles que le West Nile Virus par exemple[30] - [31]), que pour le monde sauvage[32]. Elles pourraient ainsi parfois accélérer, aggraver certaines zoonoses (ex. : l'écureuil gris invasif transporte un microbe qui tue l'écureuil roux). Elles peuvent aussi accroître certains risques épidémiologiques pour l'humanité. Par exemple, la prévalence des hantavirus augmente statistiquement nettement dans les zones où la biodiversité des rongeurs est plus faible[33].
Selon les modèles théoriques, quand une espèce envahissante naïve entre dans un système hôte-parasite établi, ce nouvel hôte peut tantôt réduire (« diluer ») ou augmenter (« spill-back ») la transmission des agents pathogènes pour les espèces-hôtes indigènes. Les données empiriques sont assez rares, notamment concernant les agents pathogènes des animaux. À titre d'exemple, le Buggy Creek virus (BCRV) (alphavirus transportés par des arthropodes et transmis via la piqûre de Oeciacus vicarius) à l'hirondelle à front blanc (Petrochelidon pyrrhonota) dont la reproduction est coloniale) a été étudié de ce point de vue. Dans l'ouest du Nebraska, le moineau domestique (Passer domesticus) a envahi des falaises qui abritaient des colonies de reproduction d'hirondelles (il y a environ 40 ans)[34]. Ils ont été exposés au virus BCRV. Une étude a évalué l'impact de cette exposition et comment l'ajout de moineaux domestiques à ce système hôte-parasite a affecté la prévalence et l'amplification d'une lignée « aviaire » du virus BCRV. Les chercheurs ont constaté que la prévalence de l'infection chez les moineaux était huit fois celle des hirondelles à front blanc. Et les hirondelles nichant dans une colonie mixte étaient beaucoup moins susceptibles d'être infectées que les moineaux dans les colonies monospécifiques. Les moineaux infectés par le BCRV étaient en outre infectés avec des titres (teneur des prélèvements en virus) plus élevés que ceux des hirondelles à front blanc (et donc a priori plus contagieux ou diffusants)[34]. Le BCRV recherché chez les insectes sur le site a été positivement associé à la prévalence du virus chez les moineaux domestiques, mais non avec la prévalence du virus chez les hirondelles « des falaises ».
Dans ce cas, l'introduction d'une espèce-hôte très sensible au virus, a conduit à pérenniser l'épizootie. Les moineaux envahissants ont sans doute un certain avantage (dilution du risque) à se mélanger avec des hirondelles qui résistent mieux qu'eux au microbe, mais peuvent augmenter la probabilité que les hirondelles soient infectées[35].
Impacts économiques
Dans le monde : rien que pour les dégâts induits par des insectes introduits et devenus envahissants, les coûts ont été évalués à au moins 70 milliards d'euros par an dans le monde[8].
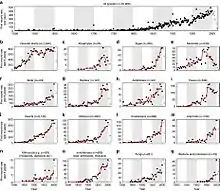
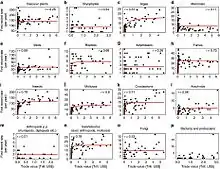
La revue Nature publie le une étude du laboratoire « Écologie, Systématique et Évolution » (université Paris-Saclay) sur le coût global, pour l'économie mondiale, des espèces exotiques envahissantes, qui a mobilisé une centaine d'experts de quarante pays. Elle évalue ce coût à 1 288 milliards $ sur cinquante ans (1970-2020) ; il augmente rapidement, doublant en six ans ; sur la seule année 2017, il a représenté près de 163 milliards $, montant du même orde de grandeur que le coût des catastrophes naturelles de 2020 estimé par l'assureur Swiss Re à 202 milliards $[36].
En Europe : chiffrer ces impacts dans leur ensemble semble impossible, mais de nombreuses études cherchent par espèce ou pour une activité humaine ou pour un territoire donné à commencer à les chiffrer. Selon les données réunies pour produire l'étude d'impact du règlement européen de 2014 sur la prévention et la gestion de l’introduction et de la propagation des espèces exotiques envahissantes[37] il y aurait vers 2010 plus de 1500 EEE repérées dans le territoire européen, et elles coûteraient plus de 12 milliards d’euros par an aux États-membres[38].

En France : selon une étude (2015)[39] du CGDD, pour la période 2009-2013, d'après les résultats d'un questionnaire d’enquête faite auprès des services de l’État, des collectivités, des établissements publics, des gestionnaires d’espaces naturels, des chercheurs et d'entreprises concernées, croisé avec une analyse bibliographique et des entretiens (faits en métropole et en outre-mer), les EEE pour lesquelles des données suffisantes sont disponibles coûteraient en moyenne 38 millions d'euros par an (dépenses occasionnées + pertes/dégâts)[38]. Au vu du coût de gestion et des dégâts, les 11 espèces les plus citées par les personnes et collectivités enquêtées (correspondant à 58 % des dépenses) étaient : le moustique-tigre (en métropole et en outre-mer), le cerf de Java et le cochon féral en Nouvelle-Calédonie, les jussies, les élodées, le ragondin et le rat musqué en métropole, le rat, le chat et la souris grise en outre-mer, et les renouées en métropole[39]. L'étude précise que « la plupart des EEE qui sont les plus coûteuses aujourd’hui ont été introduites de façon volontaire, à l’exception notable du moustique-tigre, de l’ambroisie, du frelon asiatique et de plusieurs champignons »[39] et pour plus de 600 espèces suivies en France, 11 % concentreraient près de 60 % des dépenses (avec, parmi les espèces animales, le moustique-tigre en première source de coûts, et, parmi les végétaux, la renouée du Japon)[8].
Impacts sur le fonctionnement des écosystèmes
Une espèce envahissante peut affecter le fonctionnement d’un écosystème de bien des façons et à tous les niveaux. Elle est susceptible de modifier les facteurs biotiques et abiotiques du milieu, positivement, négativement, les deux, ou n’avoir aucun effet. Ces effets étant contexte dépendants, il est difficile de généraliser et donc nécessaire de s’appuyer sur des exemples.
Impacts sur les flux
L’effet le plus retrouvé dans la littérature provient de l’impact des espèces envahissantes sur le fonctionnement des cycles du carbone et de l’azote. Ehrenfeld (2010)[40] met en évidence que dans la grande majorité des études, les espèces envahissantes sont associées à une augmentation des réserves de carbone et d’azote dans les écosystèmes (il note cependant que cela est très dépendant du contexte, et qu’il n’est pas toujours facile de faire des généralités, notamment pour l’azote), que ce soit en milieu terrestre ou marin. Il illustre ainsi ses propos à travers différents exemples.
Le premier concerne l'accroissement des concentrations en nutriments dans l’environnement, notamment par excrétions. En environnements marins particulièrement, les excrétions d’azote, sous forme liquide ou en tant que fèces, concentrent d’autant plus le milieu en ces éléments lorsqu'il s’agit d’espèces envahissantes.
Comme autre exemple, les fourmis peuvent avoir un effet similaire sur les écosystèmes. En modifiant leur milieu, elles changent la répartition des nutriments dans le sol, en les concentrant au niveau des couches inférieures. De plus, la construction de la fourmilière concentre les nutriments au sein de leur habitat, au détriment des autres organismes du sol.
En plus de modifier le sol en général, les espèces envahissantes peuvent affecter la décomposition de la litière, et donc modifier les cycles biogéochimiques, en éliminant les détritivores et décomposeurs s’y trouvant.
Ehrenfeld (2010)[40] soulève également un point important concernant la productivité d’un écosystème : dans la grande majorité des cas d’invasions, l’écosystème aura une productivité, et donc une biomasse plus importante qu’en l’absence d’envahisseur. Ainsi, les limites de la productivité d’un écosystème semblent repoussées par la présence d’espèce(s) envahissante(s).
La modification dans les flux peut générer des impacts écologiques se propageant tout le long du réseau trophique et déclenchant des cascades trophiques. La moule par exemple est une espèce qui modifie la dominance des voies énergétiques et le flux des nutriments dans les écosystèmes d’eau douce (lacs et les rivières)[41]. Cette étude montre que la moule zébrée (Dreissena polymorpha) et la moule quagga (D.rostriformis bugensis) sont responsables de l’augmentation de la quantité de phosphore soluble dans l’habitat, ce qui joue un rôle dans la productivité d’espèces benthiques autotrophiques. Est également associée une baisse de la biomasse du phytoplancton, du zooplancton et du zoobenthos profond. Au niveau du littoral benthique est observée une modification de la circulation d’énergie, ce qui a pour conséquences l’amélioration de la clarté de l’eau, la diminution de la biomasse de phytoplancton, une diminution du zoobenthos profond et une augmentation du phosphore soluble. Cela est bénéfique pour un grand nombre de groupes associés avec un habitat littoral benthique (macrophytes, zoobenthos du littoral par exemple).
Ainsi, l’introduction d’une espèce dans un écosystème avec un réseau trophique complexe peut mener à des modifications importantes de la structure et de la fonction de tout l’écosystème.
Les changements dans les flux de carbone peuvent également concerner les émissions de gaz à effet de serre, comme le montre l’étude de Gao (2017)[42]. Originaire du nord des États-Unis, Spartina alterniflora a envahi les écosystèmes de mangroves de la rivière Zhanjiang (Chine) en 1979 et modifie les flux de carbone de cet écosystème. Les émissions de méthane (CH4) y sont en effet 57 fois plus importantes comparées à des écosystèmes non envahis. Puisque le CH4 a un potentiel de réchauffement global bien supérieur à celui du dioxyde de carbone (CO2), l’effet des émissions totales de gaz à effet de serre est conséquent. De plus, cette augmentation des émissions de CH4 pourrait être la conséquence du changement des communautés microbiennes déclenché par S.alterniflora, puisqu’une augmentation de la biomasse microbienne a été observée après l’invasion de S.alterniflora.
Impacts sur les feux
En plus des flux, les feux sont des éléments importants dans les écosystèmes, et leur modification à la suite d’invasions a souvent des conséquences sur l’ensemble de l’écosystème[43] - [44] - [40].
Les plantes sont un élément extrêmement important pour les feux, puisqu’elles servent de combustibles. Des espèces envahissantes ayant des propriétés physiques et chimiques différentes d’espèces natives sont ainsi susceptibles de changer les régimes de feux (par exemple, une plante grasse possède plus d’eau dans ses tissus, et une invasion par ce type de plante aura tendance à diminuer la fréquence et l’intensité des feux).
Selon Brooks et al. (2004)[44], le régime de feu est considéré comme changé lorsque l’on observe une altération persistante dans le temps de celui-ci. Une rétroaction positive se met alors en place entre les feux et l’espèce envahissante, permettant un renforcement des deux partis, et souvent une exclusion des espèces natives. Une fois ce cap passé, il devient très difficile (et coûteux), voire parfois même impossible de restaurer les communautés précédemment existantes.
En plus du problème de la restauration des communautés, le passage d’un feu peut diminuer les quantités d’azote disponibles dans l’écosystème. Ehrenfeld (2010)[40] présente le cas de l’introduction d’Andropogon sp. en Australie, qui a eu pour conséquence un sol appauvri de 113 % en azote par rapport aux espèces endémiques. Très combustible, Andropogon sp. intensifie la fréquence de survenu des incendies, ce qui diminue drastiquement et durablement les réserves azotées. De plus, en milieu aride, il y a trop peu de pluie pour aider à restaurer le pool initial d’azote, de ce fait, 10 années seraient nécessaires pour le restaurer.
Changement physique de l’habitat
Un autre impact important dans les changements du fonctionnement des écosystèmes est le changement de la structure physique de l’habitat. Ces impacts structuraux changent également bien sûr les flux, mais la modification physique de l’habitat en elle-même peut être considérée comme un impact, selon Simberloff (2011)[43]. Plusieurs exemples sont ainsi identifiables dans la littérature.
L’invasion de la carpe commune (Cyprinus carpio) dans un grand nombre de lacs en Amérique du Nord, au XIXe siècle (Bajer et al., 2016)[45] a causé la modification de structure la physico-chimie de l’habitat. En effet, la biomasse de carpe est inversement corrélée avec la couverture végétale et la diversité des végétaux aquatiques, ce qui induit une baisse de la filtration du milieu par les plantes aquatiques et donc une augmentation des particules en suspension dans l’eau. Il est aussi observé une augmentation de la turbidité de l’eau et donc une baisse de la pénétration de la lumière, qui a en général un impact sur tous les niveaux trophiques de l’écosystème.
Un second exemple est celui du Castor Nord-Américain (Castor canadensis). Il a été introduit en 1946 dans la réserve de la biosphère du Cap Horn (CHBR) dans le sud du Chili[46]. Le castor est considéré comme une espèce envahissante ingénieure d’écosystème, son introduction a ainsi profondément altéré la structure physique des écosystèmes. Tout d’abord en augmentant la rétention de matière organique, mais aussi en changeant les communautés locales, en diminuant la diversité de macroinvertébrés benthiques (tout en augmentant leur biomasse) et en augmentant l’abondance des espèces restantes. De plus, il y a une modification des groupes fonctionnels par une augmentation de biomasse des macroinvertébrés prédateurs et chasseurs ainsi qu’une diminution des broyeurs et filtreurs. Enfin, la modification de l’habitat a augmenté la production secondaire.
Le castor modifie donc fortement l’habitat en changeant les ressources en nutriments, les liens trophiques et les ressources physiques de l’habitat.
Tous ces changements peuvent être répertoriés à échelle locale, comme le cas du castor[46] à l’échelle de sa rivière, mais peuvent être d’une plus grande ampleur et concerner des surfaces bien plus importantes.
Un problème très médiatisé ces dernières années, présenté par Veiga et al (2018)[47], est le cas de l’invasion de Sargassum muticum où S. flavifolium est endémique. Les macroalgues comme celles-ci sont considérées comme espèces ingénieures, conférant habitats et ressources à une grande diversité d’espèces en plus de réguler les flux.
Il s’est avéré que S. muticum renferme une biodiversité plus faible que S. flavifolium, notamment dû au couvert moins important et plus épars comparé à S. flavifolium. De plus, un nombre plus faible d’espèces endémiques aux Sargasses natives a été observé. En impactant la biodiversité, tout le réseau trophique, ici de haut niveau à forte production primaire, se retrouve affecté, en modifiant surtout les top-prédateurs et les espèces intermédiaires en recrutant plutôt des généralistes.
Effet de latence
Des effets dits de latence (« lag ») quant à l’impact d’une espèce envahissante sur un écosystème sont également à mentionner. Ce phénomène peut être considéré comme un décalage entre le moment de l’invasion et le moment où l’espèce envahissante affectera significativement l’écosystème[43]. Simberloff (2011)[43] donne l’exemple de l’impact de la fourmi Anoplolepis gracilipes sur les populations de crabes Gecarcoidea natalis, sur Christmas Island. La fourmi a envahi l’île, mais n’a eu d’effet sur les crabes que lors d’une seconde invasion, celles des hémiptères Coccus celatus et Tachardina aurantiaca (l’origine de ces derniers n’est pas confirmée). La conséquence a été la décimation des populations de crabes, ainsi qu’un changement dans la litière du sol, puisque des plantes auparavant contrôlées par les populations de Gecarcoidea natalis ont pu se développer, permettant également l’expansion de l’escargot Africain géant, Lissachatina fulica.
Impacts positifs
Il est important de préciser que seuls les effets négatifs imposés au fonctionnement d’un écosystème ont été présentés jusqu’à présent. Or, S.muticulum, par exemple, peut également avoir un impact positif (Veiga et al., 2018). En effet, S.muticulum montre une augmentation de sa biomasse en saison chaude. Ainsi, avec une surface plus importante, elle domine l’écosystème et peut conférer un renforcement positif des liens trophiques ainsi amplifiés par rapport aux sargasses endémiques.

Autre exemple, les Leucaena leucocephala (envahissants notamment en Nouvelle-Calédonie) permettent de fixer dans le sol jusqu'à 500 kilos d'azote par an et par hectare, ce qui contribue à enrichir les sols[48].
De ce fait, les espèces envahissantes peuvent également intensifier un processus écosystémique ou devenir un élément de vie essentiel aux espèces locales.
Néanmoins, ces effets positifs ne sont pas toujours apparents, masqués par d’autres caractéristiques propres à l’espèce. Ils sont bien souvent mis à jour par le changement de l’écosystème après l’éradication de l’espèce envahissante considérée. Cela fut le cas pour le Tamarix sp., espèce envahissante des USA implantée pour l’ornementation et l’ombre qu’elle procure en zone aride. Cette étude de Bonanno (2016)[49] évoque ce cas et explique que des campagnes d’éradication ont été lancées, pensant que cet arbuste épuisait les stocks en eau du sol. Cependant, il n’en consomme pas plus que les espèces locales. De plus, grâce à sa résistance plus importante aux sécheresses et au sel, il confère un habitat durable pour la biodiversité locale et permet de préserver le réseau trophique. Particulièrement, Empidonax traillii extimus, espèce indigène et en danger, utilise cet arbuste pour nicher. Ainsi, Tamarix, malgré son caractère non natif, a permis de remplir le rôle d’autres espèces, rôle optimisé par sa grande résistance aux contraintes abiotiques du milieu.
Les diverses études sur l’impact des espèces envahissantes sur le fonctionnement des écosystèmes, dont celle d’Ehrenfeld (2010)[40], s’entendent à dire qu’il n’y a pas de modèle général d’altération de l’écosystème. En effet, il a été montré différents mécanismes et conséquences associées. Cela dépend bien entendu du règne visé ainsi que de l’écosystème considéré. Chaque environnement est indépendant et réagira d’une façon différente.
Par exemple, des différences sont observées entre les plantes et les animaux. Les plantes affectent le fonctionnement d’un écosystème par la modification de l’allocation des ressources. Les animaux, quant à eux, influencent notamment le milieu envahi par voies trophiques, ces impacts pouvant aussi dépendre d’un comportement. Par la consommation de proies, le prédateur envahissant enclenche une cascade trophique et a un impact direct sur les mécanismes de flux de nutriments. Un plus grand nombre de voies de transformation est utilisé par les animaux envahissants par rapport aux plantes.
Nous ne savons aujourd’hui pas prédire l’évolution de l’impact d’une invasion. En effet, si la majorité des scientifiques s’accordent à dire que celui-ci décline avec le temps, cela n’est basé que sur des preuves abstraites et peu fondées. Il est également envisageable que l’impact s’intensifie continuellement avec le temps, ou bien qu’il se renforce sous certaines conditions[50].
Il est nécessaire de rappeler que les impacts d’espèces envahissantes sont très contexte dépendants, comme le souligne Bonanno (2010)[49] : « a change in host communities does not imply necessarily harm […] the functional roles of a species matter more than its origin ». C’est pour cela, qu’aujourd’hui il existe très peu de cadre théorique afin de lutter efficacement contre les espèces envahissantes et leurs impacts sur les écosystèmes. Un des axes de recherches sur ce sujet est de rassembler un maximum d’informations sur ces espèces envahissante (biologique, fonctionnels, évolutives) et l’ensemble de leurs impacts sur les écosystèmes. Le but étant de réaliser un cadre théorique pour lutter contre les espèces envahissantes avant qu’elles ne modifient complètement l’écosystème.
Nous tenons enfin à mentionner que de nombreux biais sont présents parmi les études concernant les espèces envahissantes. Notamment, il y a aujourd’hui une tendance à ne publier que les études montrant le très fort impact d’une invasion sur un écosystème, en oubliant de les nuancer par d’autres études montrant peu ou pas d’impacts. Beaucoup d’études sont également basées sur des cas particuliers, et il y a un manque de travaux basés à grandes échelles et trop peu de cas on en fait été étudiés[43] - [50] - [40].
Modes et sources de propagation
Jardins botaniques et espèces envahissantes
Selon une analyse des données disponibles relatives à 34 des 100 espèces réputées les plus envahissantes du monde (selon l'UICN /Union internationale pour la conservation de la Nature), sur la base de cas documentés pour la période allant de 1800 au milieu des années 1900, les jardins botaniques seraient en partie responsables de la propagation de plus de 50 % des espèces envahissantes. Pour 19 des 34 plantes étudiées, les points de départ des invasions ont très probablement été des jardins botaniques[51].
En 2001, une sorte de code de bonnes pratiques visant à limiter le risque d’évasions accidentelles, dit Déclaration de Saint-Louis est créé. Le Chicago Botanic Garden (CBG) remplace les espèces envahissantes par d’autres et a cessé ses échanges de graines avec d’autres jardins botaniques, mais la Déclaration de Saint-Louis n’était signée, en 2010, que par 10 des 461 jardins botaniques des États-Unis[52].
Introductions d'espèces

- le lapin en Australie, et sur plusieurs îles : 24 lapins furent introduits en Australie en 1874 et se reproduisirent très rapidement[53]. Afin d'arrêter les dégâts provoqués par ces millions d'animaux, les Australiens relâchèrent des renards, jusqu'ici absents de l'île-continent, qui s'attaquèrent aux marsupiaux[53].
- Caulerpa taxifolia en Méditerranée,
- la perche du Nil dans le lac Victoria,
- la grenouille taureau dans le Sud-Ouest de la France,
- l'écrevisse de Louisiane en Europe,
- la truite fario (européenne) en Amérique du Nord,
- l'écureuil gris qui provoque une forte régression de l'écureuil roux au Royaume-Uni et en Italie,
- le cerisier tardif (Prunus serotina Ehrh) devenu envahissant en France par exemple en forêt de Compiègne,
- la petite fourmi de feu ou fourmi électrique (Wasmannia auropunctata), espèce super-envahissante en Polynésie ou en Australie.
- plusieurs espèces de Prosopis sont devenues envahissantes dans plusieurs endroits du monde, dont Prosopis chilensis dans la Corne de l'Afrique où il a été importé du Chili pour freiner l'avancée du désert[54]. Prosopis glandulosa est considérée par l'UICN comme une des cent espèces les plus envahissantes.
- la palourde asiatique qui envahit certains fleuves français, aux dépens de bivalves d'eau douce indigènes dont certaines moules d'eau douce,
- la jussie à grandes fleurs et la jussie rampante, des plantes aquatiques appartenant au genre Ludwigia commercialisées comme plantes d'ornement de bassin, colonisent de nombreux cours d'eau et étangs, aboutissant à leur fermeture progressive et leur assèchement et, constituent une grave menace pour les milieux aquatiques de France et d'Europe,
- La Moule zébrée dans le fleuve Saint-Laurent et dans une grande partie de l'Europe,
- Sinanodonta woodiana, une moule d'eau douce géante venue de Chine, souvent sous forme de larves (glochidie)) attachées à des poissons (carpes, poissons rouges...) utilisés en pisciculture ou réutilisés pour le rempoissonnement,
- Les Plathelminthes terrestres envahissants en France, prédateurs de vers de terre, signalés seulement en 2013, mais déjà présents dans plusieurs départements[55] - [56] - [57] - [58] - [59] - [60] - [61] - [62] - [63] - [64].
Facteurs expliquant ou favorisant l'envahissement
Allélopathie
Beaucoup de plantes émettent autour d'elles dans l'air et/ou dans les sols des hormones ou molécules phytotoxiques pour d'autres espèces (phénomène dit d'allélopathie). Là où elles ont coévolué avec les espèces de leur guilde écologique, cet effet est peu visible, mais hors de leur aire naturelle de répartition, elles peuvent devenir toxiques pour les autres plantes, ou fortement le inhiber.
On a notamment montré chez des invasives comme l'absinthe (hors de son aire naturelle) que l'ajout de charbon de bois activé au sol, inhibe ou supprime l'allélopathie racinaire[65].
Effet Janzen-Connell inversé
Une espèce introduite peut devenir envahissante par l'effet Janzen-Connell inversé alors qu'elle était freinée par l'effet Janzen-Connell dans son environnement d'origine[66].
Travail des sols agricoles ou forestiers
Le travail mécanique et le désherbage chimique ont connu un succès croissant après la Seconde Guerre mondiale. Or, ces techniques favorisent fortement l'installation d'espèces envahissantes. Par ailleurs, les engins colportent souvent les propagules, contribuant à l'expansion géographique des zones colonisées.
De nombreuses études ont montré que le labour, le scarifiage du sol par sillons (sous-solage), le déchaumage et le brûlage dirigé, ou brûlage en andains modifient ou suppriment la concurrence des espèces autochtones, ce qui favorise l'installation d'espèces pionnières exotiques ou d'espèces localement devenues résistantes à ces traitements. Par exemple, une étude canadienne (avec des sites témoins) a montré sur 10 ans, les effets de la préparation mécanique de terrains forestiers sur la diversité spécifique et structurale du sous-bois. Dans tous les cas, la réponse de la communauté végétale se montre très influencée par l'intensité du traitement de préparation du terrain. Ainsi, sur un site boréal dominé par les saules (Salix L. spp.), l'aulne vert crispé (Alnus crispa (Ait.) Pursh ssp. crispa) et le peuplier faux-tremble (Populus tremuloides Michx.), un travail léger du sol a peu d'effet sur la diversité spécifique mais les traitements plus intenses « ont augmenté de 10 à 16 fois l'abondance des espèces exotiques (et seulement légèrement la croissance de l'épinette blanche (Picea glauca (Moench) Voss) » plantée. Sur un autre site (subboréal et oligotrophe), la diversité spécifique a diminué d'autant plus que le sol avait été travaillé[67]. Le brûlage a des effets en partie comparables[68].
Mondialisation des transports
Les espèces envahissantes introduites avec les eaux de ballast ou sous les coques de navires sont de plus en plus nombreuses. Les trains, camions et voitures en transportent aussi. Et une étude[69] de 2007 de l’université d’Oxford a montré que dans des régions au climat comparable, plus on s'approche d'une zone desservie par des lignes aériennes, plus on augmente le risque d’invasion par des espèces étrangères animales, avec une « fenêtre d’invasion » en juin-août, a priori du fait du nombre de vols et de passagers qui augmente et de conditions climatiques favorables. 800 lignes aériennes ont été étudiées du au (soit 3 millions de vols environ).
Évolution rapide
La plupart des espèces envahissantes sont caractérisées par une évolution rapide, principalement dirigée par l’une des quatre forces évolutives, la sélection naturelle. Cette évolution rapide promeut l’adaptation des espèces aux différents environnements. De nombreuses espèces envahissantes subissent une évolution rapide des traits d’histoire de vie impliqués dans l’invasion[70] - [71]. Ces traits impliquent généralement un fort taux de survie et de croissance, une tolérance aux changements environnementaux et une capacité à se développer dans des conditions environnementales variées, un temps de génération court, un fort investissement dans la reproduction, des œufs ou graines de petites tailles, une grande capacité de dispersion et une forte compétitivité[71]. Les traits d'histoire de vie impliqués dans l'invasion semblent être mieux transmis à la descendance chez les populations envahissantes que chez les populations natives (meilleure héritabilité). Cela a notamment été mis en évidence chez Phalaris canariensis[72].
Ces traits ont été observés chez les plantes et les animaux. Par exemple, les herbes vivaces itéropares allouent plus de ressources à la reproduction qu’à la croissance végétative[73]. De même, plusieurs plantes introduites sur des petites îles au Canada dispersant par le vent, produisent de plus petits pappus et des akènes plus lourds. Cela favorise le dépôt des graines sur l’île plutôt que dans l’eau[71]. On peut également citer le cas du crapaud buffle introduit en Australie en 1935. Il a notamment développé de plus longues pattes arrières ce qui lui a permis de coloniser rapidement une large partie du territoire[70] - [71].
Le processus d’invasion passe par différents stades : la colonisation, l’établissement et la dispersion. Les traits d’envahissement s’expriment de manière plus ou moins forte, et la direction de sélection d’un trait peut changer au cours du processus d'invasion[71]. Les adaptations évolutives des populations introduites, qui apparaissent en réponse aux variations de pressions de sélection, sont en grande partie permises par la plasticité phénotypique. Par exemple, un panais sauvage introduit en Amérique du Nord en 1609 a cessé de produire du furanocoumarine (substance chimique de résistance aux herbivores), car les herbivores qui le consommaient n’étaient pas présents dans ce nouvel environnement. La plante a ainsi pu allouer plus d’énergie dans la reproduction et la dispersion. Mais en 1890, un herbivore a été introduit et il a été montré que la production de furanocoumarine était supérieure chez l’espèce envahissante que chez les espèces natives. Le panais sauvage peut donc exprimer plus ou moins un trait en fonction des conditions environnementales (ici défenses contre les herbivores)[71].
Le phénomène de plasticité a lieu quand il y a suffisamment de variabilité génétique dans les populations introduites[74]. La sélection des individus capables de plasticité va également permettre aux espèces envahissantes de mieux répondre aux changements globaux que les espèces natives. Les plantes, par exemple, présentent une grande plasticité phénotypique lors des premiers stades de l’invasion ce qui leur permet de s’étendre rapidement[75].
Pressions de sélection
L’évolution chez les espèces envahissantes est en grande partie due aux changements des pressions de sélection qu’elles subissent. Par sélection naturelle, les traits favorisés ne seront pas nécessairement les mêmes que ceux sélectionnés dans leur habitat d’origine, pouvant conduire à des changements évolutifs rapides.
Les pressions de sélection s'exerçant sur les espèces envahissantes sont de différente nature et n’ont pas les mêmes effets. Premièrement, le stress environnemental dû à l’arrivée dans un nouvel environnement peut favoriser l’apparition de modifications du génome et du transcriptome chez les espèces introduites. Ces modifications peuvent être sélectionnées et se fixer dans la population. Cependant, il semblerait que ce processus ne soit pas le plus important dans l’évolution rapide des espèces envahissantes[76].
Les pressions de sélection peuvent être abiotiques. Par exemple, Hypericum perforatum, introduite en Amérique du Nord dans les années 1860, a vu sa morphologie évoluer et ses traits d’histoire de vie s’adapter aux différentes latitudes du continent. Lorsque l'on place des plantes adaptées au Nord dans la région Sud, les plantes installées dans le Sud résistent mieux en comparaison. On observe l’effet réciproque en déplaçant des plantes du Sud dans la région Nord. Les populations de cette espèce sont donc adaptées aux conditions abiotiques que confère la latitude[71].
Des pressions biotiques s’appliquent également sur les espèces envahissantes. Elles sont particulièrement importantes puisque les individus introduits doivent faire face à des espèces compétitrices ou antagonistes avec lesquelles elles n’ont pas coévolué. Dans de nombreux cas, les pressions de sélection biotiques sont plus fortes que les pressions abiotiques. En effet, les espèces, en particulier végétales, sont introduites dans un environnement avec des conditions climatiques et édaphiques relativement similaires à ceux de leur aire d’origine[74]. Les modifications de pression sont bénéfiques aux espèces envahissantes s’il s’agit de la perte de compétiteurs, pathogènes et/ou prédateurs, lesquels imposent des pressions spécifiques.
Dans le cas des plantes, une pression d’herbivorie peut mener à l’évolution de stratégies de défense. La réduction de cette pression dans les populations introduites devrait donc conduire à la sélection des individus qui investissent peu dans les stratégies de défense, ou des individus capables de modifier l’allocation de leurs ressources pour favoriser des traits d’invasibilité par rapport au développement d’une résistance[74]. C’est le cas de Silene latifolia qui, à la suite de son introduction en Europe il y a 200 ans, a perdu des herbivores présents en Amérique du Nord. Cela lui a permis d’allouer moins de ressources à ses défenses et plus à la reproduction[71].
Une variation des relations peut également mener à un changement rapide du cycle biologique des espèces, qui est soumis à une forte pression sélective. La présence d’herbivores conduit parfois les plantes à privilégier la reproduction précoce et la monocarpie pour assurer une descendance. En l’absence de consommateurs, on constate que les populations introduites semblent s’orienter vers la polycarpie qui peut alors devenir un avantage sélectif[74]. Ces changements se répercutent sur les interactions écologiques, donc sur la dynamique des populations[75].
La pression liée aux pathogènes est aussi souvent moins forte dans les populations introduites. Les ressources attribuées à la résistance aux pathogènes peuvent à ce moment être allouées à la colonisation (reproduction, dispersion) et permettent à la population de devenir envahissante. Les pathogènes des plantes sont souvent moins divers chez les populations introduites[74].
Il existe également une sélection spatiale à l’échelle populationnelle. Dans une population envahissante, les phénotypes diffèrent entre le front d’invasion et les zones déjà colonisées. En effet, sur le front d’invasion les individus sont soumis à moins de compétition intra-spécifique et suivent une évolution progressive vers une dispersion croissante. Les phénotypes sélectionnés sont alors ceux qui permettent une meilleure croissance démographique pour des faibles densités et qui dispersent le mieux. La reproduction de ces individus entre eux entraîne une évolution rapide, qui permet aux espèces envahissantes de coloniser de plus en plus efficacement leurs nouveaux environnements[70]. Ce mécanisme a permis aux crapauds buffles de doubler leur distance de dispersion pendant leur progression dans le Nord de l’Australie[70].
Importance de la variabilité génétique
L’invasion biologique est généralement précédée d’un effet fondateur ou d’un goulot d’étranglement génétique, provoquant une forte réduction de la diversité génétique. Lorsque cela arrive, les petites populations sont sujettes à une forte dérive génétique et à des niveaux de consanguinité accrus[75]. Ces deux phénomènes devraient, a priori, affaiblir la population et augmenter son risque d’extinction. Cependant, on observe que les espèces envahissantes sont capables de se répandre après leur introduction. C’est le cas par exemple de la plante Hypericum canariense (en) qui, après avoir perdu 45 % de son hétérozygotie lors de son introduction en Amérique du Nord, a réussi à proliférer dans cette région[71] - [77]. Cela s’explique par le fait que la perte de variabilité génétique causée par l’isolement d’une population est compensée par plusieurs facteurs.
Pour commencer, la variabilité génétique issue de l’épistasie et la variabilité additive permettent l’émergence de nouveaux génotypes, et donc de nouveaux traits phénotypiques. La variabilité génétique additive résulte de la somme des effets relatifs des allèles sur un trait. Dans les populations d’origine, on mesure des hauts niveaux de cette variabilité pour les traits liés à l’invasion[78]. Il semblerait qu’il y ait une accumulation de niveaux de variabilité additive pendant le temps de latence[78]. Cette phase correspondrait donc au temps nécessaire à l’adaptation évolutive[74] et refléterait le degré de différence entre l’ancien et le nouvel environnement[71].
La variabilité génétique peut également être assurée par l’hybridation ou par des réarrangements génomiques lors de la reproduction. Ce phénomène sera d’autant plus important s’il y a plusieurs événements d’introduction.
Une hypothèse donnée pour expliquer la rapidité de l’évolution après un effet fondateur, ou un goulot d’étranglement, est que les allèles favorables à l’invasion sont déjà présents dans le génome des individus introduits. Ils sont donc immédiatement disponibles lors du changement d’environnement. Cette explication est soutenue par le fait que ces allèles sont présents dans des proportions plus importantes que des allèles neutres ou délétères[76].
Par ailleurs, il existe des exemples pour lesquels la perte de variabilité génétique est favorable à la prolifération. L’un d'eux est la fourmi Linepithema humile chez qui une diminution de la diversité génétique a réduit la compétition inter-colonies et a donc mené à la formation de super-colonies[78] - [79].
Introductions multiples
Les introductions multiples apparaissent comme étant un phénomène répandu chez la plupart des espèces envahissantes. Un nombre élevé d’introductions signifie que les individus introduits proviennent potentiellement de populations sources différentes. Cela conduit à la présence d’une proportion plus importante du pool génétique d’origine dans le nouveau milieu, et donc à une diversité génétique plus grande que dans le cas d’une introduction unique[80]. C’est un facteur essentiel qui contribue à la pérennité des populations introduites qui peuvent, à terme, devenir envahissantes.
Les phénomènes d’introductions répétées permettent de réduire les conséquences néfastes à l’établissement d’une population que sont les effets fondateurs ou les goulots d’étranglement. L’apport de nouveaux allèles par ces phénomènes favorise les recombinaisons alléliques et permet l’apparition de nouveaux génotypes et donc de nouveaux phénotypes. Les populations introduites ont alors de meilleurs potentiels évolutifs et sont donc susceptibles d’évoluer plus rapidement que les populations natives.
Un exemple est la plante Phalaris arundinacea, dont les populations nord-américaines, issues d’introductions successives et répétées, sont envahissantes[72]. Elles possèdent une diversité génétique plus importante que les populations européennes d’origine. 98,5 % de leurs génotypes sont absents dans la population d’origine. Les nouvelles combinaisons alléliques résultent du remaniement des génotypes des populations introduites lors d’événements différents. Ces nouveaux génotypes ont induit l’expression de phénotypes à fortes capacités envahissantes (tallage, production foliaire et de biomasse, reproduction asexuée). Ils augmentent les potentialités de croissance et de reproduction et induisent donc une augmentation directe de la valeur sélective. Ces phénotypes sont associés à une plus grande héritabilité et donc une meilleure réponse à la sélection naturelle. Les populations introduites possèdent également une plus forte plasticité phénotypique[72].
Les introductions multiples favorisent donc une plus grande diversité génétique au sein des populations non natives. Les effets de la sélection seront donc plus importants. Cela explique l’apparition rapide de génotypes exprimant de fortes capacités de colonisation et une plasticité phénotypique importante.
De nombreuses études dans la littérature montrent que les phénomènes d’introductions multiples sont communs chez les espèces envahissantes. C’est donc un point qu’il est important de prendre en compte dans les politiques de gestion des espèces envahissantes. En effet, l’introduction de nouveaux individus dans un environnement, même si l’espèce y est déjà présente, peut contribuer à un phénomène d’invasion[80].
Effets de l'hybridation
Les hybridations sont un facteur important dans l’évolution rapide des espèces envahissantes. C’est le phénomène évolutif le plus cité dans les modèles ISPS (Invasive Species Predictives Schemes)[71]. L’hybridation peut se produire entre une espèce native et une espèce non native ou entre deux espèces non natives d’un même lieu[73] - [72] - [76]. Elle favorise une augmentation de la variabilité génétique. Ces croisements ont généralement lieu chez des végétaux. Par exemple, environ 7 % des espèces végétales envahissantes dans les îles britanniques ont subi des événements d’hybridation[71]. Ils ne mènent pas forcément à de l’évolution rapide ou à une augmentation de la valeur sélective pour l’espèce envahissante. Pour cela, l’hybride doit pouvoir engendrer une descendance viable[75].
L’hybridation permet l’apparition rapide de nouveaux génotypes au sein de la population envahissante[75]. Il y a donc une plus grande probabilité qu’apparaissent des génotypes favorables à de nouvelles conditions environnementales, permettant une adaptation de l’espèce au milieu dans lequel elle a été introduite. Cela favorise également la perte d’allèles délétères[75] - [78]. La structure du paysage peut également influencer la fréquence des hybridations[73] - [75]. Dans le cas où elle favorise l’invasion, l’hybridation peut mener à l’hétérosis[76]. L'hybridation peut se faire par introgression permettant l’apparition de nouveaux traits potentiellement favorables les invasions[71] - [73] - [76].
Un exemple d’hybridation est l’hybride issu des espèces Spartina alterniflora (espèce envahissante) et Spartina foliosa (en) (espèce native) dans la baie de San Francisco. L’hybride a un rythme important d’expansion. Il possède des traits transgressifs supérieurs à celui des traits parentaux notamment la production de pollen, la viabilité des graines ou la tolérance environnementale. Les hybrides sont fertiles, ils peuvent se reproduire entre eux ou avec les deux espèces parentes. Il s’agit d’un phénomène de rétrocroisement. Cette tendance menace l’espèce native Spartina foliosa (en)[75].
La stabilité de l’hybride est due à divers mécanismes comme la polyploïdie, la translocation ainsi que des mécanismes de multiplication asexuée : agamospermie et croissance clonale[73]. On retrouve notamment dans les populations envahissantes, des niveaux de ploïdie plus importants par rapport aux espèces non-envahissantes[76].
Surveillance
Des observatoires de la biodiversité ou des organismes comme les conservatoires botaniques[81], agences de l'eau[82], muséums, ONG et naturalistes surveillent de plus en plus l'apparition et la diffusion des espèces envahissantes et informent les publics.
Dans les milieux aquatiques, on recherche l'ADN environnemental dans des prélèvements d'eau ou de sédiments. Des chercheurs utilisent cette méthode pour détecter la présence de poissons (Carpe argentée), de mollusques (moules, Hydrobie des antipodes), de batraciens (Grenouille taureau), ainsi que diverses espèces d'herbes (Elodea spp.)[83].
Les sciences participatives et citoyennes sont également mobilisées, grâce notamment au smartphone qui permet de contribuer aux inventaires, par exemple dans le cadre du projet Interreg[84] RINSE[85] via une application smartphone (« Th@s Invasive » ; gratuite, disponible en français ou en anglais, et facilement téléchargeable[86]) permettant à chacun de recenser et cartographier un grand nombre d'espèces exotiques envahissantes, en photographiant l'espèce en question (qui sera géo-référencée par le GPS du smartphone et envoyé par le logiciel une fois confirmation faite par l'écocitoyen participant à cet inventaire général et permanent qui vise à limiter les impacts négatifs des espèces dites « envahissantes ». Mieux suivre l'extension géographique de ces espèces permettra d'accélérer voire d'anticiper les réponses, qui seront alors moins coûteuses, et ainsi limiter certains des effets négatifs de ces phénomènes de pullulation. Ceci est possible grâce à un travail préalable d'aide à l'identification interactive par clé d'identification visuelle de plantes non-indigènes. Il a notamment été fait dans l’écozone qui inclut l'Allemagne, les Pays-Bas, la Belgique et le grand Nord-Ouest de la France[87], et il pourra servir à d'autres régions et pays, où ces espèces seraient réglementées, ou là où elles peuvent être recherchées par les douanes comme « contaminants d'exportations commerciales » (exemple : « contamination par des graines dans de la nourriture pour oiseaux, mauvaises herbes dans des bonsaïs »[87]... Hormis pour les algues et mousses, ces clés interactives sont liées aux informations sur les espèces de la « Q-bank Invasive Plants database » (fiches descriptives et informatives, cartes d'aire de répartition mondiale, barcode moléculaire quand il est disponible, etc., et ces informations sont disponibles depuis 2013 à l'adresse http://www.q-bank.eu/Plants/[87].
La dendrochronologie est depuis peu appliquée à certaines herbacées (vivaces)[88]. Elle peut aider à rétrospectivement mieux comprendre la dynamique d'une population d'espèce envahissante et d'affiner des scénarios de progression future[88].
Exemples de taxons envahissants


- Homo sapiens peut être considéré comme une espèce envahissante du fait d'une démographie incontrôlée, d'impacts significatifs et néfastes sur l'environnement global (flore, faune, climats…) ;
- Wasmannia auropunctata, la petite fourmi folle qui a envahi la Nouvelle-Calédonie et Tahiti ;
- Le champignon Phytophthora infestans sur la culture de pomme de terre en Irlande provoquant la Grande Famine en 1845 ;
- Le phylloxéra Viteus vitifoliae sur les vignes européennes à la fin du XIXe siècle ;
- La méduse Mnemiopsis leidyi en mer Noire ayant considérablement affaibli les ressources halieutiques ;
- La moule zébrée et la moule quagga[83] qui peuvent boucher des canalisations, gêner la navigation et diminuer la biodiversité ;
- L'étoile de mer dévoreuse de corail (Acanthaster planci) est sujette à des « explosions de populations » qui ruinent les écosystèmes coralliens, parmi les plus riches et les plus fragiles au monde ;
- La guêpe commune Vespula vulgaris en Australie, en Nouvelle-Zélande et à Hawaï ;
- Le frelon asiatique Vespa velutina en France notamment, prédateur d'abeilles et d'autres insectes pollinisateurs ;
- L'introduction du Rat noir Rattus rattus et du Rat gris Rattus norvegicus en Europe au Moyen Âge ;
- La jacinthe d'eau, diminuant la vie aquatique, faute de lumière, dans les rivières ou les lacs.
Dans un contexte où les déplacements humains sont toujours plus nombreux, l'impact climatique des activités humaines toujours plus fort et la tentation de recours aux organismes génétiquement modifiés toujours plus grande, le risque d'une augmentation des phénomènes d'espèces envahissantes avec ses conséquences sur la biodiversité est bien réel. Il a d'ailleurs commencé à être pris en compte au cours de la conférence de Rio en 1992. Elles sont aujourd’hui la deuxième cause de régression de la biodiversité.
En zones tropicales
Dans les zones tropicales, les îles sont particulièrement touchées et vulnérables. En , une « initiative sur les espèces exotiques envahissantes dans les collectivités françaises d’outre-mer » a été lancée par le Comité français de l’UICN et le MEDAD qui doit produire un rapport et état des lieux complet sur la menace des invasions biologiques en France d'outre-mer, avec un réseau de plus de 100 experts et l’appui de 10 coordinateurs locaux.
Dans les forêts tropicales, les coupes rases favorisent la diffusion d'espèces envahissantes telles que Lantana camara dans certaines parties de l'Afrique, d'autant plus que la trouée dans la canopée est vaste ou mise en connexion avec d'autres[89].
Aux États-Unis
Sur les quelque 50 000 espèces (plantes et animaux) qui ont été introduites aux États-Unis au cours des deux cents dernières années, 1 sur 7 environ est considérée comme envahissante[90].
En Europe
Depuis un peu plus d'un siècle, de nombreuses espèces manifestent des comportements envahissants en Europe, dont beaucoup d'espèces aquatiques[91]. Ces espèces ont pourtant un coût élevé : les dégâts induits par ces espèces s'élèveraient à 12 milliards d'€/an pour l'Europe[92]. En Italie, de 1995 à 2000, la dégradation des berges par le rat musqué et les dégâts agricoles collatéraux étaient estimés à environ 11 M€ (millions d'euros) en dépit d'un plan de lutte de 3 M€) ; la Grande-Bretagne a dû dépenser environ 150 M€/an, rien que pour la lutte contre 30 plantes exotiques envahissantes, alors qu'elle perdait 3,8 G€/an (milliards d'euros par an) en récoltes perdues.
Début 2004, le Conseil de l'Europe publie une « Stratégie européenne relative aux espèces exotiques envahissantes »[93] (dans le cadre de la Convention de Berne).
En 2007, un règlement du Conseil de l'Europe traite des espèces envahissantes dans l'aquaculture[94].
En 2008, le projet européen DAISIE (Delivering Alien Invasive Species Inventories for Europe)[95] a évalué pour 15 pays européens, de 2005 à 2008, l’importance des espèces exotiques établies en Europe (animaux, végétaux, champignons), avec, pour la première fois, une attention particulière portée aux invertébrés terrestres et aux champignons (travail coordonné par l'INRA). Les chercheurs ont été surpris d’identifier 1 517 espèces exotiques (insectes surtout, mais aussi acariens, vers, mollusques terrestres) déjà établies en Europe. Cet inventaire n’est pas exhaustif, ces espèces étant souvent d'abord discrètes et plus difficiles à détecter que les animaux et plantes supérieures.
Selon l'INRA, en moyenne 19 espèces d’invertébrés exotiques supplémentaires se sont introduites et ont développé des populations viables à envahissantes en Europe chaque année pour la période 2000-2007. C’est presque le double du taux moyen mesuré (10/an) en 1950 et 1975. Fin 2008, selon le Daisie ; sur environ 10 000 espèces exotiques recensées en Europe, 11 % auraient un impact écologique et 13 % un impact économique. L’Asie est devenue le premier continent d’origine, avant l’Amérique du Nord. Moins de 10 % de ces organismes auraient été délibérément introduits (par exemple comme agents de lutte biologique ou NAC). La majorité serait arrivée avec des marchandises ou passagers involontairement « contaminés ».
Le commerce des plantes ornementales exotiques (sous toutes leurs formes) serait selon l’INRA une voie privilégiée d’invasion biologique. L’étude montre que les milieux riches en biodiversité et à haut taux de naturalité semblent plus épargnés par les invasions, alors que les milieux très anthropisés sont ceux qui accueillent la majorité des espèces exotiques (champs, parcs et jardins, habitations). Le réchauffement climatique semble avoir favorisé l’implantation croissante au moins dans l’Europe du Sud d’espèces d’origine subtropicale ou tropicale.
Selon le projet DAISIE[96], la majorité de ces espèces étudiées (1341 espèces, soit 86 % du total) ont été introduites involontairement par les importations de marchandises et la circulation des véhicules ou des hommes. 218 espèces (soit 14 % au moment de l'étude) ont cependant été introduites tout à fait intentionnellement, dans la quasi-totalité des cas à des fins de lutte biologique et essentiellement pour l'horticulture et les cultures ornementales (468 espèces, soit 29 %), les évadées plus ou moins non intentionnelles (par exemple issues des serres (204 espèces, soit 13 %) suivent, devant les ravageurs des produits stockés (201 espèces, soit 12 %) et les « passagers clandestins » (95 espèces, soit 6 %), la forêt et les ravageurs des cultures (90 et 70 espèces, respectivement 6 % et 4 %). Pour 431 espèces (soit 27 %), la voie d'introduction en Europe reste inconnue. La voie « sans aide », c'est-à-dire de dispersion spontanée d'une espèce exotique dans une nouvelle région, ou à partir d'une zone d'origine ou d'une zone où elle a été récemment introduite est probable pour certains arthropodes en Europe continentale, bien que n'étant pas précisément documentée dans les données. Les aspects spatio-temporels sont en cours d'étude, de même que les vecteurs et implications pour la gestion des espèces exotiques. L'identification et l'alerte, ainsi que les moyens de fermer les « voies d'invasion » sont des éléments importants de toute stratégie visant à réduire la pression des propagules des arthropodes souvent de petite taille et involontairement transférées. Cela exige une coordination et des responsabilités claires pour tous les secteurs impliqués dans l'élaboration de politiques et de toutes les parties prenantes associées.
Une base de données Daisie-europe-aliens[97] est librement consultable par le public.
Sur la base de 560 espèces exotiques recensées dans le bassin méditerranéen, l'UICN a établi une « Liste noire des espèces envahissantes dans le milieu marin » de Méditerranée, comprenant 15 poissons, 4 crustacés, 11 mollusques, 10 végétaux et de nombreux autres invertébrés[98].
Espèces envahissantes et « effet Allee »
Les espèces envahissantes peuvent réguler leur croissance et s’étendre dans leur nouvel habitat en causant des perturbations dans leur communauté biologique locale. Tous les taxons peuvent selon le contexte devenir une espèce envahissante[A 1].
L’effet Allee est défini en écologie comme une relation positive entre tout composant de la fitness individuelle et l’effectif (ou la densité) de conspécifiques[A 2].
Approche théorique
La plupart des envahissantes ont été introduites en faible effectif et en des lieux divers. Il a été démontré que les espèces sujettes à l'effet Allee ne pourront jamais s’établir à moins d’être introduites avec un effectif initial suffisamment grand (au moins supérieur au seuil de l’effet Allee). Quand elles sont introduites en nombre légèrement inférieur au seuil d’Allee, elles devraient pouvoir s’établir grâce à des effets de stochasticité démographique. Mais pour les modèles déterministes, la population devrait s’éteindre lorsque les effectifs se situent sous ce seuil[A 1].
Plusieurs phénomènes propres aux invasions biologiques peuvent être dus à l’effet Allee : Par exemple, le range pinning, soit la vitesse d’invasion nulle, s’explique par la seule existence d’un effet Allee dans le cadre d’un espace discret (espace divisé en patchs), sans aucun gradient environnemental (conditions homogènes du milieu) et pour des patchs équivalents dans leurs propriétés biotiques et abiotiques[A 3]. Ce mécanisme s’exprime comme une fonction du taux de dispersion et du rapport entre seuil d’Allee et la capacité de charge des patchs. En espace continu homogène, une vitesse d'invasion nulle ne peut exister que s'il existe un rapport exact d'1/2 entre la capacité de charge du milieu et le seuil d'Allee de la population[A 3]. Par ailleurs, plus l’effet Allee est sévère, plus la vitesse de la vague de dispersion sera lente[A 4].
Quelques exemples

L’effet Allee a été détecté chez certaines plantes envahissantes, par exemple chez la vigne adventice Vincetoxicum rossicum (Asclépiadacée)[A 5] ou la spartine à feuilles alternes (Spartina alterniflora)[A 6], pour des insectes envahissants comme le bombyx disparate Lymantria dispar[A 7], ou encore des espèces envahissantes aquatiques comme la moule zébrée Dreissena polymorpha[A 8].
Les preuves empiriques de l’effet Allee chez les espèces envahissantes restent assez rares mais les exemples s’accroissent[A 9].
Gestion
Le temps entre l’introduction et l'établissement d'une espèce envahissante (lag time) peut simplement dépendre de la combinaison entre l’effet Allee et les processus de stochasticité de la population[A 1], ce qui devrait être pris en compte par les programmes de gestion d'espèces envahissantes. Un effet Allee non reconnu peut causer une estimation erronée des risques d’invasion[A 9].
On ne peut jamais dire qu’une espèce n’est pas envahissante parce que de petites introductions aléatoires n’ont pas conduit à une invasion ; répétées dans le temps, ces petites introductions réparties aléatoirement dans différents patchs peuvent finir par dépasser la densité géographique critique permettant alors à l'espèce de brutalement devenir pandémique[A 3]. Ainsi, l’invasion dans un espace discret combiné à un effet Allee se manifeste par une série d’événements locaux et brusques[A 3]. Pour une espèce envahissante avec un fort effet Allee, l’éradication est facilitée car il suffit de réduire la densité de la population sous le seuil d’Allee[A 7].
La présence de l’effet Allee permet d'utiliser un prédateur (ou compétiteur) « spécialiste » de l’espèce plutôt que « généraliste » : les prédateurs généralistes peuvent ralentir ou arrêter la dispersion de n’importe quel envahissant, mais les prédateurs spécialistes ne peuvent affecter que les populations sujettes à un effet Allee et peuvent ralentir la dispersion dans le cas d’un effet Allee non critique et l’arrêter dans le cas d’un effet critique[A 10].
La réussite d'une stratégie de gestion dépend du type d’effet Allee (fort et faible), mais aussi du budget affecté au programme de gestion et à l'adéquation de ses objectifs[A 6].
Aspects législatifs des mesures de luttes
Projet de nouvelle stratégie et réglementation européennes sur les espèces exotiques envahissantes (2011-2014)
La Commission Européenne a lancé une consultation[99] en ligne (ouverte à tous) ; du au et prévoit une communication pour la fin 2008, qui devrait se traduire par des mesures européennes pour analyser et traiter ce problème.
La Commission européenne a préparé de 2008 à 2013 une nouvelle stratégie[100], annoncée en 2008[101], avec une nouvelle proposition législative, soumise au Conseil et au Parlement le ; elle vise à prévenir et gérer le danger induit par ces espèces. Elle a trois priorités : la première qui permettent des contrôles visant à alerter en amont et éviter l'introduction intentionnelle d'espèces préoccupantes ; la seconde d'effectuer des mesures d’éradication en cas d'émergence d'une « invasion biologique » et enfin la troisième d'effectuer des mesures d'atténuation des dommages quand l'espèce est déjà installée[102]. les États-membres pourront alimenter la liste des espèces à considérer comme « envahissantes ».
Fin 2008, 14 États membres n'avaient pas encore de stratégies ou de plans visant à réduire les impacts des espèces envahissantes (ni des génotypes allochtones), bien que certains aient évoqué ces espèces dans leur stratégie nationale en matière de biodiversité.
En 2010, selon les experts réunis au Congrès Congrès Neobiota 2010[103], le coût annuel des dégâts induits par ces espèces pourrait atteindre, voire dépasser 12 milliards d'euros/an.
En 2014, un nouveau règlement européen « fixe des règles visant à prévenir, à réduire au minimum et à atténuer les effets néfastes sur la biodiversité de l'introduction et de la propagation au sein de l'Union, qu'elles soient intentionnelles ou non intentionnelles, d'espèces exotiques envahissantes »[104] ; il a été adopté le , et son article 4 prévoit une « Liste des espèces exotiques envahissantes préoccupantes pour l'Union » à fixer au plus tard le (est jugée préoccupante pour l'Union « une espèce exotique envahissante dont les effets néfastes ont été jugés de nature à exiger une action concertée au niveau de l'Union en vertu de l'article 4, paragraphe 3 » (du règlement)[104].
En 2015 le règlement no 1143/2014 entre en vigueur, permettant à l'Union européenne de mener une lutte renforcée et coordonnée. Il vise à limiter l'expansion des espèces déjà introduites en Europe et d'éviter l'arrivée de nouvelles espèces envahissantes.
En , la 1re liste européenne des espèces exotiques envahissantes[105] : elle recense 12 000 plantes, animaux, champignons ou micro-organismes installés sur le territoire européen sans en être originaires, 10 à 15 % environ étant devenues envahissantes[106], et regroupe 37 espèces, considérées comme causant le plus de dégâts ou comme des menaces émergentes graves pour la biodiversité, la santé publique et l'économie (plus de 12 milliards d'euros de dégâts par an selon la Commission Européenne) et nécessitant des mesures de lutte dans les 27 États-membres. Une mise à jour est en préparation[107]. Un règlement comportant des restrictions d'utilisation, d'importation, de vente, d'alimentation et d'élevage de ces espèces entre en vigueur 20 jours après la publication de cette liste européenne[107].
En France


En France, un arrêté ministériel du [108] interdit la commercialisation, l’utilisation et l’introduction dans le milieu naturel de la jussie à grandes fleurs et de jussie rampante (deux plantes envahissantes), puis un arrêté ministériel du vise diverses espèces réputées envahissantes et interdit l’introduction de certaines espèces dans le milieu naturel métropolitain[109]. Divers inventaires sont faits ou déjà publiés, qui seront à régulièrement mettre à jour, notamment à l'échelle de bassins, les canaux[110] et cours d'eau, ainsi que les ports étant des axes d'introduction importants pour nombre d'envahissantes[111]. La France, y compris pour les phénomènes de maladies émergentes, est une zone à haut risques, car très bien desservie par des aéroports en lien avec le monde entier, traversée de nombreux axes de transport terrestres ou marins et par canaux, et « seul pays d’Europe à avoir une façade à la fois sur la Mer du Nord, la Manche, l’Atlantique et la Méditerranée pour un total de 5 500 km de côtes »[111], avec des ports d’importance internationale (de Bordeaux à Dunkerque, en passant par La Rochelle, Nantes, Brest, Cherbourg, Le Havre, Boulogne, Calais, etc.)[112]. Cette position de carrefour géographique « multimodal » et son climat tempéré sont très propices à l'introduction d'espèces et au risque d'envahissement.
En complément de l'article l'article L. 411-3 du code de l'environnement, un projet de loi, préparé en 2013 par le « Comité Parlementaire de Suivi du Risque Ambroisie » a été élargi à d'autres espèces susceptibles de poser problème, et annoncé pour mi-2014. Il pourrait être examiné en automne 2014 pour fixer un cadre juridique national de lutte contre des plantes envahissantes et indésirables pour des raisons sanitaires ou économiques (orobanche). En 2016, pour l'association Stop ambroisie « Il faut étendre les pouvoirs de police des maires en leur donnant le droit d'intervenir sur les terrains privés pour se substituer aux propriétaires qui ne font rien »[8].
En Suisse
Le , le Conseil fédéral a ouvert une consultation afin de rendre plus efficace la lutte contre les espèces envahissantes exotiques causant des dégâts, au moyen de modifications de la loi sur la protection de l’environnement (LPE)[113] - [114]. Les mesures ne seraient plus seulement appliquées dans les forêts et zones agricoles, mais aussi chez les particuliers, selon le rapport explicatif[115].
Notes et références
- Seebens H & al. (2017) No saturation in the accumulation of alien species worldwide ; Nature Communications 8, Article number: 14435 ; doi:10.1038/ncomms14435 résumé)
- D'après l'Union internationale pour la conservation de la nature (UICN)
- Une espèce indigène s'oppose à une espèce exotique. Une espèce indigène est naturellement présente alors qu’une espèce exotique est introduite, volontairement ou non, sur le même territoire. Le Conseil de l'Europe catégorise "exotique" une plante introduite à partir de 1500 après J.-C.
- P. Genovesi & C. Shine, Stratégie européenne relative aux espèces exotiques envahissantes, éditions du Conseil de l'Europe, 2004
- « INPN - Espèces introduites envahissantes (invasive) », sur inpn.mnhn.fr (consulté le )
- « Définitions : invasif - Dictionnaire de français Larousse », sur larousse.fr (consulté le )
- Société Herpétologique de France, « Les espèces exotiques envahissantes », sur life-croaa.eu
- Selon Franck Courchamp, directeur du recherche au CNRS, in Environnement-magazine (2016) Le comité parlementaire du suivi du risque Ambroisie et autres espèces envahissantes alerte une nouvelle fois sur les enjeux sanitaires et économiques d'une invasion que le cadre législatif et réglementaire n'a pas permis de juguler. Voir aussi http://www.parlementaires-ambroisie.fr
- Pascal et al., 2000.
- selon le modèle Nobis. La forte diversité dans les régions chaudes et peuplées est manifeste. voir page 21
- Kennedy T.A., Naeem S., Howe K.M., Knops J.M.H., Tilman D. & Reich P., 2002 - Biodiversity as a barrier to ecological invasion. Nature, 417, 636–638 (Résumé)
- Stachowicz J.J., Fried H., Whitlatch R.B. & Osman R.W., 2002 - Biodiversity, invasion resistance, and marine ecosystem function: reconciling pattern and process. Ecology, 83, 2575–2590 (Résumé)
- Bulleri F. et Airoldi L., Artificial marine structures facilitate the spread of a non-indigenous green alga, Codium fragile ssp. tomentosoides, in the north Adriatic Sea ; Journal of Applied Ecology, 42, 6, 1063–1072, online: 2005/10/31 ; Version papier December 2005. DOI: 10.1111/j.1365-2664.2005.01096.x (Article complet)
- MacNeely J., Strahm W., 1997 - L'UICN et les espèces étrangères envahissantes : un cadre d'action. Conservation de la vitalité et de la diversité. In UICN (Ed.), Congrès mondial sur la conservation, Ottawa, 3-10
- Muller S., 2004 - Plantes envahissantes en France. Muséum national d’histoire naturelle, Paris.
- (en) Bernd Blossey & Rolf Notzold, « Evolution of Increased Competitive Ability in Invasive Nonindigenous Plants: A Hypothesis », Journal of Ecology' vol. 83, no 5, , p. 887-889
- (en) R.M. Keane & M.J. Crawley, « Exotic Plant Invasions and the Enemy Release Hypothesis », Trends in Ecology and Evolution, 17, 2002, p. 164-169.
- 10 % des espèces introduites dans un nouvel environnement parviennent à s'y établir, et 10 % de ces dernières deviennent réellement envahissantes, prenant la place d'autochtones.
- Williamson M., Biological invasions, Chapman & Hall, London, 1996, 256 p.
- (en) RICHARDSON D.M., PYSEK P., REJMANEK M., BARBOUR M.G., PANETTA F.D. et WEST C.J., « Naturalization and invasion of alien plants : concepts and definitions », Biodiversity and Distribution, no 6, , p. 93-107
- Vitousek, P.M., D'Antonio, C.M., Loope, L.L., Rejmànek, M., Westbrook, R., 1997. Introduced species: a significant component of human-caused global change. N. Z. J. Ecol. 21, 1-16.
- Usher, M.B., Kruger, F.J., Macdonald, I.A.W., Loope, L.L., Brockie, R.E., 1988. The ecology of biological invasions into nature reserves: an introduction. Biol. Conserv. 44, 1-8.
- GERBER E., KREBS C., MURRELL C., MORETTI M., ROCKLIN R., SCHAFFNER U. [2008]. Exotic invasive knotweeds (Fallopia spp.) negatively affect native plant and invertebrate assemblages in European ripirian habitats. Biological Conservation 141 : 646-654 (9 p., 4 fig., 35 réf.).
- Jacques Tassin (CIRAD), 2010 - Plantes et animaux venus d’ailleurs : une brève histoire des invasions biologiques Éditions Orphie, 125 p. (ISBN 978-2-87763-550-9)
- Ostfeld R. S., Keesing F.2000 The function of biodiversity in the ecology of vector-borne zoonotic diseases. Can. J. Zool. 78, 2061–2078. doi:10.1139/cjz-78-12-2061 (doi:10.1139/cjz-78-12-2061)CrossRef
- Keesing F., Holt R. D., Ostfeld R. S.2006 Effects of species diversity on disease risk. Ecol. Lett. 9, 485–498. doi:10.1111/j.1461-0248.2006.00885.x (doi:10.1111/j.1461-0248.2006.00885.x) Web of Science
- Gilbert L., Norman R., Laurenson K. M., Reid H. W., Hudson P. J.2001 Disease persistence and apparent competition in a three-host community: an empirical and analytical study of large-scale, wild populations. J. Anim. Ecol. 70, 1053–1061. doi:10.1046/j.0021-8790.2001.00558.x (doi:10.1046/j.0021-8790.2001.00558.x) Webof Science
- 4.Dobson A.2004 Population dynamics of pathogens with multiple host species. Am. Nat. 164 (Suppl.), S64–S78.CrossRefMedline Web of Science
- Telfer S., Bown K. J., Sekules R., Begon M., Hayden T., Birtles R.2005 Disruption of a host–parasite system following the introduction of an exotic host species. Parasitology 130, 661–668. doi:10.1017/S0031182005007250 Web of Science
- Ezenwa V. O., Godsey M. S., King R. J., Guptill S. C.2006 Avian diversity and West Nile virus: testing associations between biodiversity and infectious disease risk. Proc. R. Soc. B 273, 109–117. doi:10.1098/rspb.2005.3284 (doi:10.1098/rspb.2005.3284) Texte complet
- 13.Swaddle J. P., Calos S. E.2008 Increased avian diversity is associated with lower incidence of human West Nile virus infection: observation of the dilution effect. PLoS ONE 3, e2488. doi:10.1371/journal.pone.0002488 (doi:10.1371/journal.pone.0002488) Medline
- Kelly D. W., Paterson R. A., Townsend C. R., Poulin R., Tompkins D. M., 2009, Parasite spillback: a neglected concept in invasion ecology?; Ecology 90, 2047–2056. doi:10.1890/08-1085.1 Web of Science
- Suzán G., Marcé E., Giermakowski J. T., Mills J. N., Ceballos G., Ostfeld R. S., Armién B., Pascale J. M., Yates T. L.2009 Experimental evidence for reduced rodent diversity causing increased hantavirus prevalence. PLoS ONE 4, e5461. (doi:10.1371/journal.pone.0005461) CrossRef
- Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), I. Biodiversité, écologie et maladies infectieuses, chap. 1 (« Quels sont les effets de la biodiversité sur les maladies parasitaires ? »), p. 26-28, accès libre.
- Valerie A. O'Brien1, Amy T. Moore1, Ginger R. Young, Nicholas Komar, William K. Reisen et Charles R. Brown ; An enzootic vector-borne virus is amplified at epizootic levels by an invasive avian host
- Espèces exotiques envahissantes: l'étude choc sur un fléau mondial, Les Échos, .
- règlement (UE) no 1143/2014 du Parlement européen et du conseil du relatif à la prévention et à la gestion de l’introduction et de la propagation des espèces exotiques envahissantes
- CGDD (2015) Analyse économique des espèces exotiques envahissantes en France : première enquête nationale (2009-2013) (PDF - 3,7 Mo)
- (en) Ehrenfeld, « Ecosystem Consequences of Biological Invasions », Annual Review of Ecology, Evolution, and Systematics 41, no 1,
- (en) Higgins, « What a Difference a Species Makes: A Meta–Analysis of Dreissenid Mussel Impacts on Freshwater Ecosystems », Ecological Monographs 80, no 2,
- (en) Gao, « Exotic Spartina Alterniflora Invasion Increases CH4 While Reduces CO2 Emissions from Mangrove Wetland Soils in Southeastern China », Scientific Reports 8, no 1,
- (en) Simberloff, « How Common Are Invasion-Induced Ecosystem Impacts? », Biological Invasions 13, no 5,
- (en) Brooks, « Effects of Invasive Alien Plants on Fire Regimes », BioScience 54, no 7,
- (en) Bajer, « Biological Invasion by a Benthivorous Fish Reduced the Cover and Species Richness of Aquatic Plants in Most Lakes of a Large North American Ecoregion », Global Change Biology 22, no 12,
- (en) Anderson, « Ecosystem Engineering by Invasive Exotic Beavers Reduces In-Stream Diversity and Enhances Ecosystem Function in Cape Horn, Chile », Oecologia 154, no 1,
- (en) Veiga, « Mollusc Assemblages Associated with Invasive and Native Sargassum Species », Continental Shelf Research 161,
- « Leucaena leucocephala (Lam.) de Wit - FABACEAE - Dicotylédone », sur http://idao.cirad.fr (consulté le )
- (en) Bonanno, « Alien Species: To Remove or Not to Remove? That Is the Question », Environmental Science & Policy 59,
- (en) Strayer, « Eight Questions about Invasions and Ecosystem Functioning », Ecology Letters 15, no 10,
- étude (Trends in Ecology, DOI : 10.1016/j.tree.2011.01.005 ) faite par Philip Hulme (Université de Lincoln à Christchurch, Nouvelle-Zélande)
- brève du par Andy Coghlan : "Botanic gardens blamed for spreading plant invaders", newscientist.com, repris par Tela Botanica Rubrique Points de vue, en ligne mercredi
- Jean Demangeot, Les milieux « naturels » du globe, Paris, Armand Colin, 10e édition, 2002, p. 105
- La nation, no 148 du
- Alerte au ver plat tueur de lombrics ! Le Télégramme
- La France Agricole, no 3489 du , page 27
- Espèces invasives : des plathelminthes terrestres prédateurs de lombrics, Le Courrier de la Nature , no 276, page 14
- Une ombre plane sur notre mascotte. Menace sur les vers de terre, Techniques Culturales Simplifiées , no 73, page 32
- Menace sur nos lombrics, Espèces , no 9, page 9
- Nos vers de terre sont en danger, Réussir Grandes Cultures, http://www.reussir-grandes-cultures.com/actualites/nos-vers-de-terre-sont-en-danger:FUQLYOSZ.html
- « Écosystème - Le ver qui tue les lombrics » Le Télégramme.
- France Inter, Planète Environnement, émission du , « Un ver envahisseur »
- (en) Justine J-L, Winsor L, Gey D, Gros P & Thévenot J, « The invasive New Guinea flatworm Platydemus manokwari in France, the first record for Europe: time for action is now » PeerJ 2014;2:e297. DOI 10.7717/peerj.297 (Article en anglais avec traduction française intégrale)
- Jean-Lou Justine, Leigh Winsor, Patrick Barrière, Crispus Fanai, Delphine Gey, Andrew Wee Kien Han, Giomara La Quay-Velázquez, Benjamin Paul Yi-Hann Lee, Jean-Marc Lefevre, Jean-Yves Meyer, David Philippart, David G. Robinson, Jessica Thévenot et Francis Tsatsia, « The invasive land planarian Platydemus manokwari(Platyhelminthes, Geoplanidae): records from six new localities, including the first in the USA », PeerJ, vol. 3, , e1037 (ISSN 2167-8359, DOI 10.7717/peerj.1037, lire en ligne)
- (en) Inderjit et Chester L. Foy, « Nature of the Interference Mechanism of Mugwort ( Artemisia vulgaris ) », Weed Technology, vol. 13, no 1, , p. 176–182 (ISSN 0890-037X et 1550-2740, DOI 10.1017/S0890037X00045115, lire en ligne, consulté le )
- Marc-André Selosse, « Comment les parasites sculptent les paysages végétaux », Pour la science, no 528, , p. 40-48
- (en) Haeussler S., Bedford L., Boateng J. O., & MacKinnon A., 1999 - Plant community responses to mechanical site preparation in northern interior British Columbia. Canadian Journal of Forest Research, 29(7), 1084-1100 (résumé)
- (en) Köhler B., Gigon A., Edwards P. J. , Krüsi B., Langenauer R., Lüscher A., Ryser P., 2005 - Changes in the species composition and conservation value of limestone grasslands in Northern Switzerland after 22 years of contrasting managements. Perspectives in Plant Ecology, Evolution and Systematics, 7, 1, 51-67 (résumé)
- Source : « Proceedings of the Royal society »,
- (en) T. Alex Perkins, Benjamin L. Phillips, Marissa L. Baskett et Alan Hastings, « Evolution of dispersal and life history interact to drive accelerating spread of an invasive species », Ecology Letters, vol. 16, no 8, , p. 1079–1087 (DOI 10.1111/ele.12136, lire en ligne, consulté le )
- (en) Kenneth D. Whitney et Christopher A. Gabler, « Rapid evolution in introduced species, ‘invasive traits’ and recipient communities: challenges for predicting invasive potential: Evolution and invasion predictions », Diversity and Distributions, vol. 14, no 4, , p. 569–580 (DOI 10.1111/j.1472-4642.2008.00473.x, lire en ligne, consulté le )
- (en) S. Lavergne et J. Molofsky, « Increased genetic variation and evolutionary potential drive the success of an invasive grass », Proceedings of the National Academy of Sciences, vol. 104, no 10, , p. 3883–3888 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.0607324104, lire en ligne, consulté le )
- (en) Norman C. Ellstrand et Kristina A. Schierenbeck, « Hybridization as a stimulus for the evolution of invasiveness in plants? », Euphytica, vol. 148, nos 1-2, , p. 35–46 (ISSN 0014-2336 et 1573-5060, DOI 10.1007/s10681-006-5939-3, lire en ligne, consulté le )
- (en) Oliver Bossdorf, Harald Auge, Lucile Lafuma et William E. Rogers, « Phenotypic and genetic differentiation between native and introduced plant populations », Oecologia, vol. 144, no 1, , p. 1–11 (ISSN 0029-8549 et 1432-1939, DOI 10.1007/s00442-005-0070-z, lire en ligne, consulté le )
- (en) John G. Lambrinos, « HOW INTERACTIONS BETWEEN ECOLOGY AND EVOLUTION INFLUENCE CONTEMPORARY INVASION DYNAMICS », Ecology, vol. 85, no 8, , p. 2061–2070 (ISSN 0012-9658, DOI 10.1890/03-8013, lire en ligne, consulté le )
- (en) Peter J. Prentis, John R.U. Wilson, Eleanor E. Dormontt et David M. Richardson, « Adaptive evolution in invasive species », Trends in Plant Science, vol. 13, no 6, , p. 288–294 (DOI 10.1016/j.tplants.2008.03.004, lire en ligne, consulté le )
- (en) K. M. Dlugosch et I. M Parker, « Founding events in species invasions: genetic variation, adaptive evolution, and the role of multiple introductions », Molecular Ecology, vol. 17, no 1, , p. 431–449 (DOI 10.1111/j.1365-294X.2007.03538.x, lire en ligne, consulté le )
- (en) Carol Eunmi Lee, « Evolutionary genetics of invasive species », Trends in Ecology & Evolution, vol. 17, no 8, , p. 386–391 (DOI 10.1016/S0169-5347(02)02554-5, lire en ligne, consulté le )
- (en) Fred W. Allendorf et Laura L. Lundquist, « Introduction: Population Biology, Evolution, and Control of Invasive Species », Conservation Biology, vol. 17, no 1, , p. 24–30 (ISSN 0888-8892 et 1523-1739, DOI 10.1046/j.1523-1739.2003.02365.x, lire en ligne, consulté le )
- (en) S. J. Novak, « The role of evolution in the invasion process », Proceedings of the National Academy of Sciences, vol. 104, no 10, , p. 3671–3672 (ISSN 0027-8424 et 1091-6490, PMID 17360409, PMCID PMC1820639, DOI 10.1073/pnas.0700224104, lire en ligne, consulté le )
- Lettre d’information du Conservatoire botanique national de Bailleul, Numéro spécial "Invasives", ], [(fr) lire en ligne (page consultée le 8 janvier 2010)]
- Voir par exemple les Fiches invasives (animales et végétales) de l'Agence de l'eau Artois-Picardie
- Office fédéral de l'environnement OFEV, « Utilisations de l’ADN environnemental pour la surveillance et l’évaluation biologiques des écosystèmes aquatiques », sur bafu.admin.ch (consulté le )
- programme Interreg IV A des 2 mers
- Rinse‐Europe
- eu/smartphone‐apps téléchargement sur la plate forme de RINSE ou en recherchant « Th@s Invasive » sur Google Play pour Android ou sur App Store pour iPhone
- Valkenburg, J. L. C. H., Duistermaat, H., & Boer, E. (2013). Image‐driven electronic identification keys for invasive plant species in the Netherlands. EPPO Bulletin, 43(2), 250-254 (résumé.
- Page de waldwissen.net relative aux cernes de croissance chez les herbacées
- Ørjan Totland, Philip Nyeko, Anne-Line Bjerknes, Stein Joar Hegland et Anders Nielsen ; Does forest gap size affects population size, plant size, reproductive success and pollinator visitation in Lantana camara, a tropical invasive shrub ? ; Forest Ecology and Management Volume 215, Issues 1-3, 25 August 2005, Pages 329-338 doi:10.1016/j.foreco.2005.05.023 (Résumé)
- L'état de la planète, L'état de la planète publications, , p. 71.
- Leppäkoski, E., Gollasch, S. & Olenin, S., eds. (2002) Invasive aquatic species of Europe — distribution, impacts and management ; Kluwer Academic Publishers, Dordrecht
- étude dirigée par Montserrat Vilà. publiée lundi dans le magazine de l'Ecological Society of America, citée par le journal Le Monde du , dans un article intitulé Le ragondin et la bernache figurent parmi les dix espèces exotiques les plus envahissantes en Europe
- Stratégie européenne relative aux espèces exotiques envahissantes (Sauvegarde de la Nature, no 137, 74 pages, publié le )
- (CE) no 708/2007 du Conseil du
- Delivering Alien Invasive Species Inventories in Europe
- Chapitre de Alien terrestrial arthropods of Europe d'Alain ROQUES, Marc KENIS, David LEES, Carlos LOPEZ-VAAMONDE, Wolfgang RABITSCH, Jean-Yves RASPLUS et David B. ROY
- base de données Daisie-europe-aliens
- Otero, M., Cebrian, E., Francour, P., Galil, B., Savini, D., « Surveillance des espèces envahissantes marines dans les aires marines protégées (AMP) méditerranéennes », sur IUCN.org, IUCN, .
- Consultation européenne sur les espèces envahissantes
- Portail européen Espèces invasives
- Cf. Suites de la Communication 2008 de la Commission «Vers une stratégie européenne sur les espèces envahissantes»
- Communiqué de la Commission européenne (2013) Environnement: l'UE lance une nouvelle action visant à protéger la biodiversité contre le problème des espèces envahissantes ;
- Neobiota 2010, et (résumé des interventions (282 pages))
- (UE) No 1143/2014 du parlement européen et du Conseil du relatif à la prévention et à la gestion de l'introduction et de la propagation des espèces exotiques envahissantes
- 1re liste européenne des espèces exotiques envahissantes
- « L'UE dresse la liste des espèces invasives », sur lepoint.fr, .
- Fabian Tubiana & Agence Europe (2016), Brève intitulée Espèces envahissantes : l'Europe lance la chasse ; le L'Europe vient de dresser la liste des 37 espèces exotiques envahissantes sur lesquelles les États membres devront concentrer leurs efforts grâce à des plans d'actions coordonnés ; Environnement Magazine,
- Arrêté ministériel du publié au Journal officiel de la République française no 114 du .
- Arrêté du interdisant sur le territoire métropolitain l'introduction dans le milieu naturel de certaines espèces d'animaux vertébrés : Journal officiel de la République française du , édition no 210 Texte de l'arrêté
- Bouquerel J., 2008. Les canaux : des milieux privilégiés pour les macroinvertébrés invasifs. Étude de la région Nord/Pas-de-Calais. Rapport d'études. Agence de l'Eau Artois-Picardie et USTL ; laboratoire d'Écologie numérique et d'écotoxicologie, 81 p.
- Dewarumez J.-M., Gevaert F., Massé C., Foveau A., Grulois D., 2011. Les espèces marines animales et végétales introduites dans le bassin Artois-Picardie. UMR CNRS 8187 LOG et Agence de l’Eau Artois-Picardie. PDF, 140 pages.
- Noël, P., 2002. Les invertébrés aquatiques introduits en France. Bulletin de l’Institut royal des sciences naturelles de Belgique, Biologie 72 suppl, 19-27.
- « Espèces envahissantes : le Conseil fédéral veut ancrer les mesures de lutte dans la loi », sur admin.ch (consulté le )
- https://www.newsd.admin.ch/newsd/message/attachments/56929.pdf
- https://www.newsd.admin.ch/newsd/message/attachments/56930.pdf
Références pour espèces envahissantes et effet Allee
- Ackleh A.S., Allen L.J.S. & Carter J., 2007 - Establishing a beachhead: A stochastic population model with an Allee effect applied to species invasion. Theor. Pop. Biol., 71, 290-300
- Stephens P.A., Sutherland W.J. & Freckleton R.P., 1999 - What is the Allee effect ? Oikos, 87, 185–190
- Keitt T.H., Lewis M.A. & Holt R.D., 2001 - Allee effects, invasion pinning, and species' borders. Am. Nat., 157, 203–216
- Wang M.H. & Kot M., 2001 - Speeds of invasion in a model with strong or weak Allee effects. Math. Biosci., 171, 83–97
- Cappuccino N., 2004 - Allee effect in an invasive alien plant, paleswallow-wort Vincetoxicum rossicum (Asclepiadaceae). Oikos, 106, 3–8
- Taylor C.M. & Hastings A., 2004 - Finding optimal control strategies for invasive species: a density-structured model for Spartina alterniflora. J. Appl. Ecol., 41, 1049–1057
- Liebhold A. & Bascompte J., 2003 - The Allee effect, stochastic dynamics and the eradication of alien species. Ecol. Lett., 6, 133–140
- Leung B., Drake J.M. & Lodge D.M., 2004 - Predicting invasions: propagule pressure and the gravity of Allee effects. Ecology, 85, 1651–1660
- Taylor C.M. & Hastings A., 2005 - Allee effects in biological invasions. Ecol. Lett., 8, 895–908
- Fagan, W.F., Lewis, M.A., Neubert, M.G. & van den Driessche, P. (2002). Invasion theory and biological control. Ecol. Lett., 5, 148–157.
Annexes
Bibliographie
- (en) Elton C.S. 1958. The ecology of invasions by animals and plants. Methuen
- Genovesi M-P. & Shine C. 2003. Stratégie européenne relative aux espèces exotiques envahissantes. Version finale. Convention relative à la conservation de la vie sauvage et du milieu naturel de l'Europe. Comité permanent. 23e réunion. Strasbourg : 50 p.
- Goudard A. 2007. Fonctionnement des écosystèmes et invasions biologiques. Importance de la biodiversité et des interactions interspécifiques. Thèse de doctorat en écologie, sous la direction de Michel Loreau. Université Pierre et Marie Curie - Paris VI, 2007, 216 p.
- Lévêque C., Faut-il avoir peur des introductions d’espèces ?, éd. Le Pommier, 2008
- Lévêque C., 'Quand les espèces deviennent envahissantes, in Biodiversité. Les menaces sur le vivant (Les dossiers de La Recherche no 28, )
- (en) Mc Neely J.A. (Ed). 2001. The Great reshuffling : human Dimensions of invasive Alien Species. IUCN, Gland, Switzerland and Cambridge, UK.VI+242 p.
- Nentwig W., Espèces invasives. Plantes, animaux et micro-organismes, Presses polytechniques et universitaires romandes, coll. « Le savoir suisse », 2012
- Rémy E., Beck C., Allochtone, autochtone, invasif : catégorisations animales et perception d’autrui, Politix.
- (en) Richardson D-M., Pysek P., Barbour M-G., Panetta F-D., Rejmanek M. & Wests C-J. 2000. Naturalization and invasion of alien plants: concepts and definition. Diversity and Distributions 6 : 93–107.
- Tassin J., Plantes et animaux venus d'ailleurs : une brève histoire des invasions biologiques, Éditions Orphie, 2010
- Tassin J., La grande invasion : qui a peur des espèces invasives ?, Éditions Odile Jacob, 2014
- (en) UICN, The World Conservation Union. 2000. Guidelines for the prevention of biodiversity loss due to biological invasion. 15 p.
- (en) Mc Neely J.A., Mooney H.A., Neville L.E., Schei P.J. & Waage J.K. 2001. A global strategy on invasive Alien Species. UICN in collaboration with GISP, Gland, Switzerland, and Cambridge, UK, 55 p.
Articles connexes
- Cent espèces envahissantes parmi les plus nuisibles du monde
- Effet Allee
- Contrôle des espèces envahissantes
- Global Invasive Species Database : base de données qui regroupe les espèces envahissantes
- Insecte ravageur
- Invasion biologique
- Liste d'espèces envahissantes
- Liste d'espèces classées parmi les plus envahissantes au XXIe siècle
- Liste des espèces exotiques envahissantes préoccupantes pour l'Union européenne
- Liste d'espèces susceptibles d'être classées nuisibles en France
- Migration humaine#Migrations préhistoriques
- Extinction de la Mégafaune australienne
- Extinction de l'Holocène
- Plante envahissante
- Défi d'Honolulu
- Mammifères introduits sur les îles de reproduction d'oiseaux marins
- Liste d'espèces envahissantes comestibles
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « Faune invasive : pousse-toi de là que je m’y mette », La Méthode scientifique, France Culture, .
- « Les invasions biologiques », La tête au carré, France-Inter, .
Généralités
- ISSG-GISD-IUCN
- (en+ja) Biodiversity Network Japan
Exemples de pays
- (en) GISD-ISSG-IUCN ci-dessus, pour la France
- (en) Espèces invasives en Belgique
- Site dédié aux espèces envahissantes en Bretagne
- (fr+en) « Dangers liés au déplacement du bois de chauffage ; Ne déplacez pas de bois de chauffage », Agence canadienne d'inspection des aliments, Gouvernement du Canada, .