Évolution rapide
En écoévolution, l’évolution rapide peut être définie comme tout changement génétique héritable qui se produit suffisamment vite pour avoir un impact mesurable sur des processus écologiques ayant lieu sur la même échelle de temps. Les impacts de l'évolution doivent alors être relativement importants par rapport aux impacts causés par les facteurs écologiques pour pouvoir être observables[1].
Les différents mécanismes (la mutation, la dérive génétique, la migration et la sélection naturelle) peuvent potentiellement entraîner une évolution rapide. Cette évolution peut par exemple être causée par des changements de l’environnement entraînant une pression de sélection sur les individus et donc un mécanisme de sélection naturelle. Les changements évolutifs qui en résultent peuvent conduire à des impacts sur l’environnement[2]. Des évènements stochastiques touchant l’ensemble de la population peuvent également survenir comme les catastrophes par exemple, et peuvent entraîner une évolution rapide de la population. On aura dans ce cas-là une dérive génétique faisant évoluer la population très rapidement puisque les individus seront très différents de ceux de la population de départ. La dérive est d'autant plus importante que les populations sont petites[3].
Cet article porte principalement sur l'étude de l'évolution rapide due aux effets de la sélection naturelle sur la population. Ce type d'évolution rapide écoévolutive est notamment due aux interactions existant entre les individus et l’environnement qui les entoure.
Contexte historique
Dès 1859, Charles Darwin, dans De l’Origine des espèces, admet qu’il est probable que les modifications des habitudes (échelle écologique) et de la structure (échelle évolutive) des individus à l’échelle d’une population se réalisent simultanément ou bien sur une toute petite échelle de temps. Dans les années 1950 à 1960, l’idée que l’évolution peut avoir une influence sur l’écologie et la dynamique des populations sur des échelles de temps courtes en comparaison de ce qu'on pensait alors de l'échelle évolutive se développe notamment chez des scientifiques comme D. Chitty ou encore D. Pimentel. J. A. Endler, en 1986, a initié une compilation d’exemples d’évolution rapide qui n’a fait que s’accroître au fil des observations et inclut désormais des analyses sur le long terme de l’évolution rapide en réponse à des changements environnementaux. La caractérisation de l’évolution rapide par Endler fut poursuivie par J. N. Thompson, en 1998, qui suggéra que l’évolution rapide due à la sélection naturelle est fréquente dans la nature. Ces conclusions suggèrent que les dynamiques écologiques et évolutives se produisent à des échelles de temps proches l’une de l’autre, voire confondues[1].
Principes généraux de l'évolution rapide
On a longtemps cru que les processus écologiques étaient tellement rapides par rapport aux processus évolutifs qu’ils ne pouvaient pas avoir lieu à la même échelle de temps. Cependant, aujourd'hui, de nombreux éléments suggèrent que l'on ne peut plus comprendre l’évolution des espèces sans prendre en compte le fait que les espèces sont en interaction avec leur environnement et qu’elles évoluent avec lui. On a une évolution rapide dans le cas des boucles de rétroaction entre l'écologie et l'évolution[1].
Définition de la boucle de rétroaction

On peut définir les boucles de rétroaction entre l’écologie et l’évolution comme les cycles d’interaction reliant les effets de l'écologie sur l’évolution et de l’évolution sur l'écologie.
On désigne ici l’environnement comme l’ensemble de toutes les conditions biologiques et physicochimiques externes aux individus qui peuvent influencer l'évolution de la population. Les changements écologiques de l’environnement agissent sur les individus de la population et vont conduire à un changement évolutif de leurs traits. En effet, les pressions de sélection, via la sélection naturelle agissent sur la variabilité phénotypique des individus (due à la variabilité génétique), c'est-à-dire la variabilité des traits. Les populations évoluent en réponse à ces pressions de sélection et la variabilité phénotypique dans la population peut modifier à son tour l’environnement. Cela est possible car les organismes modifient leur environnement par la prédation, la modification de l'habitat, les ressources en nutriments, etc.[2]
Prenons un exemple simple. On définit l’environnement comme la quantité de ressources et d’herbivores pour une population de plantes pouvant avoir deux stratégies :
- Soit la plante se défend, par exemple en produisant des toxines. Cela a un coût pour la plante (il y aura moins d’énergie allouée à sa croissance et à sa reproduction), elle a besoin de plus de ressources et donc l'environnement se retrouve appauvri en ressources et les herbivores ne peuvent pas manger ce type de plante : stratégie S1.
- Soit la plante ne se défend pas, elle a besoin de moins de ressources et les herbivores peuvent manger ce type de plante : stratégie S2.
On a une variabilité phénotypique qui dépend de la défense des plantes contre les herbivores, et les différents phénotypes auront des conséquences différentes pour l’environnement. Dans un milieu A avec une variabilité phénotypique V1, beaucoup d’individus se défendent (S1 domine). Il y a donc beaucoup moins de ressources disponibles dans l'environnement et la population d’herbivores est faible. Par conséquent, l’environnement est constitué d’une quantité de ressources et d’herbivores faible. Dans un milieu B avec une variabilité phénotypique V2, peu d’individus se défendent (S2 domine). Il y a donc beaucoup de ressources disponibles dans l'environnement et la population d’herbivores est forte. Par conséquent, l’environnement est constitué d’une quantité de ressources et d’herbivores plus forte. La variabilité phénotypique influence l'environnement[4]. Sous l'effet de la sélection naturelle, l'environnement peut modifier la variabilité phénotypique. En effet, la présence d'herbivores sélectionne la stratégie S1 puisque ces derniers ne peuvent pas se nourrir de plantes qui se défendent. Dans cet environnement, les plantes S1 survivent et se reproduisent mieux (meilleure valeur sélective), elles sont donc sélectionnées. La fréquence du phénotype des plantes à stratégie S1 est plus grande que celle du phénotype des plantes à stratégie S2, donc la variabilité phénotypique est modifiée.
Conditions d'apparition
Cette boucle de rétroaction peut se faire si les individus qui composent la population ont de fortes interactions avec leur environnement et si cet environnement peut provoquer l’évolution de la population. Cela implique que les changements écologiques de l’environnement affectent des individus qui sont sélectionnés selon leur différence de valeur sélective (sélection de la population directionnelle ou disruptive) et que la population ait une capacité génétique suffisante pour évoluer en réponse à ces changements (on parle d’évolvabilité). Il ne faut pas que le changement évolutif soit rapide ou que le changement écologique soit lent, il faut que l’échelle de temps de l’écologie et de l’évolution soient suffisamment similaires pour permettre à cette boucle de rétroaction de se faire[2]. L'évolution rapide via la sélection naturelle peut se faire si l'environnement exerce une forte sélection sur les individus de la population. De plus, une autre condition nécessaire est qu'il doit y avoir une forte variabilité phénotypique entre les individus associée à de fortes différences de valeur sélective entre les phénotypes qui sont héritables[3].
Lecture graphique
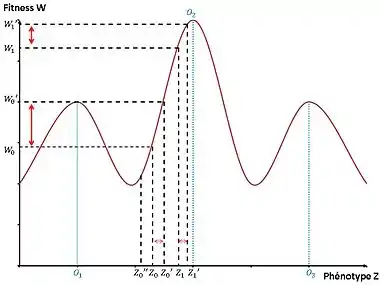
La fitness moyenne des individus de la population résidente dépend du phénotype . Ces différences peuvent être représentées selon un graphique du paysage adaptatif, introduit pour la première fois par Sewall Wright en 1932. On est dans un environnement fixe où la fitness est associée à un caractère. On étudie juste ici l'effet de la sélection c'est-à-dire la variabilité phénotypique entre les individus associée à des différences de valeur sélective[5].
Soit un mutant de phénotype qui apparaît dans la population de phénotype . Il est avantagé si la fitness relative du mutant par rapport à la fitness moyenne de la population est positive (donc si ) sinon le mutant finit par disparaître . Ici, est désavantageux donc il va disparaître de la population alors que est avantageux donc il va envahir la population et finir par remplacer le phénotype résident . Si le mutant est avantagé, on a une évolution rapide si la pente de la fitness de vers la fitness du mutant est forte car le mutant envahit très facilement et très vite la population. Au contraire, quand la fitness du mutant est proche du pic d’optimum de fitness (phénotype optimal), la pente est faible et donc on n’a pas d’évolution rapide. On a par conséquent une évolution rapide pour le phénotype mutant alors que pour le phénotype mutant (qui apparaît dans une population résidente où le phénotype est ), on a une évolution plus lente[5].
On a donc une évolution rapide de la population si on a une forte variabilité phénotypique entre le phénotype mutant et le phénotype résident associées à de grandes différences de valeur sélective donnant un avantage pour le phénotype mutant. Mais cela ne suffit pas, il faut aussi que ce qui a été sélectionné en réponse à la sélection soit héritable.
Équation canonique de la dynamique adaptative
La dynamique adaptative permet de visualiser et de comprendre les conséquences à long terme de l'apparition de petites mutations au sein de la population. On a choisi d'étudier l'évolution rapide par l'intermédiaire de la dynamique adaptative car elle est la méthode la plus simple pour étudier les effets des boucles de rétroaction entre l'écologie et l'environnement et l'évolution.
L'équation des éleveurs (breeder's equation) établie par Jay Lawrence Rush en 1937 décrit la variation d'un trait phénotypique dans une population en réponse à de pressions de sélection :
avec la variation du trait , le différentiel de sélection () et l’héritabilité du trait[6]. Cette formule prend en compte l'effet de la sélection du trait et le fait que seuls les traits héritables vont être transmis. Si est proche de 1 et si est grand, on va avoir une évolution rapide en réponse à la sélection. À partir de cette équation, Dieckmann et Law ont trouvé l'équation canonique de la dynamique adaptative[7] :
: probabilité par individu d’avoir une mutation
: amplitude de variation du phénotype procurée par une mutation
: densité de la population à l’équilibre
: nombre total de mutations observées sur un temps donné
: gradient de fitness : dérivée partielle de la fitness du mutant dans la population résidente (taux de croissance du mutant dans la population résidente) quand le trait mutant est proche du trait résident (sans mutation) . Le gradient de sélection représente biologiquement les forces de sélection agissant sur le trait mutant relativement au trait .
car la fonction en fonction de est une courbe (pente du paysage de fitness) et coupe l’axe des abscisses en . Quand la fitness est supérieure à 0, la mutation est sélectionnée et quand la fitness est inférieure à 0, la mutation est contre-sélectionnée. Autour du point , on a la variance de la mutation qui suit une courbe gaussienne et qui est donc symétrique autour de ce point. Plus est grande, plus la mutation est de grande amplitude (donc plus la mutation est éloignée du trait de la population résidente). Pour , le trait disparaît (il n’est pas sélectionné) donc la moitié de la variance correspondant à cette partie de la mutation ne peut pas être prise en compte. On ne prend en compte que la moitié de la variance correspondant à la partie où le trait est sélectionné[7].
Pour l'équation canonique de la dynamique adaptative, on peut supposer que[7] :
- l'héritabilité est de 1 dans le modèle de la dynamique adaptative ;
- est assez petite car on est dans le cas de l'apparition de petites mutations avec une amplitude faible ;
- le taux de mutation est négligeable ;
- la population du mutant est aussi négligeable puisqu'il n'apparaît qu'un seul mutant.
La variabilité phénotypique est permise par l’héritabilité du trait, la variabilité du trait et la différence de fitness. Or, comme on fait l'hypothèse de négliger la variation du trait et d'avoir une héritabilité de 1, on ne considère avec ce modèle de la dynamique adaptative que la différence de fitness entre le trait mutant et le trait résident dans la population résidente correspondant au gradient de sélection. Le gradient de sélection représente le sens que va prendre le trait après l'apparition du trait et avec quelle amplitude, ce qui veut dire que ce gradient de l'équation canonique provoque une sélection directionnelle avec le décalage de la variance du trait dans la population (cette sélection directionnelle est aussi prise en compte par l'équation des éleveurs).
On peut utiliser cette formule pour étudier l'évolution rapide puisque représente la variation du trait par unité de temps après apparition du mutant. Si ce trait subit une évolution rapide, ces variations vont être rapides dans le temps ce qui veut dire que les variations du trait vont être grandes sur une unité de temps . On peut avoir une évolution rapide lorsque est très supérieur à 0. Cette équation permet de visualiser l'effet de la sélection sur l'évolution d'un trait qui doit être fort dans le cas d'une évolution rapide.
Applications à l'évolution rapide
< 0 signifie que la fitness du mutant apportée par le phénotype mutant est inférieure à la fitness du résident. Le mutant est moins adapté à son environnement que le résident, le mutant va donc disparaître de la population (< 0).
> 0 signifie que la fitness du mutant apportée par le phénotype mutant est supérieure à la fitness du résident. Le mutant est mieux adapté à son environnement que le résident, le mutant va donc envahir la population ( > 0).
Plus le gradient de sélection est grand, autrement dit, plus la fitness relative du mutant par rapport aux résidents est grande, plus le mutant va envahir rapidement la population résidente. L’évolution peut alors être qualifiée de « rapide ».
(>>> 0 ). Le gradient de sélection peut être lu graphiquement car il correspond à la pente du paysage adaptatif. Si la pente est forte cela veut dire que la fitness du mutant est très différente de la fitness du résident. Le mutant va envahir très vite la population résidente et par conséquent il y aura évolution rapide (voir graphique du paysage adaptatif). L’avantage de la dynamique adaptative est qu’elle s’intéresse à la variation des phénotypes en continu contrairement à la théorie des jeux qui étudie des phénotypes discrets.
Ce modèle à des limites car il repose sur quatre hypothèses :
- Les échelles de temps sont séparées : l’échelle de temps écologique est plus rapide que l’échelle de temps évolutive
- Des petites mutations : le mutant diffère un tout petit peu du résident
- Reproduction clonale : héritabilité=1 (pas de reproduction sexué)
- est stable : la dynamique écologique est stable (population à l’équilibre)
Sélection naturelle
La sélection naturelle est l’un des moteurs de l’évolution. Des évènements d’évolution rapide peuvent subvenir lorsque cette pression de sélection intervient de manière forte. De nombreux cas d’évolution rapide sont causés par l’humain.

L'exemple des mouflons d’Amérique du Nord (Ovis canadensis)[8] : les chasseurs de mouflons choisissent leur mouflon dans une optique de chasse aux trophées. Les chasseurs tuent préférentiellement les mouflons les plus gros avec les cornes les plus longues. L’étude des populations de mouflons de 1970 à 2005 a montré que le poids moyen des mouflons était passé de 85 à 65 kg et que la taille moyenne des cornes était passée de 70 à 45 cm, tout ceci en l’espace de 35 ans. Les mouflons sont donc plus petits avec de plus petites cornes. Les mouflons ont été chassés selon des caractéristiques précises ; il y a donc un risque de perturbation de la dynamique des populations de mouflons. C’est la pression de chasse qui est à l’origine de cette évolution rapide.
Conséquences écologiques
Au niveau des populations
Une population peut être définie comme un ensemble d'individus d'une même espèce se trouvant à un même endroit sur une même échelle de temps. L'évolution rapide peut entraîner des modifications sur la dynamique des populations, entraînant des conséquences écologiques diverses. Nous expliquerons des conséquences écologiques possibles à travers l'exemple de la surexploitation des morues de l'Atlantique.

La morue de l’Atlantique (Gadus morhua) est un poisson qui a fait l’objet de pêcheries intensives au cours du dernier siècle, ayant provoqué un effondrement de la population dans les années 1980-1990. À la suite d'un moratoire en mer, mis en place par le gouvernement Canadien en 1992[9], dans le but de permettre le rétablissement de la population de morue. Mais cette dernière croît si lentement qu’actuellement, les pêcheurs ne peuvent toujours pas pêcher la morue.
S’il est clair que cette surexploitation de la morue de l’Atlantique a eu un effet important sur le déclin de la population, il est aussi intéressant de constater qu’avant cet effondrement et en quelques décennies, des modifications dans les traits d’histoire de vie (ou traits biologiques) de cette population ont également été observées. On peut dès lors parler d’une évolution rapide de ces traits d’histoire de vie qui est due à une pression de sélection exercée par la pêche[9].
En effet, la surpêche a entraîné une augmentation de la mortalité des poissons de grande taille et se reproduisant à un âge tardif (maturité sexuelle vers 6 ans) ce qui a donc favorisé fortement les morues de plus petite taille et avec une maturité sexuelle plus précoce[9].

Les travaux d’Olsen et al. effectués en 2004 ont permis de mettre en évidence au sein de la population une diminution de la taille moyenne des poissons ainsi qu’une maturité sexuelle bien plus précoce qu’avant (la maturité sexuelle est passée de 6 à 5 ans) conduisant à une diminution de la fitness moyenne (ou succès reproducteur) des individus, ce qui signifie donc une diminution de la production et de la qualité des descendants[10].
Cette évolution rapide présente un fort impact sur la dynamique des populations de morues puisqu’en provoquant une diminution de la fitness des individus, elle induit une diminution du taux de croissance de la population, qui peut expliquer alors la croissance très lente des populations de morues[11].
Implications en biologie de la conservation
L'évolution rapide peut permettre à une population de s'adapter et de persister face à de nouvelles pressions environnementales : on appelle ce phénomène le
_adult_female_(10385377414).jpg.webp)
secours évolutif[3]. Plusieurs cas ont été observés dans la nature. Par exemple, en Australie des serpents se sont adaptés à la toxicité du crapaud buffle (Rhinella marina), une espèce invasive récemment introduite[12]. Cependant, actuellement, les changements environnementaux d'origine anthropique comme la pollution et l'introduction d'espèces invasives entraînent de nombreuses extinctions. On peut alors se demander sous quelles conditions l'évolution rapide peut permettre de secourir une population ? Dans un article paru en 2007, Kinnison et Hairston[3] ont tenté d'apporter des éléments pour répondre à cette problématique.
_(8397137495).jpg.webp)
Le modèle de Gomulkiewicz et Holt, présenté en 1995, considère une population suivant une dynamique malthusienne et faisant face à un changement environnemental brusque. Ce modèle prédit que sous certaines conditions la population peut évoluer suffisamment vite grâce à une sélection directionnelle pour persister et croître dans le nouvel environnement. L'évolution rapide peut permettre au taux de croissance de devenir assez importants pour que la population croisse de nouveau et atteigne une taille suffisante pour persister. Dans ce modèle, il existe une taille critique de la population (Nc) à partir de laquelle le risque d'extinction de la population devient très important. La population peut se comporter de trois façons : (a) en l'absence d'évolution ou si l'évolution ne permet pas au taux de croissance de devenir suffisamment important, la population décline et s'éteint. (b) dans un premier temps l'évolution ne permet pas d'enrayer le déclin de la population, qui passe sous le seuil critique, mais si la population persiste suffisamment longtemps elle peut s'adapter et sa taille peut de nouveau croître et repasser au dessus du seuil. (c) l'évolution permet à la population de se rétablir sans atteindre la zone critique[3].
Selon ce modèle, plus la sélection est forte, plus l'évolution est rapide. Cependant la taille de la population décroît d'autant plus puisque le nombre d'individus sélectionnés est faible, ce qui entraîne un risque d'extinction plus élevé[3].
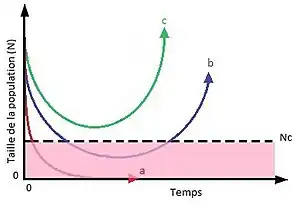
Les populations de petites taille sont souvent touchées par des phénomènes telles que les effets Allee, la dépression de consanguinité ou une stochasticité démographique avec un poids important. Cela peut donner lieu à des vortex d'extinction qui entraînent le déclin puis l'extinction de la population. Cela explique la probabilité d’extinction plus importante lorsque la taille devient inférieure au seuil critique. Lorsque l'évolution permet aux populations de se rétablir bien que l'effectif soit passé sous ce seuil, on observe d'après le modèle de Gomulkiewicz et Holt qu'elles mettent plus de temps à croître de nouveau que les populations qui n'ont pas atteint le seuil. Des populations peuvent évoluer et croître sans rencontrer ces problèmes ou en les surmontant. C'est le cas par exemple des espèces invasives dont les populations introduites sont souvent fondées à partir d'un très petit nombre d'individus[3].
L’évolution peut permettre d’augmenter le taux de croissance de la population en augmentant le taux de natalité ou en diminuant le taux de mortalité, c’est-à-dire en augmentant la fitness moyenne des individus de la population. Dans le cas d’une dynamique logistique, la capacité de charge peut être augmentée en améliorant la capacité des individus à exploiter les ressources disponibles ou en leur permettant d’utiliser d’autres ressources. Un phénomène de vortex de persistance peut avoir lieu : l’évolution peut augmenter le taux de croissance et la taille de la population, ce qui permet d’éviter les problèmes liés aux petites tailles de population et augmente la probabilité que la population persiste[3].
Cependant, la sélection n’est pas toujours directionnelle. Un changement environnemental peut également entraîner une sélection fluctuante si des conditions environnementales différentes se succèdent et que le phénotype optimal est différent selon les conditions. Si la population a le temps de s’adapter à des conditions et qu’elles changent de manière non prédictible, le risque d’extinction de la population sera plus grand. En effet, la population peut ne pas être adaptée aux autres conditions et la sélection ayant conduit à l’adaptation de la population réduit la variabilité génétique, et donc les possibilités d’adaptation futures[3].
Sur des échelles de temps courtes, l’augmentation de la variabilité génétique est surtout permise par des flux de gènes grâce à l’émigration et à l’immigration. Lorsque l’environnement change, les individus provenant d’autres populations peuvent avoir un phénotype mieux adapté que ceux de la population locale. L’apport de phénotypes héritables favorables peut permettre l’évolution rapide et la persistance de la population via la sélection naturelle. Les populations bénéficient d’autant plus de l’immigration que leur taille est petite et leur variabilité faible. Cependant, un apport trop important de variabilité peut empêcher l’adaptation locale : les flux de gènes ne doivent pas être trop importants pour permettre l’adaptation[3].
L’évolution rapide peut donc permettre à des populations en déclin de subsister et de se rétablir. Elle permet également le succès de certaines espèces invasives. Il est donc nécessaire la prendre en compte en biologie de la conservation. Néanmoins, toutes les populations ne peuvent être secourues par l’évolution rapide : si la sélection est trop forte, la taille de la population peut se trouver très réduite. La consanguinité, la dérive génétique, le manque de variabilité génétique et d’autres problèmes liés à une petite taille de population peuvent alors mener à sa disparition bien que la population ait subi une évolution rapide. Ainsi, l’évolution rapide peut aussi permettre de prévoir l’effondrement d’une population. Une taille et une variabilité génétique importantes peuvent permettre à la population de subsister suffisamment longtemps pour s’adapter. Enfin, le potentiel qu’une petite population a de croître et de persister dépend notamment des individus qui la composent[3].
Au niveau des communautés
Une communauté est un ensemble de populations d’espèces différentes vivant en un lieu donné, sur une échelle de temps donnée. Au sein d’une communauté, les espèces interagissent les unes avec les autres et forment notamment des réseaux trophiques. Les communautés possèdent diverses propriétés, telles que la richesse ou l’assemblage spécifique (espèces composant la communauté), l’abondance relative des espèces et la dynamique des populations en interaction (par exemple les interactions proie-prédateur entraînent des dynamiques particulières pour les populations de la proie et du prédateur considérés). Ces propriétés peuvent changer au cours du temps.
Communautés simples
Au sein d’une communauté, différentes populations interagissent entre elles. L’évolution rapide d’une ou plusieurs populations peut donc avoir des conséquences au niveau de leur communauté.
Diverses études ont mis ce phénomène en évidence. La revue de Fussman et al, parue en 2007[13], rend compte de l’état actuel des connaissances sur la compréhension des conséquences de l’évolution rapide sur la dynamique des communautés.
La majorité des études a été réalisée sur des interactions proie-prédateur ou hôte-parasite (notamment hôte-pathogène) et pour des communautés très simples de deux espèces, plus faciles à suivre, à maintenir en laboratoire et à modéliser.
Ainsi, on peut prendre comme exemple d’évolution rapide le cas des interactions proie-prédateur entre les rotifères et leurs proies, des algues unicellulaires, lors d’expériences en laboratoire.
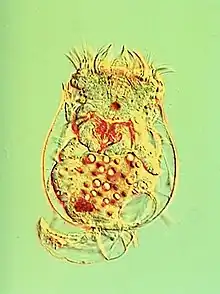
Les rotifères Brachionus calyciflorus consomment des algues vertes unicellulaires et asexuées Chlorella vulgaris. L’étude de Yoshida et al. (2003)[14] a consisté à comparer les dynamiques des systèmes algues-rotifères avec des cultures composées d’un seul clone d’algues (pas de variabilité génétique) et avec des cultures composées de plusieurs clones d’algues différents (génétiquement variables). Les chercheurs ont pris une population d’algues avec différents clones de valeur nutritive et de compétitivité différentes pour tester le potentiel évolutif de la population de proies. Les expériences se font dans des chémostats, dans un milieu limité en azote. Ils obtiennent les résultats suivants : les cultures avec un seul clone ont une différence de phase entre les algues et les rotifères d’un quart de cycle (typique du modèle Lotka-Volterra), alors que pour les cultures avec plusieurs clones, les rotifères et les algues sont presque exactement en phase opposée c’est-à-dire lorsque l’on a un maximum de rotifères, il y a un minimum d’algues. Et aussi, les cultures avec un seul clone ont une dynamique à cycle court alors que pour les cultures avec plusieurs clones, les cycles sont plus longs[14].
Dans le cas où l’on a une population composée de plusieurs clones d’algues de phénotypes différents, la prédation des rotifères et la compétition pour les éléments nutritifs entraîne des changements rapides de la fréquence des génotypes des algues. On a une évolution rapide qui résulte d’un compromis évolutif entre la compétitivité entre les algues la défense contre la prédation des rotifères. On observe deux stratégies avec une variabilité phénotypique du trait de la valeur nutritive des algues. Lorsque l’on a des algues à forte valeur nutritive, on a une augmentation de la densité de rotifères. L’environnement change puisque la prédation des algues augmente avec la densité de rotifères. Cela a pour conséquence que la proportion d’algues à forte valeur nutritive va diminuer en abondance. En parallèle, les algues à faible valeur nutritive survivent mieux à la prédation des rotifères même si le mécanisme reste encore à déterminer. La fréquence de ces algues va augmenter dans la population et donc les clones d’algues à faible valeur nutritive vont dominés progressivement la population. La population de rotifères va diminuer, donc l’environnement va changer puisque la pression de prédation sur les algues va diminuer. Cela se traduit par une augmentation de la densité d’algues lorsqu’il y a très peu de rotifères. La population de rotifères ne répond pas immédiatement à cette augmentation. Elle n’augmente que lorsque la densité en algues est élevée (et que la proportion en algues à forte valeur nutritive a augmenté), ce qui se traduit par un décalage de phase dans le cycle entre les algues et les rotifères. On observe une prédation des algues qui se fait de manière intensive et le cycle recommence[14].
Les prédateurs peuvent aussi évoluer rapidement. Mais on ne sait pas si la pression de prédation des rotifères sur les algues pourrait être plus forte que la pression de sélection des algues sur les rotifères ou si l’évolution des prédateurs pourrait ne pas avoir beaucoup d’influence sur la dynamique du système proie-prédateur. Les résultats de cette étude ont montré que l’évolution rapide des proies peut modifier la dynamique proie-prédateur (durée du cycle et relations de phase) d’où l’idée qu’on ne peut pas ignorer les effets de l’évolution rapide pour comprendre les oscillations de la population de rotifères en lien avec celles des algues dans la nature. Les cycles des populations de proies fluctuent à la suite de la sélection et influent sur la dynamique des populations de prédateurs et inversement. L’évolution rapide des proies en réponse à la densité oscillante des prédateurs affecte donc les interactions proie-prédateur. Les interactions entre les proies et les prédateurs changent en permanence à travers l’évolution rapide[14].
De telles études ont permis de mieux comprendre les effets de l’évolution rapide au niveau des interactions interspécifiques.
Il a également été observé que l’évolution rapide d’une population peut entraîner l’évolution d’une autre population avec laquelle elle interagit. Plusieurs espèces peuvent ainsi évoluer en parallèle, en réponse à des pressions qu’elles exercent l’une sur l’autre : ce phénomène est appelé coévolution. Lorsque la coévolution a lieu à la même échelle de temps que la dynamique résultant de l’interaction et la modifie, elle peut représenter un cas particulier d’évolution rapide au sein d’une communauté, suivant la définition d’évolution rapide proposée par Thomson en 1998[15] et Hairston et al. en 2005[1].
Communautés complexes
.jpg.webp)
Les communautés naturelles sont généralement très complexes : elles comprennent de nombreuses espèces et une grande diversité d'interactions. De nombreux facteurs influencent la dynamique des communautés. De ce fait les conséquences de l'évolution rapide au niveau des communautés naturelles restent mal connues[13].
Il existe néanmoins des exemples permettant d’apporter des éléments dans la compréhension de ces phénomènes. Nous pouvons ainsi citer l’étude réalisées par Johnson et al. au Canada, parue en 2009[16]. Cette étude combine une approche expérimentale en milieu naturel et une approche théorique via la modélisation et montre que l’évolution rapide d’une population de plante par sélection naturelle peut entraîner des modifications au niveau de la communauté d’arthropodes qui lui est associée.
Johnson et ses collègues ont utilisé comme modèle l’Onagre bisannuelle (Oenothera biennis), une herbacée de la famille des Onagraceae originaire des milieux ouverts de l’est de l’Amérique du Nord. Cette plante est connue pour être l’hôte de plus de 150 espèces d’arthropodes différentes. Il s’agit d’une plante se reproduisant par autofédondation : les graines produites par la plante mère lui sont génétiquement identiques, ce qui permet d'obtenir des populations clonales. Au cours de cette étude, des réplicats de 14 génotypes différents ont été plantés aléatoirement dans la zone d'étude afin d'être naturellement colonisés par la communauté d'arthropodes. Plusieurs mesures ont ensuite été réalisées sur différents traits de la plante afin de tester la présence de variabilité génétique, d'héritabilité des traits, la présence de sélection directionnelle et la corrélation entre les traits sélectionnés et des variables de la communauté. Un trait en particulier s'avère répondre à tous ces critères : la biomasse de la plante, avec une sélection pour une biomasse importante[16].

Du fait de la complexité du suivi de la population d’Onagre et de la communauté d’arthropodes dans la nature, Johnson et ses collègues ont opté pour une approche théorique. Les résultats de cette étude ont montré que pour des modèles prenant en compte l’évolution de la plante hôte uniquement, des changements importants pouvaient être prédits au niveau de la communauté d’arthropodes[16].
Entre la première et la seconde génération d'Onagre, l'évolution des traits de la plante entraine une augmentation significative de trois des espèces d'arthropodes les plus courantes de la communauté (Philaenus spumarius, Mompha stellella et Sparaganothis recticulatana), sachant que ces espèces représentent 80 % de la communauté. L'abondance totale en arthropodes augmente également. On observe une augmentation rapide de l'abondance totale en arthropodes durant les premières génération. Ce changement est significativement plus grand pour les modèles où la population évolue par sélection naturelle que pour ceux sans sélection. La richesse spécifique de la communauté d'arthropodes augmente rapidement au cours des premières générations puis diminue. Les effets sont surtout visibles pour de grandes populations de taille constante où la sélection joue un rôle important. Les petites populations évoluant principalement par dérive génétique, leur évolution peut également entraîner des effets au niveau de la communauté d'arthropodes mais ils ne sont pas prédictibles du fait de la stochasticité du phénomène. Les changements prédits au niveau de la communauté sont liés au fait que chaque génotype est associé à un assemblage en arthropodes particulier : la communauté tend vers l'assemblage associé aux génotypes sélectionnés au sein de la population d'Onagre[16].
Cet exemple montre que l'évolution rapide d'une population (les fréquences génotypiques de la communauté d'Onagre varient rapidement sous l'effet de la sélection) peut entraîner des effets significatifs au niveau d'une communauté complexe. Cependant, les résultats de cette étude restent théoriques. De nombreux facteurs influencent la dynamique des communautés et des facteurs écologiques peuvent en réalité se révéler plus importants que l'évolution rapide, ce qui aura pour conséquence d'en masquer les effets[16].
Au niveau des écosystèmes
Par ses implications dans la dynamique des populations et des communautés, l’évolution des populations a la capacité de modifier l’écosystème dans lequel celles-ci vivent. Un écosystème est défini[17] comme étant la somme des interactions entre la biocénose (ensemble des organismes vivants dans un écosystème à un instant donné) et le biotope (ensemble des facteurs abiotiques).
La théorie selon laquelle l’évolution peut se produire sur une échelle de temps écologique suggère que les phénotypes en résultant peuvent avoir différents effets sur les fonctions et la structure de l’écosystème. Des différences entre les individus peuvent via des mécanismes évolutifs comme la sélection naturelle mener à la différenciation des populations et par conséquent avoir un impact sur l’adaptation d’une population au sein d’un écosystème. L’écosystème lui-même peut par la suite être modifié en conséquence de l’évolution rapide d’une population. Cette modification de l’environnement par l’évolution d’une population sur une échelle écologique (évolution rapide selon Thomson 1998 et Hairston et al 2005) est principalement causée par une modification de l’utilisation des ressources présentes dans l’écosystème, perturbant ou modifiant ainsi les flux de nutriments, la productivité primaire, le taux de décomposition de la matière organique ou encore les cycles biogéochimiques. Les conséquences sont la modification de la dynamique des écosystèmes et la mise en place de feed-back entre les processus écologiques et évolutifs (écoévolution)[18].

Il existe plusieurs exemples de modifications d’un écosystème résultant de l’évolution rapide d’une population et ayant pu être mesurées. C’est ce que montre l’étude de l’écosystème de rivières de Trinidad[20] - [21]. Cet écosystème est notamment constitué de guppies omnivores (Poecilia reticulata) qui vivent dans des milieux avec une faible prédation (LP) et dans des milieux avec une forte prédation (HP). Les Guppies HP subissent une plus grande mortalité due à la prédation de ses larves par le killifish (Rivulus hartii). Le système proie-prédateur est à l’origine d’une évolution sur une échelle de temps écologique de la part des Guppies dont la morphologie, la performance de nage mais aussi le comportement divergent de l’autre population LP. Les deux populations sont génétiquement différentes et ces modifications des traits sont héritables.

Dans des mésocosmes (lieu confiné dont les paramètres sont modifiables par un expérimentateur qui simule un écosystème) sans guppies (seulement killifish) l’ajout de guppies HP révèle une évolution des traits sur une échelle de temps écologique ce qui laisse penser que les prédateurs ont un rôle direct sur l’évolution rapide des guppies. Cette modification des traits entre les deux populations de guppies a des implications dans l’excrétion d’azote, dans les cascades trophiques et aussi dans le régime alimentaire des guppies. En effet, les habitats HP ont moins de vertébrés comme sources nutritives (plus de compétition entre les killifish et les guppies pour cette ressource) et plus d’algues que les habitats LP. Il a été observé expérimentalement dans ces mésocosmes que les guppies des environnements HP sont plus sélectifs dans leur régime alimentaire, ils consomment plus d’invertébrés que les LP et consomment moins de diatomées et de détritus. Ce régime alimentaire différentiel entre les deux populations et les différences de cascades trophiques qui s’ensuivent modifient considérablement l’écosystème considéré. Dans les milieux HP, comparativement aux milieux LP, le stock d’algues est plus important mais la biomasse de la production primaire, les stocks d’invertébrés et la décomposition des feuilles sont moins importants. La modification de l’excrétion de nitrate chez les deux populations fait varier le taux de production d’algues dans l’écosystème et plus généralement de producteurs primaires. La modification de l’écosystème de rivières de Trinidad est donc liée à la fois par l’évolution rapide locale des guppies et l’effet de la prédation sur les densités des guppies présents.
L’évolution rapide d’une population, c’est-à-dire sur une échelle temporelle écologique, peut donc avoir des conséquences sur la structure et le fonctionnement des écosystèmes.
Notes et références
- (en) Hairston, Nelson G., Ellner, Stephen P., Geber, Monica A. et Yoshida, Takehito, « Rapid evolution and the convergence of ecological and evolutionary time », Ecology Letters, vol. 8, (ISSN 1461-0248, DOI 10.1111/j.1461-0248.2005.00812.x/abstract, lire en ligne, consulté le )
- (en) David M. Post et Eric P. Palkovacs, « Eco-evolutionary feedbacks in community and ecosystem ecology: interactions between the ecological theatre and the evolutionary play », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 364, , p. 1629-1640 (ISSN 0962-8436 et 1471-2970, PMID 19414476, PMCID 2690506, DOI 10.1098/rstb.2009.0012, lire en ligne)
- (en) Michael T. Kinnison et Nelson J. Hairston JR, « Eco-evolutionary conservation biology: contemporary evolution and the dynamics of persistence », Functional Ecology, vol. 21, , p. 444-454 (ISSN 0269-8463, DOI 10.1111/j.1365-2435.2007.01278.x, lire en ligne)
- Nicolas Loeuille, Michel Loreau et Régis Ferrière, « Consequences of Plant-Herbivore Coevolution on the Dynamics and Functioning of Ecosystems », Journal of Theoretical Biology, vol. 217, , p. 369–381 (DOI 10.1006/jtbi.2002.3032, lire en ligne, consulté le )
- (en) Jon F. Wilkins et Peter Godfrey-Smith, « Adaptationism and the adaptive landscape », Biology & Philosophy, vol. 24, , p. 199–214 (ISSN 0169-3867 et 1572-8404, DOI 10.1007/s10539-008-9147-5, lire en ligne, consulté le )
- (en) M. B. Morrissey, L. E. B. Kruuk et A. J. Wilson, « The danger of applying the breeder's equation in observational studies of natural populations », Journal of Evolutionary Biology, vol. 23, , p. 2277–2288 (ISSN 1420-9101, DOI 10.1111/j.1420-9101.2010.02084.x, lire en ligne, consulté le )
- (en) Ulf Dieckmann et Richard Law, « The dynamical theory of coevolution : a derivation from stochastic ecological processes », Journal Of Mathematical Biology, vol. 34, , p. 579-612 (ISSN 0303-6812, PMID 8691086, DOI 10.1007/BF02409751, lire en ligne)
- (en) David W. Coltman, Paul O'Donoghue, Jon T. Jorgenson, John T. Hogg, Curtis Strobeck et Marco Festa-Bianchet, « Undesirable Evolutionary Consequences of Trophy Hunting », Nature, vol. 426, , p. 655-658 (DOI 10.1038/nature02177)
- Esben Moland Olsen, George R Lilly, Mikko Heino et M Joanne Morgan, « Assessing changes in age and size at maturation in collapsing populations of Atlantic cod (Gadus morhua) », Canadian Journal of Fisheries and Aquatic Sciences, vol. 62, , p. 811–823 (ISSN 0706-652X, DOI 10.1139/f05-065, lire en ligne, consulté le )
- Esben M. Olsen, Mikko Heino, George R. Lilly et M. Joanne Morgan, « Maturation trends indicative of rapid evolution preceded the collapse of northern cod », Nature, vol. 428, , p. 932–935 (DOI 10.1038/nature02430, lire en ligne)
- Jeffrey A Hutchings, « Life history consequences of overexploitation to population recovery in Northwest Atlantic cod (Gadus morhua) », Canadian Journal of Fisheries and Aquatic Sciences, vol. 62, , p. 824–832 (ISSN 0706-652X, DOI 10.1139/f05-081, lire en ligne, consulté le )
- (en) Ben L. Phillips et Richard Shine, « Adapting to an invasive species: Toxic cane toads induce morphological change in Australian snakes », Proceedings of the National Academy of Sciences of the United States of America, vol. 101, , p. 17150–17155 (ISSN 0027-8424 et 1091-6490, PMID 15569943, PMCID 535375, DOI 10.1073/pnas.0406440101, lire en ligne, consulté le )
- (en) Gregor F. Fussman, Michel Loreau et Peter A. Abrams, « Eco-evolutionary dynamics of communities and ecosystems. », Functional Ecology, vol. 21, , p. 465-477 (ISSN 0269-8463, DOI 10.1111/j.1365-2435.2007.01275.x, lire en ligne)
- (en) Takehito Yoshida, Laura E. Jones, Stephen P. Ellner et al., « Rapid evolution drives ecological dynamics in a predator-prey system », Nature, vol. 424, , p. 303-306 (ISSN 0028-0836, PMID 12867979, DOI 10.1038/nature01767, lire en ligne)
- (en) John N. Thompson, « Rapid evolution as an ecological process », Trends in Ecology & Evolution, vol. 13, , p. 329-332 (DOI 10.1016/s0169-5347(98)01378-0, lire en ligne)
- (en) Mark T.J. Johnson, Mark Vellend et John R. Stinchcombe, « Evolution in plant populations as a driver of ecological changes in arthropod communities », Philosophical Transactions of the Royal Society B, vol. 364, , p. 1593-1605 (ISSN 0962-8436, DOI 10.1098/rstb.2008.0334, lire en ligne)
- Serge Frontier, Denise Pichot-Viale, Alain Leprêtre, Dominique Davoult, Christophe Luczak, Écosystèmes - 4ème édition : Structure, Fonctionnement, Évolution, Paris, Dunod, , 576 p. (ISBN 978-2-10-051935-4 et 2-10-051935-2), p. 2
- (en) Luke J. Harmon, Blake Matthews, Simone Des Roches et Jonathan M. Chase, « Evolutionary diversification in stickleback affects ecosystem functioning », Nature, vol. 458, , p. 1167–1170 (ISSN 0028-0836, DOI 10.1038/nature07974, lire en ligne, consulté le )
- H.Krisp
- (en) Ronald D. Bassar, Michael C. Marshall, Andrés López-Sepulcre et Eugenia Zandonà, « Local adaptation in Trinidadian guppies alters ecosystem processes », Proceedings of the National Academy of Sciences, vol. 107, , p. 3616–3621 (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.0908023107, lire en ligne, consulté le )
- (en) Eric P. Palkovacs, Michael C. Marshall, Brad A. Lamphere et Benjamin R. Lynch, « Experimental evaluation of evolution and coevolution as agents of ecosystem change in Trinidadian streams », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 364, , p. 1617–1628 (ISSN 0962-8436 et 1471-2970, DOI 10.1098/rstb.2009.0016, lire en ligne, consulté le )
- Andy from Pittsburgh, United States 2008
Voir aussi
- Tachytélie et bradytélie
- Systématique évolutionniste




























