Acanthaster planci
L’acanthaster pourpre (Acanthaster planci) est une espèce d’étoiles de mer de couleurs vives, de la famille des Acanthasteridae, de l'ordre des Valvatida (anciennement Spinulosida). Elle est aussi appelée « couronne épineuse », « couronne du Christ » ou « couronne d’épines » ou encore « coussin de belle-mère »[1] - [2].
Cette espèce carnassière vit dans les récifs coralliens de la zone tropicale du bassin Indo-Pacifique ; elle se nourrit presque exclusivement de corail. De dimensions imposantes, de couleurs et de morphologie variables, elle est dotée de piquants dont le venin, qui provoque la nécrose des tissus, est toxique pour un grand nombre d’espèces, l’Homme y compris, ce qui lui fait craindre peu de prédateurs. Sa capacité de reproduction est très importante, les femelles pouvant produire plusieurs dizaines de millions d’œufs par saison. Les larves, planctoniques, sont particulièrement mobiles et peuvent dériver sur des centaines de kilomètres.
L’acanthaster est ainsi connue pour être localement une espèce invasive à fort potentiel de destruction sur les récifs coralliens[3], dont elle consomme les polypes en grande quantité, et elle a fait l’objet de tentatives d’éradication dans certaines régions du monde telles que le Japon ou l’Australie[4]. Les facteurs à l’origine de ces invasions sporadiques des récifs par cette étoile de mer étaient encore à l’étude en 2016[5].
Cette espèce est actuellement en cours de redéfinition, et d'éclatement en plusieurs espèces distinctes : les informations contenues sur cette page pourraient ne pas s'appliquer à toutes les espèces prochainement décrites.
Couronne du Christ, Coussin de belle-mère, Acanthaster pourpre

Description
C'est une grosse étoile de mer aux couleurs variables suivant les régions, allant du rouge au violet profond en passant par diverses teintes de gris, de rose, de bleu et de marron, unie ou chamarrée, avec souvent une couleur différente pour les épines[6] ; ces couleurs semblent suivre parfois des variantes géographiques. Toute la face supérieure est couverte de piquants mobiles longs de 4 à 5 cm, rendus venimeux par des composés présents sous leur épiderme[6]. Les piquants sont entourés de pédicellaires, qui protègent les nombreuses papules respiratoires rouge vif. Celles-ci ont la capacité de se rétracter en cas de menace : ce phénomène change la couleur générale de l'étoile pour l'observateur, la faisant généralement apparaître plus sombre[7]. Elle atteint en moyenne de 25 à 40 cm de diamètre, avec un diamètre maximal enregistré de près de 80 cm[6]. Elle possède de 8 à 23 bras plutôt courts, de section triangulaire (cinq chez les juvéniles, seize en moyenne chez l'adulte[6] - [8]), rayonnants autour d'un large disque central aplati. Son poids varie de 200 g à 3 kg[8] ; le poids est généralement proportionnel à la taille[9].
De trois à seize madréporites assurent la régulation de la pression hydrostatique interne de l’animal[6].
Comme beaucoup d'étoiles de mer, Acanthaster planci est capable de perdre un ou plusieurs bras sans grand danger pour sa survie : elle peut régénérer le ou les bras manquant(s) à une vitesse de 2,5 mm/mois[6] - [10].
.jpg.webp) Acanthaster planci bleue à Bohol (Philippines).
Acanthaster planci bleue à Bohol (Philippines)..jpg.webp) Spécimen brun-rose, photographié à La Réunion.
Spécimen brun-rose, photographié à La Réunion.
Biologie et comportement
Alimentation
Au stade larvaire, cette étoile de mer se nourrit d'algues, d'abord de phytoplancton pélagique (Dinoflagellés et diatomées notamment). Le juvénile, vagile, va tout d'abord se nourrir d'algues encroûtantes (par exemple des Corallinaceae telles que celles des genres Lithothamnium ou Porolithon)[6].
Lorsqu'elle atteint environ 10 mm de diamètre[6], l'acanthaster juvénile devient corallivore et commence à se nourrir principalement des polypes du corail, contre lequel elle va développer un important potentiel de destruction : l'acanthaster adulte escalade les récifs, dévagine son estomac sur le corail, libère ses enzymes digestives puis en absorbe les tissus ainsi liquéfiés. Un seul individu peut ainsi détruire jusqu'à 6 m2 de coraux par an[6]. Un massif corallien en bon état peut supporter entre 1 et 15 acanthasters par hectare[11], mais ce chiffre est aujourd'hui largement dépassé dans de nombreux endroits, notamment en Indonésie et en Australie[12].
Tant qu'ils sont en faible densité, les adultes se nourrissent seulement la nuit, en se tenant à distance les unes des autres et vivant cachées pendant la journée. Mais, poussées par la faim ou la promiscuité lors des grandes invasions, elles deviennent aussi diurnes et peuvent se regrouper en gigantesques fronts de plusieurs centaines d'individus[13]. En 1978, un front de 83 000 individus a été observé au sud de l'île de Tutuila[14] et, sur la Grande Barrière de corail australienne, on a relevé des densités de plus de 14 000 individus/km2[12]. Ces fronts invasifs laissent sur leur passage une large bande blanche de corail mort, qui peut par la suite se recouvrir d'algues pour former à terme une bande verte (où pourront proliférer des algues toxiques comme Gambierdiscus toxicus), qui pourra à son tour provoquer une invasion d'oursins et la fuite des poissons coralliens[15].
L'acanthaster semble s'attaquer préférentiellement à certaines espèces de corail à croissance rapide, comme Acropora, Montipora et Pocillopora[6] - [11] - [16] - [17], mais épargne souvent les espèces protégées par des animaux symbiotiques inquilinistes quand elle le peut (certains Pocillopora, Seriatopora, Stylophora)[18] ou celles où les nématocystes (cellules urticantes des polypes) sont abondantes. Elle évite enfin certaines autres espèces à croissance lente (comme les Porites)[6].
L'acanthaster se nourrit plus pendant l'été, avant la reproduction ; durant les périodes de disette, elle peut vivre sur ses réserves et jeûner pendant près de neuf mois[6]. Dans les cas d'invasion ou de pénurie de nourriture, elle peut s'attaquer à des coraux habituellement évités et, dans les cas extrêmes, l'intégralité du corail peut même être consommée sans distinction, ainsi qu'une grande partie de la faune sessile (éponges, gorgones). Elle peut aussi se nourrir occasionnellement d'algues, de mollusques et d'autres échinodermes, ou même pratiquer le cannibalisme si nécessaire (notamment envers les jeunes)[11].
 Acanthaster planci se nourrissant de coraux.
Acanthaster planci se nourrissant de coraux. Groupe d'acanthasters se nourrissant dans du corail (Acropora).
Groupe d'acanthasters se nourrissant dans du corail (Acropora)._starfish_and_hard_coral_damage_after_feeding.jpg.webp) Cicatrice de nourrissage d'une acanthaster.
Cicatrice de nourrissage d'une acanthaster. Gros plan sur l'estomac partiellement dévaginé d'une acanthaster, dérangée en plein repas.
Gros plan sur l'estomac partiellement dévaginé d'une acanthaster, dérangée en plein repas. Les plis de la paroi stomacale sont visibles sur le corail.
Les plis de la paroi stomacale sont visibles sur le corail.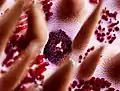 Gros plan sur l'anus d'une acanthaster, entre les piquants et les papules respiratoires.
Gros plan sur l'anus d'une acanthaster, entre les piquants et les papules respiratoires. Gros plan sur les glandes digestives d'une acanthaster prédatée.
Gros plan sur les glandes digestives d'une acanthaster prédatée.
Sens

Les acanthasters sont sensibles au contact (qui provoque notamment la sécrétion du venin et la rétractation des papules respiratoires), ainsi qu'à certains composés chimiques présents dans l'eau[19]. Elles sont ainsi capables de communiquer par signaux chimiques, notamment pour la reproduction, le nourrissage ou dans les cas d'aggrégations[20]. Chaque bras comporte à son extrémité une petite ocelle composée qui permet une vision rudimentaire[21] mais suffisante pour conditionner l'orientation[21], et pourrait jouer un rôle dans l'orientation et la sélection de la nourriture[22], ainsi que l'orientation à certaines distances[21]. De plus, l'ensemble du corps semble parcouru de nerfs pourvus de photorécepteurs permettant de capter les variations de luminosité[21].
_Figure_1.jpg.webp)
Locomotion
L'acanthaster se déplace grâce aux nombreux podias qui tapissent sa face inférieure. Ce sont des excroissances charnues partiellement rétractiles, très mobiles et adhésives, grâce auxquelles elle peut déplacer son imposante masse sur des surfaces verticales, même en cas de houle.
Sa vitesse de déplacement dépend du type de terrain et de l'activité de l'acanthaster. Elle varie de 20 à 30 mètres par heure[5] sur du sable à 0,25 mètre par heure sur du corail, quand elle se nourrit[6]. De gros adultes ont été observés se déplaçant de plus de 500 m en une journée (ce qui demeure exceptionnel et ne permet pas des migrations internationales significatives des adultes)[5]. En moyenne, les acanthasters ne parcourent pas plus d'une trentaine de mètres par jour, et ne le font que quand elles ont terminé de consommer les ressources alimentaires de leur habitat initial[5].
Quand elle est dérangée, l'acanthaster est capable de se mettre en boule pour protéger sa face ventrale plus vulnérable ; dans cet état, elle peut rouler plusieurs mètres avant de se rétablir une fois la menace disparue.
 Face orale d'une acanthaster, montrant les nombreux podia.
Face orale d'une acanthaster, montrant les nombreux podia..jpg.webp) Une acanthaster escaladant le corail aux Îles Fidji.
Une acanthaster escaladant le corail aux Îles Fidji. Les acanthaster sont des étoiles très souples, capable de se mettre en boule.
Les acanthaster sont des étoiles très souples, capable de se mettre en boule.
Reproduction et mode de vie

Reproduction
Cette espèce est dioïque (c'est-à-dire à sexes séparés) ; les gamètes sont émis dans l'eau de mer à la période la plus chaude de l'année. Les individus essaient de synchroniser la reproduction, et adoptent généralement une position bombée caractéristique au sommet d'un bloc de corail pour optimiser la dispersion des gamètes. Une seule femelle peut émettre de 4 à 65 millions d’œufs en une seule fois[6]. La fertilisation sera meilleure s’il y a agrégation des individus (provoquée par communication hormonale[6]) mais elle est encore très bonne à 8 m[6]. Le taux de fertilisation est encore de 5,8 % à 100 m de distance avec un seul mâle, ce qui est sans doute un record chez les échinodermes et même la plupart des organismes marins[23]. La synchronisation de la période de reproduction est, semble-t-il, déterminée par des phéromones[6].
La fécondité des femelles est liée à leur masse. En moyenne, une femelle d'une taille donnée pourra pondre :
- 20 cm de diamètre : 0,5-2,5 millions d'œufs, soit 2-8 % du poids de la femelle
- 30 cm de diamètre : 6,5-14 millions d'œufs, soit 9-14 % du poids de la femelle
- 40 cm de diamètre : 47-53 millions d'œufs, soit 20-25 % du poids de la femelle[24].
Les capacités de régénération de cette étoile lui permettent, si elle se retrouve coupée en deux, de former deux individus autonomes à condition que les moitiés d'étoiles ne soient pas victimes d'infection, de parasitisme ou de prédation avant les 6 semaines nécessaires à la cicatrisation complète[25], période durant laquelle la plaie rend les individus particulièrement vulnérables[26]. La régénération à partir de plus petites parties semble plus rare, et cette étoile ne semble pas capable de reconstituer un individu complet à partir d'un seul bras, ce qui est l'apanage de certaines espèces de la famille des Ophidiasteridae[27]. Pour ces raisons, la reproduction asexuée est très limitée chez cette espèce, et l'autotomie reproductive n'a jamais été observée.
Phase larvaire pélagique
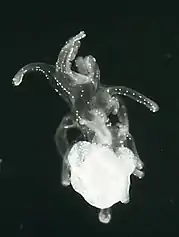
Les œufs puis larves ainsi produits peuvent dériver sur de très longues distances au gré des courants, rendant difficile l'étude de la dynamique migratoire de l'espèce. Les acanthasters passent par deux stades larvaires : le stade bipinnaria (4e à 5e jour), puis le stade brachiolaria (6e à 12e jours)[6]. Suivant l'abondance de nourriture, la forme pélagique peut ainsi durer entre 14 et plus de 50 jours (avec un optimum à 22 jours[5]), permettant aux larves de dériver sur de grandes distances, jusqu'à 300 km[11] ; on observe toutefois une connectivité limitée au-delà de 1 000 km[5]. Leur taux de survie diminue nettement avec la durée de la période planctonique (0,82% à 30 jours, 0,03% à 50 jours)[5]. Elles se nourrissent de phytoplancton et sont la proie des nombreux planctonivores et en particulier du corail près des récifs. La sous-alimentation semble cependant être la cause principale de l'importante mortalité à ce stade ; inversement, la sur-nutrition pourrait jouer un rôle déterminant dans les invasions, permettant également d'accélérer le développement de l'animal[28]. La température optimale pour leur survie est de 26 à 28 °C ; des températures inférieures à 14 °C ou supérieure à 33 °C leur sont létales[6].
Phase larvaire benthique


Une fois atteint le stade compétent, la larve mature se fixe ensuite à partir du 12e jour[6] à un substrat (généralement des algues corallinales poussant sur du corail mort[5]) pour entamer, en phase larvaire benthique, une première métamorphose vers un stade herbivore, avec une forme déjà reconnaissable de petite étoile de mer discoïde à nombreuses branches, forme qu'elle conservera jusqu'à atteindre une taille suffisante pour s'aventurer en terrain découvert et commencer à consommer du corail (généralement 10 mm[6]). La question de la profondeur préférée du lieu de fixation est encore largement non-résolue : on a longtemps pensé que les juvéniles étaient plus abondants en crêtes de récifs, mais le recrutement pourrait aussi se faire au pied des tombants coralliens[5].
Le passage de l'herbivorie au régime carnivore est encore peu étudié mais semble être une phase stratégique de la vie de ces étoiles : en effet, au début, les juvéniles sont encore suffisamment vulnérables pour être sévèrement blessés voire tués par les mécanismes de défense du corail, et la prédation du corail sur les juvéniles semble pouvoir jouer un rôle important dans la dynamique de population de l'espèce[29].
La surface de l'estomac d'Acanthaster planci est nettement supérieure à celle des autres étoiles de mer[8], ce qui lui confère une croissance bien plus rapide en cas d'abondance de nourriture[11].
Croissance
Il faut entre un et trois ans à une acanthaster pour atteindre sa taille adulte[8], le temps d'accumuler suffisamment de réserves pour se métamorphoser. Une fois que ses épines ont bien poussé, elle peut passer plus de temps à se nourrir, n'ayant plus rien à craindre de la plupart des prédateurs, et ainsi s'assurer une croissance rapide et de bonnes chances de reproduction[11]. Bien nourries, ces étoiles peuvent croître de 10 à 15 cm par an, et atteindre un diamètre de 30 cm en trois ans[5].
Le professeur Charles Birkeland note qu'on assiste souvent à des invasions d'acanthaster trois ans après les épisodes de fortes pluies (notamment avec les cyclones tropicaux), qui lessivent le sol des îles et enrichissent la mer en matière organique, provoquant une prolifération du phytoplancton ; ce phénomène est plus important sur les récifs des îles montagneuses ou très étendues, notamment en présence d'agriculture intensive[14]. Le type de lagon semble jouer aussi un rôle important, un lagon profond et très fermé avec un courant faible favorisant le développement des algues et empêchant la dispersion des larves[14]. Les expériences menées en laboratoire ont enfin mis en évidence une meilleure survie des larves en diminuant la salinité et en augmentant la température[30] : ces deux facteurs peuvent donc eux aussi intervenir dans les phénomènes d'explosion de population.
Adulte

Il semble que les acanthasters puissent développer deux modes de vie différents suivant les conditions : en cas d'abondance de nourriture et de forte densité de population, la maturité sexuelle arrive très tôt (à l'âge d'un an), au détriment de la croissance, dépassant rarement 25 cm. Ces individus ont tendance à se regrouper et à se reproduire plus rapidement, réduisant également leur espérance de vie (autour de trois ans). Inversement, les individus isolés vont connaître une croissance plus longue, la maturité sexuelle arrivant vers trois ans, et atteindre des tailles beaucoup plus impressionnantes (généralement 40 cm, jusqu'à 80), et ainsi un potentiel reproductif à terme plus important, aidé par une longévité accrue (jusqu'à une dizaine d'années, parfois jusqu'à quatorze ans[5])[31]. L'éthologie connaît elle aussi de grandes différences entre ces deux « modes », puisqu'on constate que, dans les populations invasives, les étoiles semblent adopter un comportement beaucoup plus audacieux et être moins sélectives dans leur recherche de nourriture[31].
Ces deux modes de vie alternatifs coïncident respectivement avec les deux « stratégies » du Modèle évolutif r/K développé par les études sur la dynamique des populations animales. L'acanthaster serait donc l'un des rares animaux à pouvoir changer de stratégie pour s'adapter à son environnement[31]. Cette adaptation concerne cependant plus la vie des individus que l'écologie de l'espèce : l'exceptionnelle fécondité de l'acanthaster la rapproche ainsi résolument de la « stratégie r », d'autant plus que l'absence de soins prodigués à la progéniture et l'existence de cannibalisme, notamment sur les juvéniles, semble incompatible avec une « stratégie K ».
Venin
%252C_d%C3%A9tail_des_%C3%A9pines.jpg.webp)
Les épines d'acanthaster sont particulièrement pointues, capables de percer une combinaison de plongée, et rendues encore plus efficaces par leur mobilité, permettant à l'animal d'orienter ses piquants pour en optimiser l'angle de pénétration. La piqûre d'acanthaster inocule un venin puissant proche des stéroïdes (plus précisément des saponines, substances détruisant les parois cellulaires et notamment les cellules sanguines), accompagné d'allergènes, d'anticoagulants, et de toxines peptidiques particulières appelées plancitoxines. Curieusement, la séquence peptidique de ces dernières est relativement proche des DNAse II humaines[32].
Une telle piqûre provoque une vive douleur sur le coup, mais le pic de douleur se situe cependant sur les jours suivant l'envenimation. Très souvent la région autour du point de contact devient inflammatoire avec un érythème et un œdème, ainsi qu'un fort risque d'infection. Le membre piqué va gonfler et s'engourdir, pouvant évoluer jusqu'à la paralysie (doigt, main, pied), symptôme qui peut persister plusieurs semaines[1] - [6].
Les envenimations les plus importantes (piqûre multiple, prolongée, etc.) peuvent générer des symptômes généraux tels que des frissons, des nausées et des vomissements, ainsi que parfois des réactions potentiellement dangereuses pour un baigneur isolé (convulsions, paralysie, malaise syncopal, choc anaphylactique, etc.)[1] - [6].
La toxicité du venin, quoique moyenne, est donc normalement non mortelle pour l'homme : pour réduire et tenter de stopper la forte douleur, il faut retirer les piquants à l'aide d'une pince puis désinfecter la plaie à l'alcool ou à la teinture d'iode ; les piquants ayant pénétrés plus profondément doivent être retirés chirurgicalement ; et si les symptômes persistent, il faut se rendre dans un lieu médicalisé[33].
D'après certaines sources, il semble que, même des années après, une seconde piqûre déclenche chez certaines personnes une réaction encore plus violente[11].
Répartition et habitat


On la trouve dans les récifs coralliens des régions tropicales depuis la mer Rouge jusqu'à l'océan Indien et l'océan Pacifique, ainsi que tout le long des côtes pacifiques du Panama, jusqu'au Japon, avec une présence notable et invasive dans la grande barrière de corail en Australie[6]. Elle est absente de l'océan Atlantique et donc des Caraïbes. D'après des recherches récentes, il semblerait que cette répartition ait abouti à une séparation en quatre sous-espèces (mer Rouge, océan Indien nord, océan Indien sud, Pacifique), qui n'auraient pas toutes la même capacité à produire des invasions (ce serait là la seule différence de comportement connue entre ces populations)[34]. Les colorations semblent avoir une variabilité supérieure à ce nombre de subdivisions : violettes et bleues en Thaïlande et aux Maldives, souvent orange et parfois grises en Australie, de grises à marron dans le Pacifique et au Japon, vertes et rouges à Hawaï, violettes, bleues ou rouges dans l'océan Indien etc.
L'acanthaster vit dans les eaux marines, à des profondeurs variant de la surface (quand elle n'est pas trop agitée) jusqu'à −65 m[6], les individus matures tendant à se rapprocher de la surface[6]. On la trouve presque toujours à proximité de sa source de nourriture, principalement dans des eaux calmes, car elle n’aime ni le courant, ni le ressac[6] - [11].
Elle n’apprécie pas les substrats meubles (comme le sable), où elle a du mal à s'accrocher avec ses pieds ambulacraires, et où elle est davantage exposée à ses prédateurs, surtout lorsqu'elle est à l'état juvénile. Elle se cache normalement de la lumière en journée en se logeant dans des anfractuosités ou sous les colonies de corail, mais devient de plus en plus téméraire avec l'âge[35]. Les jeunes vivent généralement cachés, en profondeur, ne sortant que la nuit tant qu'ils sont vulnérables aux prédateurs[6].
Le mode de vie du stade larvaire pélagique est encore mal connu mais il semble avoir la possibilité de dériver sur de très grandes distances[11], possibilité peut-être augmentée par le trafic maritime humain (les larves pourraient être transportées par ballastage).
Écologie
Symbioses
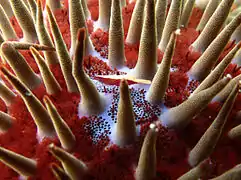
L'acanthaster est connue pour s'attaquer préférentiellement au corail à croissance rapide (comme acropora) au profit du corail à croissance lente (comme porites), ce qui favoriserait ainsi la biodiversité au sein d'un récif[11] ; cet effet « bénéfique » semble cependant annihilé lors des invasions massives[36].
Certains animaux peuvent vivre en mutualisme avec les acanthasters, notamment des crevettes nettoyeuses comme la « crevette des astérides » Periclimenes soror[37], qu'on trouve souvent vivant à l'abri des prédateurs entre les piquants de ces étoiles, qu'elles débarrassent des parasites en retour.
Prédation subie

Très peu de prédateurs semblent capables de s'attaquer à une Acanthaster planci adulte : les trois seuls animaux consommant régulièrement des individus adultes en bonne santé semblent être le Triton Géant (Charonia tritonis), un gros mollusque gastéropode armé d'un aiguillon venimeux[5], ainsi que les poissons-globes Arothron hispidus et Arothron stellatus[38]. La « couronne d'épines » a cependant quelques autres prédateurs occasionnels[39], peu spécifiques et s'attaquant de préférence aux jeunes adultes et aux juvéniles, tels que d'autres poissons-globes (du genre Arothron[38]), le bec de canne bleuté[39], certains gros balistes (Balistapus undulatus, Balistoides viridescens[39], Pseudobalistes flavimarginatus[38]) et le poisson-napoléon[11], ainsi que d'autres gros mollusques comme le casque cornu (Cassis cornuta), la féroce crevette arlequin (Hymenocera picta)[39], et le ver polychète Pherecardia striata[6] (un charognard capable d'entrer dans un individu abîmé pour l'achever en le dévorant de l'intérieur[26]). D'autres ne consomment occasionnellement que les juvéniles ou les individus affaiblis, comme le mérou lancéolé (Promicrops lanceolatus), la langouste fourchette (Panulirus penicillatus) ou certains crabes de la famille des Xanthidae[6] ; le plus féroce prédateur des juvéniles semble être le crabe Schizophrys aspera, même si de nombreux autres petits invertébrés peuvent, sinon les consommer entièrement, du moins les endomager gravement[40]. On a même observé l'absorption d'un jeune Acanthaster planci par un polype solitaire de Paracorynactis hoplites[41] - [5]. La prédation larvaire est très mal connue mais sans doute importante, et des exemples de prédation des œufs et des larves de cette espèce ont été observés de la part de certains coraux ou de certains poissons planctonivores tels que Chromis dimidiata[6].
 Le triton géant (Charonia tritonis) est le principal prédateur connu d'Acanthaster planci adulte.
Le triton géant (Charonia tritonis) est le principal prédateur connu d'Acanthaster planci adulte. Le poisson-ballon étoilé Arothron stellatus est un prédateur courant de l'acanthaster.
Le poisson-ballon étoilé Arothron stellatus est un prédateur courant de l'acanthaster. La crevette Arlequin est un prédateur occasionnel de l'acanthaster.
La crevette Arlequin est un prédateur occasionnel de l'acanthaster. Le ver de feu Pherecardia striata est un prédateur opportuniste de l'acanthaster.
Le ver de feu Pherecardia striata est un prédateur opportuniste de l'acanthaster..jpeg.webp) Le crabe Schizophrys aspera est un prédateur important des juvéniles.
Le crabe Schizophrys aspera est un prédateur important des juvéniles.
Espèce invasive

Une étude de 1989 laisse supposer que cette espèce connait des épisodes invasifs depuis au moins 7 000 ans[42]. Cependant, la population de cette espèce d'étoile de mer semble avoir augmenté depuis les années 1970 et être en partie responsable de la diminution des coraux, notamment au niveau de la Grande barrière de corail[43] et en Indonésie[6]. Dans les années 1970, l'Australie avait réagi en organisant de vastes campagnes de ramassage (privées et publiques), alors que l'Indonésie n'a jamais mis en œuvre les moyens nécessaires au contrôle de la situation. La multiplication de ces prédateurs dans le « triangle corallien » pacifique, une zone particulièrement importante pour la biodiversité marine inquiète les spécialistes de la biologie marine[44], d'autant plus que cette zone concentre les trois quarts des espèces marines du monde, dont plus de 600 sortes de coraux[45].
Cependant, les critères de population normale et d’invasion restent difficiles à établir : le repère subjectif souvent utilisé reste la densité d'acanthasters à partir de laquelle la vitesse de destruction du corail devient manifestement supérieure à sa capacité de réparation. Dans les programmes de comptage systématiques menés en Australie (Green Island en 1980 par exemple[46]), cela représentait 100 adultes/km2[47]. Dans les études sous-marines de moindre ampleur, l'unité utilisée est souvent le nombre d'individus repérés par minute de plongée : à partir de deux acanthasters/minute, on considère que la population est anormalement élevée[48]. Potts définit ainsi une invasion : « agrégation de plusieurs centaines ou milliers d'individus qui persistent à forte densité pendant des mois ou des années et causent de fortes mortalités des coraux sur des grandes étendues[11]. »
De même, l'appellation « espèce invasive » n'est pas réellement adaptée pour l'acanthaster, dans la mesure où ses « explosions de population » ont presque toujours eu lieu sur des sites où elle était présente depuis longtemps, avec une densité de population « normale ». Elle représente donc l'une des rares espèces invasives sur son lieu de vie naturel, ce qui en rend difficile la classification dans les programmes de lutte et l'identification de ces invasions[11].
Il existe plusieurs théories au sujet de cette explosion de population et le débat dans le monde scientifique est ouvert. Voici les principales hypothèses énoncées :
- la surpêche, voire la disparition, de ses principaux prédateurs tels que le triton géant (Charonia tritonis), un mollusque gastéropode recherché par les touristes pour sa belle coquille. Cet argument est devenu minoritaire[28] étant donné la faible prédation subie par l'acanthaster, et le fait que le Triton a toujours été un animal assez peu répandu, et ne privilégie pas spécifiquement cette proie. Quant aux autres prédateurs potentiels, ils ne semblent pas non plus rechercher activement l'acanthaster ni en consommer souvent. De plus, la plupart de ces poissons ne sont pas pêchés industriellement : le baliste est peu pêché et assez courant, comme les poissons-ballons, et le napoléon est protégé. Pour tous les prédateurs potentiels évoqués, aucun ne semble avoir connu d'effondrement brutal de population au cours des dernières décennies, en tout cas pas à l'échelle des explosions de population de l'acanthaster pourpre. De plus, les prodigieuses capacités de régénération de l'acanthaster font que la prédation lui est rarement mortelle[25] : même si la moitié de son corps est dévoré par un prédateur, l'étoile a environ 75 % de chances de survivre[10] (en l'absence de prédateur opportunistes) et de se régénérer en quelques mois, à raison de 0,1 mm/jour[6] ;
- la prolifération pourrait être le résultat d'un processus naturel cyclique, lié à la vitesse de reproduction de ces animaux. Cette théorie est basée sur le fait que la Grande barrière de corail australienne avait connu une invasion d'Acanthaster pourpre dans les années 1970 et dans les années 1980, et que des traces d'invasions plus anciennes ont été confirmées par les études géologiques[49]. Cet argument « naturaliste » est contesté par le fait que, lors des grandes invasions récentes, la fréquence et la capacité de destruction des colonies était bien supérieure à la capacité de résilience des récifs coralliens, qui n'auraient donc sans doute jamais existé si de telles invasions avaient été un phénomène « naturel »[28] ;
- la pollution générée par les effluves journalières des agglomérations urbaines et de l'agriculture qui y est pratiquée. Celle-ci pourrait soit intoxiquer la microfaune prédatrice des larves (à cause des pesticides), soit provoquer une efflorescence algale (à cause des engrais) permettant aux larves, voraces, d'être mieux nourries et ainsi d'accélérer leur croissance et d'optimiser leurs chances de survie. Cet argument, actuellement dominant, demeure discuté[5], et contesté notamment par le fait qu'il devrait concerner parallèlement d'autres espèces, ce qui ne semble pas être le cas[50]. Cependant peu d'espèces ont, à l'âge adulte, une nourriture aussi abondante et disponible que le corail avec une pression de prédation aussi négligeable ;
- un autre argument pour expliquer l'augmentation de la fréquence de ces invasions serait la mauvaise santé du corail lui-même. En effet, les acanthasters repèrent principalement leur nourriture via des signaux chimiques et le corail « stressé » émet des signaux particuliers qui attirent d'autant plus les acanthasters[51]. De plus, dans un environnement en mauvaise santé, d'autres facteurs peuvent favoriser cette étoile de mer, comme l'absence de symbiotes protecteurs du corail (crevette pistolet, ver arbre de Noël, huître corallicole, crabes trapèze[52]…) ou d'habitat pour les prédateurs naturels (crevette arlequin, ver charognard), une faible diversité des coraux, ou encore une faible densité en nématocystes sur les polypes coralliens.
_spines_up_close.jpg.webp)
La théorie actuellement majoritaire dans le milieu scientifique[30] - [28] est cependant que ces explosions de population seraient surtout liées à l'efflorescence de micro-algues qui résulterait du développement de l'agriculture, et qui perturberait le réseau trophique.
Par ailleurs, l'argument de la surpêche des prédateurs semble bien faible étant donné la pression de prédation presque négligeable qu'ils exercent sur les adultes, et le taux de fécondité extrême de la population : un seul couple suffirait en effet à reconstituer toute la population, avec plusieurs millions d’œufs à chaque ponte. Ainsi, le moteur des invasions ne serait pas à trouver dans la population adulte, qui quelle que soit sa densité produira toujours un nombre d’œufs astronomique, mais dans le taux de survie des larves jusqu'à l'âge adulte, période pendant laquelle la mortalité est supérieure à 99,9999 %[53], la plus imperceptible variation de ce taux suffisant à entraîner une invasion massive. C'est pourquoi les campagnes d'« éradication » sont considérées comme vaines, les associations pouvant tout au plus « nettoyer » une petite aire protégée des acanthasters adultes qui la menacent, mais en aucun cas endiguer le flux permanent de milliards de larves[30]. Et encore : en 1980, une équipe nombreuse aidée par l'armée tenta en vain, pendant plusieurs mois, de protéger le célèbre spot de plongée de Green Island sur la Grande Barrière de corail, mais l'invasion finit par submerger la capacité d'élimination des équipes, d'autant plus que le front d'étoiles de mer avançait autant de jour que de nuit[47].
Impact sur les récifs coralliens

Les effets des invasions d'acanthasters sont très variables. Une étude du réseau ReefCheck menée sur environ 400 km de longueur du tiers médian de la grande barrière de corail a montré que, 8 ou 9 ans après le début d'une invasion, jusqu'à 60 % du récif était affecté, surtout dans sa partie externe, et jusqu'à 10 % était entièrement décimé[11] ; le taux de couverture corallienne est par endroits passé de 78 % à 2 % en six mois[6]. Selon une étude de 2013[44] (confirmée en 2016[5]), ces étoiles constitueraient la principale cause de mortalité du corail en Indonésie, avec des taux de mortalité dépassant 50 % sur de nombreux sites.
En Polynésie française, l'île de Moorea a perdu plus de 96% de sa couverture corallienne à cause des acanthasters entre 2005 et 2010[5].
La résilience après cela est lente : les scientifiques estiment qu'il faudrait 12 à 15 ans pour que les coraux à croissance rapide recolonisent l'espace et 50 ans pour ceux à croissance lente, en admettant qu'aucune nouvelle invasion ou perturbation ne survienne[6], les coraux jeunes étant plus vulnérables que les grosses colonies[54]. Les conséquences ne se limitent pas aux coraux : on a remarqué que lors d'une invasion d'acanthasters, les populations de poissons corallivores diminuaient, au profit des espèces herbivores[6], modifiant ainsi durablement la composition de l'écosystème[55].

L'Homme et Acanthaster planci
Depuis les premières grandes invasions modernes, notamment en 1969 sur la grande barrière de corail australienne et sur l'île de Guam, de nombreux gouvernements ont mis en place des programmes de lutte contre les acanthasters, sans jamais parvenir à contrôler de manière durable la population[47].

Les chiffres sont parfois impressionnants : en 1969, 240 000 individus ont été pêchés à Okinawa, puis 354 470 à Ngadarak (Palaos) en 1977[14]. En 1980, on en récolta 490 000 étoiles à Samoa[6]. Au total, 13 millions d'acanthasters furent pêchées aux îles Ryūkyū entre 1970 et 1983 (dont 6 millions pour la seule Okinawa), pour un coût total de près de trois millions de dollars[14] - [56]. Dans tous les cas, ces opérations n'ont pu aboutir qu'à la limitation relative et provisoire de la population sur certains secteurs (aires marines protégées, spots de plongée…), mais n'ont jamais ébranlé le potentiel invasif de l'espèce[47], d'autant plus qu'à la moindre menace, les acanthasters libèrent leurs millions d’œufs en quelques secondes.
Plusieurs méthodes sont utilisées pour le délicat contrôle de la population de cet animal imposant et dangereux[57] :
- les premières opérations consistaient à ramasser les acanthasters de manière plus ou moins artisanale, et souvent peu efficace : les étoiles de mer étaient parfois récoltées et emmenées par bateau sur le continent pour servir d'engrais, notamment au Japon, mais le volume d'acanthasters à ramasser dépassait bien vite la capacité des flottes engagées[56]. Elles étaient ramassées soit à la main avec d'épais gants de protection, soit enfilées par dizaine le long d'un pieu taillé en pointe ;
- pour augmenter la cadence d'élimination, le Japon et l'Australie décidèrent de tuer les acanthasters sur place. La première méthode consistait à les couper en deux puis les rejeter à la mer : elle fut rapidement abandonnée quand on découvrit que les étoiles de mer survivaient souvent à cette méthode, et se régénéraient, peut-être même en deux nouvelles acanthasters[10]. Certains plongeurs préfèrent enterrer les acanthasters à l'envers dans du sable[58], celui-ci les empêchant d'avoir une prise pour se retourner, ce qui les expose à certains prédateurs (mollusques, vers de vase…) : cette méthode semble efficace, mais a un rendement assez faible et oblige à manipuler les étoiles de mer. Une autre façon était de les remonter sur un bateau où elles étaient plongées dans un bac d'eau douce (parfois additionnée de produits pour piscine acides ou chlorés), ce qui les tuait immédiatement par choc osmotique, puis rejetées à la mer : cette méthode s'avéra plus efficace, mais avec toujours une cadence assez faible, même si l'injection d'air comprimé dans les étoiles de mer pour les faire remonter toutes seules vers le bateau a pu accélérer les cadences[59] ;
- la technique moderne la plus utilisée est le fusil-injecteur sous-marin[57] : cette « arme » est développée par une société australienne, et comporte un long injecteur à piston manuel et un réservoir dorsal rempli d'une solution à base de bisulfate de sodium, un produit acide mais biodégradable utilisé dans les piscines[60]. Quatre injections dans des parties différentes du disque central sont nécessaires pour empêcher l'étoile de mer de « cloisonner » la partie de son corps atteinte, et assurer l'élimination de l'animal. Avec cette méthode, un plongeur équipé de 5 L de produit peut tuer jusqu'à 200 acanthasters en une plongée — ce qui reste faible vu le nombre d'individus composant une invasion[15].
Le succès des campagnes d'éradication est étroitement lié au nombre d'individus en cause (de part et d'autre), mais aussi à la topographie du site (superficie, accessibilité, isolement) et de la saison, étant impératif de procéder avant la période de fertilité[61].
Dans la culture
Cette espèce a inspiré deux Pokémon dans la série de jeux vidéo japonais éponyme : Vorastérie et Prédastérie (en anglais : Mareanie et Toxapex). Tous deux sont décrits comme se nourrissant du Pokémon corail Corayon (en anglais : Corsola), et se défendant au moyen des piquants venimeux sur leurs bras[62].
Étymologie et appellations

Acanthaster vient du grec acanthos (épine) et aster (étoile) : le genre signifie donc « étoile épineuse ». Le nom planci vient du naturaliste italien Giovanni Bianchi alias Janus Plancus[1].
En français, on l'appelle communément « couronne d'épines », « Couronne du Christ », « acanthaster pourpre » ou plus malicieusement « coussin de belle-mère », et depuis la médiatisation des phénomènes invasifs on entend souvent l'appellation « étoile de mer dévoreuse de corail ». En anglais elle est généralement nommée Crown-of-thorns starfish (plus rarement Coral-eating starfish), traduit tel quel dans la plupart des langues européennes : Stella corona di spine en italien, Estrella de mar corona de espinas en espagnol et Dornenkronenseestern en allemand[63]. Son nom polynésien est Taramea, et on l'appelle Bula aux Fidji, Rrusech au Palau, et Alamea aux îles Tonga et Samoa[6].
L'acanthaster possède de nombreux noms dans tous les pays où elle est présente, ce qui a permis aux chercheurs d'avoir une idée des lieux d'invasions anciennes. Charles Birkeland a ainsi pu cartographier les îles de l'indopacifique où cette espèce était distinguée par les populations locales des autres étoiles de mer, signe selon lui d'invasions historiques ; le résultat de ce relevé fut utilisé pour vérifier la liste des facteurs de risques qu'il avait établie dans le même article : « Les habitants des îles montagneuses ont souvenir d'invasions anciennes, connaissent des traitements traditionnels pour soigner les piqûres d'A. planci, et utilisent des dénominations spécifiques pour A. planci. Les habitants des atolls n'ont pour leur part aucun souvenir d'invasions et nomment A. planci avec des termes génériques désignant indistinctement toutes les étoiles de mer[14] ».
Systématique et classification

Le premier scientifique occidental à avoir découvert cette espèce fut Georg Everhard Rumphius en 1705 (qui la nomma Stella marina quindecium radiotorum, « étoile de mer à quinze bras rayonnants »), mais elle ne fut réellement décrite qu'en 1758 par Carl von Linné[6], qui la nomma Asterias planci à partir d'illustrations rapportées par les naturalistes italiens Plancus et Gualtieri en 1743. C'est Paul Gervais qui fixa le nom du genre « Acanthaster » en 1841.
Cette espèce a connu plusieurs synonymes taxinomiques : Asterias planci Linnaeus, 1758, Asterias echinites Ellis & Solander, 1786, Acanthaster echinites (Ellis & Solander, 1786), Asterias solaris Schreber, 1793, Acanthaster solaris Schreber, 1793, Stellonia echinites L. Agassiz, 1836, Asterias echinus Gervais, 1841, Acanthaster echinus Gervais, 1841, Acanthaster mauritiensis de Loriol, 1885, et Acanthaster pseudoplanci Caso, 1962[19].
Acanthaster planci est classée au sein de l'embranchement des échinodermes, dans la classe des Asteroidea (étoiles de mer). Elle fait partie de l'ordre des Valvatida depuis 2011, après avoir été longtemps classée comme Spinulosida (étoiles épineuses, mais qui n'ont pas de pédicellaires, contrairement aux acanthasters).
Le genre Acanthaster est, selon les connaissances actuelles, le seul représentant de la famille des Acanthasteridae (y compris dans le registre fossile), et la famille la plus proche semble être celle des Oreasteridae[64], famille de grosses étoiles tropicales (les « étoiles-coussins »), qui comporte d'autres espèces pouvant se nourrir de corail, comme celles du genre Culcita. Des fossiles de l'Eocène présentent des étoiles d'apparence oréastéride relativement proches morphologiquement des acanthasters, suggérant un taxon basal[64].
Il y a débat parmi les scientifiques quant aux espèces à inclure dans ce genre. Ainsi, l'espèce la plus proche d'Acanthaster planci a longtemps été, selon les sources, soit Acanthaster ellisi[65] (souvent considérée comme une simple sous-espèce du Pacifique Est), soit Acanthaster brevispinus[66] - [67], espèce beaucoup plus rare, caractérisée par des piquants plus courts et nombreux sur le disque central, et qui semble préférer les substrats meubles et une alimentation plus omnivore. La possibilité d'hybridation entre ces trois « types » d'acanthasters rend la détermination cladistique d'autant plus difficile[68].


 Hybride de laboratoire d’A. planci et A. brevispinus[68].
Hybride de laboratoire d’A. planci et A. brevispinus[68].
La distinction d'Acanthaster planci en sous-espèces voire espèces est donc encore peu claire[34] - [69], et la corrélation entre les coloris et la zone géographique semble complexe, étant donné qu'une même population peut comporter une grande diversité de robes entre les individus, et que les larves ont un potentiel migratoire assurant un important brassage génétique à grande échelle. Au moins quatre groupes génétiques distincts ont été identifiés : Mer Rouge, Océan Indien sud et ouest, Océan Indien nord et est, et Pacifique[34].
Haszprunar, Vogler et Wörheide proposent depuis 2017 de diviser l'espèce en 4[70] :
- Acanthaster planci (Linnaeus, 1758) -- nord de l'océan Indien, bleue et rouge
- Acanthaster mauritiensis de Loriol, 1885 -- sud de l'océan Indien
- Acanthaster cf. solaris (Schreber, 1795) -- océan Pacifique, max. 23 bras
- Acanthaster benziei Wörheide, Kaltenbacher, Cowan & Haszprunar, 2022 -- Mer Rouge (max. 14 bras, mais des observations jusqu'à 16[71])[72].
Haszprunar & Spies (2014) comptent également Acanthaster ellisii (Gray, 1840), qu'ils considèrent valide même si elle ne figure pas dans la plupart des études récentes[73].
L'espèce pacifique se caractériserait par une couleur plus souvent grisâtre et moins de bras (encore moins, pas plus de 14, pour l'espèce de Mer Rouge), et la « vraie » A. planci serait la seule avec une livrée fixe, bleue et violette. Cependant la diversité des robes et des tailles interdit toute généralité visuelle sur ces espèces, et si leur statut est en voie de confirmation, elles n'ont pour le moment aucune clef fiable de détermination autre que génétique (ou géographique)[70]. Cette nouvelle division, si elle demande encore à être confirmée, commence progressivement à être utilisée dans la littérature scientifique, notamment l'appellation « Acanthaster cf. solaris » pour les spécimens du Pacifique[5].
.jpg.webp) Acanthaster planci planci, typique de la forme du nord de l'océan Indien (ici à Koh Lanta)
Acanthaster planci planci, typique de la forme du nord de l'océan Indien (ici à Koh Lanta) Acanthaster mauritiensis, typique de l'océan Indien du sud (ici à La Réunion).
Acanthaster mauritiensis, typique de l'océan Indien du sud (ici à La Réunion)..jpg.webp) Acanthaster « solaris », typique du Pacifique (ici à Guam).
Acanthaster « solaris », typique du Pacifique (ici à Guam). Acanthaster benziei de Mer Rouge.
Acanthaster benziei de Mer Rouge.
Notes et références
- DORIS, consulté le 30 mai 2014
- Nom vernaculaire en français d’après Termium plus, la banque de données terminologiques et linguistiques du gouvernement du Canada.
- (en) The Nation, « Army of starfish spotted feasting on coral off Phi Phi », sur nationthailand.com, The Nation (Thailand),
- « Grande barrière de corail: un petit plan pour le récif, un grand plan pour l’Australie », sur liberation.fr, Libération,
- (en) Morgan S. Pratchett, Ciemon F. Caballes, Jennifer C. Wilmes, Samuel Matthews, Camille Mellin, Hugh P.A. Sweatman, Lauren E. Nadler, Jon Brodie, Cassandra A. Thompson, Jessica Hoey, Arthur R. Bos, Maria Byrne, Vanessa Messmer, Sofia Valero-Fortunato, Carla C.M. Chen, Alexander C.E. Buck, Russell C. Babcock, Sven Uthicke, « 30 Years of Research on Crown-of-thorns Starfish (1986-2016): Scientific Advances and Emerging Opportunities », Diversity, vol. 9, no 41, (DOI 10.3390/d9040041, www.mdpi.com/1424-2818/9/4/41/pdf).
- (en) P.J. Moran, « Acanthaster planci (L.) : biographical data », Coral Reefs, vol. 9, , p. 95-96 (ISSN 0722-4028, lire en ligne).
- Jack Harrang et François Cornu, « Acanthaster Planci », sur http://fran.cornu.free.fr, François Cornu, (consulté le )
- Professeur Chantal Conand, spécialiste des échinodermes de l'Indo-Pacifique et directrice du laboratoire ECOMAR (Université de La Réunion), « L'étoile épineuse Acanthaster planci », sur vieoceane.free.fr (consulté le ).
- (en) Chantal Conand, « Distribution, reproductive cycle and morphometric relationships of Acanthaster planci in New Caledonia », proceedings of the 5th International Echinoderm Conference, Galway, , p. 499-506.
- (en) V. Messmer, M.S. Pratchett et T.D. Clark, « Capacity for regeneration in crown of thorns starfish, Acanthaster planci (poster) », Coral Reefs, vol. 32, no 461, (DOI 10.1007/s00338-013-1017-1, lire en ligne).
- Élodie Lagouy, État des lieux des étoiles de mer épineuses Acanthaster planci, Taramea, en Polynésie Française, réseau Reef Check Polynésie, , 66 p. (lire en ligne).
- Bernard Salvat, Impacts des activités humaines sur les récifs coralliens : connaissances et recommandations, Moorea, Polynésie Française, Museum national d'histoire naturelle et École pratique des hautes études, Antenne de Tahiti, Centre de l'environnement, .
- Alexandra Gigou, « Les étoiles de mer épineuses Acanthaster planci du lagon de Mayotte : des explosions démographiques de plus en plus fréquentes », un rapport pour le Réseau d’Échange Technique des Aires Marines Protégées Françaises, (lire en ligne).
- (en) Charles Birkeland, « Terrestrial Runoff As a Cause of Outbreaks of Acanthaster planci (Echinodermata : Asteroidea) », Marine Biology, no 69, , p. 175-185 (ISSN 0025-3162, lire en ligne).
- Campagne de lutte contre les Acanthaster Planci (« Taramea ») dans certaines îles de Polynésie Française, rapport final de l'association ReefCheck Polynésie, janvier 2009.
- (en) Glenn De'ath, « Factors affecting the behaviour of crown-of-thorns starfish (Acanthaster planci, L.) on the Great Barrier Reef: 2: Feeding preferences », Journal of Experimental Marine Biology and Ecology, vol. 220, , p. 107-126 (ISSN 0022-0981).
- (en) Morgan Pratchett, « Feeding preferences of Acanthaster planci (Echinodermata: Asteroidea) under controlled conditions of food availability », Pacific Science, no 61, , p. 113-120 (ISSN 1534-6188).
- (en) Morgan Pratchett, « Influence of coral symbionts on feeding preferences of crown-of-thorns starfish Acanthaster planci in the western pacific », Marine Ecology, vol. 214, , p. 111-119 (ISSN 0171-8630).
- World Register of Marine Species, consulté le 30 mai 2014
- (en) Michael R. Hall et al., « The crown-of-thorns starfish genome as a guide for biocontrol of this coral reef pest », Nature, (DOI 10.1038/nature22033, lire en ligne).
- (en) Robert Sigl, Sebastian Steibl et Christian Laforsch, « The role of vision for navigation in the crown-of-thorns seastar, Acanthaster planci », Scientific Reports, vol. 6, no 30834, (DOI 10.1038/srep30834, lire en ligne).
- (en) Jane J. Lee et Christopher Mah, « Surprise! Scientists Find That Starfish Eyes Actually See, at Least a Little », sur le site de National Geographic, (consulté le ).
- (en) R.C. Babcock, C.N. Mundy et D Whitehead, « Sperm Diffusion Models and In Situ Confirmation of Long-Distance Fertilization in the Free-Spawning Asteroid Acanthaster planci », Biological Bulletin, vol. 186, , p. 17-28 (ISSN 0006-3185, lire en ligne).
- (en) C. Birkeland et J.S. Lucas, Acanthaster planci: Major Management Problem of Coral Reefs., Boca Raton, Florida, CRC Press, , 63 p.
- (en) V. Messmer, M. S. Pratchett et T.D. Clark, « Capacity for regeneration in crown of thorns starfish, Acanthaster planci », Coral Reefs, vol. 32, , p. 461 (lire en ligne).
- (en) Christopher Mah, « Worm+Shrimp Versus Crown of Thorns, aka the Importance of the Little Guy », sur Echinoblog, .
- Susan Scott, « Starfish have amazing power of regeneration », Ocean Watch, (consulté le ).
- (en) K. E. Fabricius, K. Okaji et G. De’ath, « Three lines of evidence to link outbreaks of the crown-of-thorns seastar Acanthaster planci to the release of larval food limitation », Coral Reefs, .
- Dione J. Deaker, Benjamin Mos, Corinne Lawson, Symon A. Dworjanyn, Claire Budden, Maria Byrne, « Coral strikes back: the perilous transition of juvenile crown-of-thorns starfish to corallivory », MEPS prepress abstract, (DOI 10.3354/meps13660).
- (en) Jon Brodie, Katharina Fabricius, Glenn De'ath, Ken Okaji, « Are increased nutrient inputs responsible for more outbreaks of crown-of-thorns starfish? An appraisal of the evidence », Marine Pollution Bulletin, vol. 51, nos 1-4, , p. 266-278 (ISSN 0025-326X, lire en ligne).
- (en) Richard Stump, « Life history characteristics of Acanthaster planci (L.) populations, potential clues to causes of outbreaks », U. Engelhardt and B. Lassig (eds) The possible causes and consequences of outbreaks of the Crown-of-Thorns Starfish, Workshop Series, Great Barrier Reef Marine Park Authority, no 18, (lire en ligne).
- (en) K. Shiomi, S. Midorikawa, M. Ishida, Y. Nagashima et H. Nagai, « Plancitoxins, lethal factors from the crown-of-thorns starfish Acanthaster planci, are deoxyribonucleases II », Toxicon, no 44, , p. 499-506 (ISSN 0041-0101, lire en ligne).
- Karim Amri, Animaux mystérieux : Ils peuvent tuer mais aussi sauver des vies, Éditions Favre SA, , 286 p. (ISBN 978-2-8289-1636-7), Acansthater planci (Couronne du Christ) pages 26 et 27
- (en) C. Vogler, « A threat to coral reefs multiplied ? Four species of crown-of-thorns starfish », Biology Letters, (ISSN 1744-9561, lire en ligne).
- (en) G. De'ath et P.J. Moran, « Factors affecting the behaviour of crown-of-thorns starfish (Acanthaster planci, L.) on the Great Barrier Reef #1 : Patterns of activity », Journal of Experimental Marine Biology and Ecology, vol. 220, no 1, , p. 83-106.
- (en) R. Endean, Ann M. Cameron et L.M. DeVantier, « Acanthaster Planci predation on massive corals : the myth of rapid recovery of devasted reefs », Proceedings of the 6th International Coral Reef Symposium, vol. 2,
- Joseph Poupin, Crustacés de la Réunion : Décapodes et stomatopodes : Étude réalisée à l’Institut de recherche de l’École navale (Irenav), publié avec le soutien de la Réserve nationale marine de la Réunion et de l'Institut de Recherches pour le Développement, Marseille, IRD Éditions, (lire en ligne), p. 101
- (en) Zara-Louise Cowan, Morgan Pratchett, Vanessa Messmer et Scott Ling, « Known Predators of Crown-of-Thorns Starfish (Acanthaster spp.) and Their Role in Mitigating, If Not Preventing, Population Outbreaks », Diversity, vol. 9, no 7, (DOI 10.3390/d9010007, lire en ligne).
- (en) Pierre Madl, « Acanthaster planci », sur biophysics.sbg.ac.at, .
- (en) Desbiens, A.A., Mumby, P.J., Dworjanyn, S. et al., « Novel rubble-dwelling predators of herbivorous juvenile crown-of-thorns starfish (Acanthaster sp.) », Coral Reefs, (DOI 10.1007/s00338-023-02364-w).
- (en) Coral reefs, « A newly discovered predator of the crown-of-thorns starfish », sur http://resources.metapress.com, (consulté le )
- (en) Charles Birkeland, Life and death of coral reefs, Springer, , 536 p. (ISBN 0412035413, lire en ligne), p. 217.
- Les chercheurs de l'AIMS Long Term Monitoring Project ont compilé les données d'invasions de la Grande Barrière dans cette animation.
- (en) A. H. Baird, M. S. Pratchett, A. S. Hoey, Y. Herdiana et S. J. Campbell, « Acanthaster planci is a major cause of coral mortality in Indonesia », Coral Reefs, vol. 32, , p. 803–812 (lire en ligne)
- Le Figaro du 18 février 2008.
- (en) Jan Sapp, What is Natural ? : Coral Reef Crisis, New York, Oxford University Press, 1999 et 2003.
- (en) Robert Raymond, Starfish Wars : coral death and the Crown-of-thorns, Macmillan, .
- Thierry Lison de Loma, Yannick Chancerelle et Franck Lerouvreur, « Évaluation des densités d'Acanthaster Planci sur l'île de Moorea », le Rapport CRIOBE UMS 2978 CNRS-EPHE, (lire en ligne).
- (en) Edgar Frankel, « Evidence from the Great Barrier Reef of ancient Acanthaster aggregations », Atoll Research Bulletin, .
- (en) J.M. Branham, « The crown-of-thorns on coral reefs », Bioscience, .
- (en) Kazuhiro Sonoda et Valerie J. Paul, « Effect of stony corals extracts on feeding by Acanthaster planci », Marine Ecology Progress Series, vol. 102, , p. 161-168 (ISSN 0171-8630, lire en ligne).
- (en) C. Seabird McKeon et Jenna M. Moore, « Species and size diversity in protective services offered by coral guard-crabs », PeerJ, vol. 2, (DOI 10.7717/peerj.574, lire en ligne).
- D'après Richard Stump (op. cit.), le taux de survie d'une larve est de moins d'un millionième.
- (en) Matthieu Leray, Maxime Béraud, Arthur Anker, Yannick Chancerelle et Suzanne C. Mills, « Acanthaster planci Outbreak: Decline in Coral Health, Coral Size Structure Modification and Consequences for Obligate Decapod Assemblages », PLOS One, vol. 7, no 4, (lire en ligne [PDF])
- (en) Mohsen Kayal, Julie Vercelloni, Thierry Lison de Loma, Pauline Bosserelle, Yannick Chancerelle, Sylvie Geoffroy, Céline Stievenart, François Michonneau, Lucie Penin, Serge Planes et Mehdi Adjeroud, « Predator Crown-of-Thorns Starfish (Acanthaster planci) Outbreak, Mass Mortality of Corals, and Cascading Effects on Reef Fish and Benthic Communities », PlosOne, vol. 7, no 10, (DOI 10.1371/journal.pone.0047363, lire en ligne [PDF]).
- (en) Acanthaster planci - Management Information, brochure d'information compilée par l'UICN, « SSC Invasive Species Specialist Group » (ISSG).
- (en) Nicole Fraser, Brien R. Crawford et Janny Kusen, « Best practices guide for crown-of-thorns clean-ups », Coastal Resources Center - Coastal Management Report, no 2225, (lire en ligne).
- On trouve notamment des attestations de cette pratique informelle sur les forums de plongeurs, comme « Forum « Sous la mer », sujet : Acanthaster », (consulté le ).
- (en) Sophie Delacour, « page dédiée sur le site de l'université Columbia », (consulté le ).
- Auparavant plusieurs autres produits avaient été testés, dont le formol, l'ammoniaque, le formaldéhyde, le cyanure ou encore l'acide acétique, mais ceux-ci ont été jugés trop nocifs pour l'environnement, alors que le bisulfate de sodium se dissout rapidement sans aucun danger pour les organismes alentour. Il est donc le seul produit agréé par le fournisseur et la plupart des organismes de protection de l'environnement. Source : (en) Sophie Delacour, « page dédiée sur le site de l'université Columbia », (consulté le ).
- (en) Arthur R. Bos, Girley S. Gumanao, Benjamin Mueller et Marjho M.E. Saceda-Cardoza, « Management of crown-of-thorns sea star (Acanthaster planci L.) outbreaks: Removal success depends on reef topography and timing within the reproduction cycle », Ocean & Coastal Management, vol. 71, , p. 116–122 (lire en ligne)
- (en) « Toxapex », sur pokemon.wikia.com.
- DORIS, consulté le 04 juin 2013
- (en) Daniel B. Blake, « The affinities and origins of the crown-of-thorns sea star Acanthaster Gervais », Journal of Natural History, vol. 13, no 3, , p. 303-314 (DOI 10.1080/00222937900770241, lire en ligne).
- (fr+en) Référence ITIS : Acanthaster Gervais, 1841.
- (en) Référence NCBI : Acanthaster (taxons inclus).
- (en) Référence World Register of Marine Species : taxon Acanthaster Gervais, 1841 (+ liste espèces).
- JS Lucas et Jones MM, « Hybrid crown-of-thorns starfish (Acanthaster planci X A. brevispinus) reared to maturity in the laboratory », Nature, vol. 263, , p. 409-412 & cover
- (en) John A.H. Benzie, « Major genetic differences between crown-of-thorns starfish (Acanthaster planci) populations in the Indian and Pacific Oceans », Evolution, no 53 (6), , p. 1782-1795.
- (en) Gerhard Haszprunar, Catherine Vogler et Gert Wörheide, « Persistent Gaps of Knowledge for Naming and Distinguishing Multiple Species of Crown-of-Thorns-Seastar in the Acanthaster planci Species Complex », Diversity, (www.mdpi.com/1424-2818/9/2/22/pdf).
- « Observations d'Acanthaster en Mer Rouge », sur iNaturalist.
- (en) Gert Wörheide, Emilie Kaltenbacher, Zara-Louise Cowan et Gerhard Haszprunar, « A new species of crown-of-thorns sea star, Acanthaster benziei sp. nov. (Valvatida: Acanthasteridae), from the Red Sea », Zootaxa, (DOI 10.11646/zootaxa.5209.3.7, lire en ligne).
- (en) GERHARD HASZPRUNAR et MARTIN SPIES, « An integrative approach to the taxonomy of the crown-of-thorns starfish species group (Asteroidea: Acanthaster): A review of names and comparison to recent molecular data », Zootaxa, vol. 3841, no 2, (DOI 10.11646/zootaxa.3841.2.6).
Voir aussi
Articles connexes
- Coussin de belle-mère
- genre Acanthaster, échinodermes de la classe des étoiles de mer (Asteroidae) et de l'ordre des Valvatida
- Acanthaster brevispinus
- Acanthaster ellisi
- espèces invasives
- récif corallien
Bibliographie
- (en) Mark D. Bertness, Steven D. Gaines et Mark E. Hay, Marine Community Ecology, Stamford, Connecticut, Sinauer associates, .
- (en) Robert Raymond, Starfish Wars : coral death and the Crown-of-thorns, Australie, Macmillan, , 218 p.
- Elodie Lagouy, État des lieux des étoiles de mer épineuses Acanthaster Planci (Taramea) en Polynésie Française, Papeete, réseau « Reef Check Polynésie », .
- (en) Katharina Fabricius, Ken Okaji et Glenn De’ath, « Three lines of evidence to link outbreaks of the crown-of-thorns seastar Acanthaster planci to the release of larval food limitation », Coral Reefs, .
- (en) Jon Brodie, Katharina Fabricius, Glenn De'ath, Ken Okaji, « Are increased nutrient inputs responsible for more outbreaks of crown-of-thorns starfish? An appraisal of the evidence », Marine Pollution Bulletin, vol. 51, nos 1-4, , p. 266-278 (ISSN 0025-326X, lire en ligne).
- (en) P.J. Moran, Crown of Thorns Starfish – Questions and Answers, Australian Institute of Marine Sciences, Townsville, 1997.
- (en) P.J. Moran, Acanthaster planci (L.) : biographical data, Coral Reefs, 1990.
- (en) P.J. Moran, The Acanthaster phenomenon, Oceanographic Marine Biology, 1986.
- (en) N. Fraser, B. Crawford, & J. Kusen, Best Practices Guide for Crown of Thorns Clean-ups, Proyek Pesisir, Indonesia ; Coastal Resources Center, Coastal Management Report, #2225.2000.
- (en) Jan Sapp, What is Natural ? Coral Reef Crisis, New York, Oxford University Press, 1999 et 2003.
- Bernard Salvat, Impacts des activités humaines sur les récifs coralliens : connaissances et recommandations, Moorea, Polynésie Française, Museum national d'histoire naturelle et École pratique des hautes études, Antenne de Tahiti, Centre de l'environnement, .
- Chantal Conand, « Acanthaster Acanthaster planci », Bull. Nat., Hist. & Géo., Mayotte, no 5, , p. 26-29.
- (en) Nicole Fraser, Brien R. Crawford et Janny Kusen, « Best practices guide for crown-of-thorns clean-ups », Coastal Resources Center - Coastal Management Report, no 2225, (lire en ligne).
- (en) Morgan S. Pratchett, Ciemon F. Caballes, Jennifer C. Wilmes, Samuel Matthews, Camille Mellin, Hugh P.A. Sweatman, Lauren E. Nadler, Jon Brodie, Cassandra A. Thompson, Jessica Hoey, Arthur R. Bos, Maria Byrne, Vanessa Messmer, Sofia Valero-Fortunato, Carla C.M. Chen, Alexander C.E. Buck, Russell C. Babcock, Sven Uthicke, « 30 Years of Research on Crown-of-thorns Starfish (1986-2016): Scientific Advances and Emerging Opportunities », Diversity, vol. 9, no 41, (DOI 10.3390/d9040041, www.mdpi.com/1424-2818/9/4/41/pdf).
Références taxinomiques
- (en) Référence World Register of Marine Species : espèce Acanthaster planci (Linnaeus, 1758)
- (fr) Référence SeaLifeBase :
- (fr) Référence INPN : Acanthaster planci (Linnaeus, 1758) (TAXREF)
- (fr+en) Référence ITIS : Acanthaster planci (Linnaeus, 1758)
- (en) Référence Catalogue of Life : Acanthaster planci (Linnaeus, 1758) (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence Animal Diversity Web : Acanthaster planci
- (fr) Référence DORIS : espèce Acanthaster planci
- (en) Référence GISD : espèce Acanthaster planci
- (en) Référence NCBI : Acanthaster planci (taxons inclus)
- (fr+en) Référence EOL : Acanthaster planci
Liens externes
- Chantal Conand et Loïc Charpy, « Les Acanthasters », sur http://www.com.univ-mrs.fr, IRD, ECOMAR (Univ. Réunion), (consulté le )
- Jack Harrang et François Cornu, « Acanthaster Planci », sur http://fran.cornu.free.fr, François Cornu, (consulté le )
- Chantal Conand et Florence Trentin, « L'étoile épineuse Acanthaster planci », sur http://vieoceane.free.fr, Florence Trentin, (consulté le )
Vidéos
- (en) [vidéo] Documentaire sur la couronne d'épines.
- (ja) [vidéo] Campagne de ramassage au Japon.

