Castor du Canada
Castor canadensis

Statut CITES
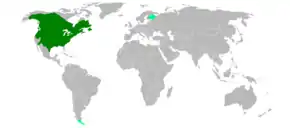
Répartition géographique
Le castor du Canada (Castor canadensis) est un grand rongeur qui vit près des cours d'eau, des lacs et des étangs en Amérique du Nord, jusqu'au nord du Mexique (où il est menacé de disparition). C'est l'une des deux espèces vivantes du genre Castor (l'autre étant C. fiber, le castor eurasien). Ses populations ont fortement régressé sous la pression de piégeage/chasse exercée par les trappeurs et il a disparu d'une grande partie de son aire de répartition, malgré les élevages qui ont été tentés pour la production de fourrure, au début du XXe siècle notamment[1].
Il est considéré comme « espèce ingénieur » ayant joué depuis plusieurs millions d'années un rôle majeur (avec les orignaux et d'autres herbivores autochtones[2]) dans la formation, la morphologie et l'entretien de nombreuses zones humides (tourbières notamment) d'Amérique du Nord[3] - [4] - [5] - [6] - [7], et notamment en zone subarctique[8]. Il joue donc aussi un rôle important en termes de cycle de l'eau, de trame bleue et de puits de carbone (les tourbières comptent en effet parmi les milieux terrestres qui stockent le plus de CO2 atmosphériques). Il a fait l'objet de nombreuses réintroductions à la fois pour retrouver une espèce longtemps disparue et de plus en plus pour son intérêt pour la biodiversité.
Origine et histoire du castor du Canada

Le castor du Canada contemporain semble avoir pour ancêtre le castor d'Europe qui aurait colonisé l'Amérique du Nord durant le Pliocène[9]. D'autres espèces, dont un castor géant, coexistaient avec lui, mais ont disparu, peut être avec l'arrivée de l'Homme.
On ignore combien de castors peuplaient l'Amérique du Nord avant l'apparition de l'Homme et avant l'arrivée des colons européens qui ont failli l'exterminer ; les estimations vont de 60 à 400 millions[10]. Selon l'explorateur et cartographe David Thompson, qui a arpenté 90 000 km en canot et à pied[11], cartographié un sixième l'Amérique du Nord[12] et parlé avec de nombreux anciens parmi les peuples autochtones qui avaient connu les castors avant l'arrivée de l'Homme blanc, toute la moitié nord du continent américain était à l'origine « possédé[e] par deux races distinctes d'êtres, l'Homme et le castor »[10]. Il occupait presque toute l'Amérique du Nord excepté les hautes montagnes, les parties sans cours d'eau des déserts et les zones colonisées par les alligators.
Cherie Westbrook, hydrologue et écologue, professeure agrégée à l'université de la Saskatchewan, estime que 85 % du linéaire de tous les cours d'eau des États-Unis (et un pourcentage comparable, mais non quantifié au Canada) sont des ruisseaux et petits cours d'eau de l'amont des bassins versants assez étroits et peu profonds pour être endigués par des castors ; il y avait selon elle des castors dans presque tous les cours d'eau d'amont d'Amérique du Nord avant la colonisation européenne[10].
Il y a eu une « ruée vers les castors » comme il y a eu une ruée vers l'or (certains coureurs des bois et autres trappeurs lui avaient donné le sobriquet de « billet poilu » (hairy banknotes)[10]). Ses peaux recherchées toujours plus loin à l'intérieur des terres (et jusque dans les quelques cours d'eau des déserts de l'Arizona, à partir de Taos au Nouveau-Mexique[13]) ont été massivement importées par des commerçants néerlandais, français et anglais et vendues sur les marchés américains. Ses populations ont ainsi rapidement décliné des années 1500 à 1850[10].
Vers 1820, George Simpson, alors gouverneur de la Compagnie de la Baie d'Hudson s'en inquiète ; de 1821 à 1850, il impose des moratoires aux piégeurs et des quotas sur certains territoires, tout en interdisant à ses agents d'acheter les peaux de jeunes castors et d'adultes tués en été (dont la fourrure avait moins de valeur)[10]. Ces mesures ont été localement utiles, mais trop limitées géographiquement pour endiguer le recul de l'animal[10]. Aux États-Unis, des trappeurs indépendants capturaient tous les castors qu'ils pouvaient. Finalement, « à l'encontre de ses propres efforts de conservation, Simpson a répondu en expansion agressive de ses opérations à l'ouest des Rocheuses, éliminant délibérément castors de certaines parties de l'Oregon et de Washington avant que ses rivaux puissent y arriver »[10].

À l'hiver 1928-1929, après des mois de recherche autour de Fort Rupert (aujourd'hui Waskaganish), les trappeurs ne peuvent ramener plus de quatre peaux de castor au poste de la Compagnie de la Baie d'Hudson, alors tenu par James Watt [14]. Watt voyant la misère affecter les Cris de la région, car ils ne peuvent plus chasser le castor pour subvenir à leurs besoins alimentaires et ne peuvent plus faire du commerce avec les peaux, décide d'acheter des huttes et de placer les castors à l'intérieur pour les protéger. À l'hiver 1930, sa femme Maud Watt se rend à Québec pour négocier avec le gouvernement provincial afin de créer une zone contrôlée de protection du castor[15]. La province accepte et Maud Watt revient à Fort Rupert avec acte de concession constituant une réserve de 18 600 m km2 2 entre la rivière Eastmain et la rivière Rupert. La trappe reprend dans la région seulement en 1940. L'initiative de protection portant fruit le gouvernement fédéral conjointement avec le gouvernement provincial et la Compagnie de la Baie d'Hudson mettent en place d'autres zones similaires[14].
Il faut attendre que le public, des associations et certains décideurs admettent la nécessité de protéger l'espèce, notamment grâce à l’immigrant anglais Archibald Belaney, anciennement trappeur dans le nord de l'Ontario et du Québec et tombé amoureux de la culture des Premières Nations et du castor, qui publie sous le pseudonyme Grey Owl des appels à respecter et protéger l'espèce. En 1928, la Direction des parcs du Dominion tourne un film muet en noir et blanc de 13 minutes, intitulé Beaver People, qui montre Grey Owl et ses deux castors apprivoisés Rawhide et Jelly Roll. C'est la première fois qu'un cinéaste professionnel fait un film sur les castors, tourné dans le milieu naturel. En 1929, Grey Owl est salarié par le Parc et accueille les touristes qui veulent découvrir le castor autrefois omniprésent et devenu rare[10].
En 1935, un premier recensement se voulant aussi exhaustif que possible est fait dans le parc national de Prince Albert ; on y trouve environ 500 castors. Alors que la population de castors se reconstitue, dès les années 1940, les responsables du parc piègent des castors qu'ils jugent en « surplus » et les délocalisent vers d'autres parcs ou propriétés publiques. En 1952, la population avoisine 15 000 individus, nombre que la direction du Parc juge trop élevé (elle réautorise les pièges mortels, avant de passer à une gestion plus bienveillante quelques années plus tard)[10].
Depuis, de très nombreuses réintroductions ont eu lieu, et l'espèce continue à recoloniser ses anciens territoires, ce qui ne se fait pas toujours sans problèmes, quand ils sont maintenant occupés par l'homme. Cette population pourrait encore être vulnérable (face à une épidémie par exemple) en raison d'une situation que les généticiens nomment goulot d'étranglement génétique. Son socle génétique est cependant plus diversifié que pour le Castor eurasiatique.
Génétique du castor du Canada
L'espèce C. fiber a été durant quelque temps confondue avec le C. canadensis[9], mais des caryotypes différents ont été révélés par les analyses génétiques[16]. L'hypothèse explicative est qu'à la suite d'une translocation robertsonienne de 8 paires de chromosomes chez le castor nord-américain, le nombre de ses chromosomes serait passé de 48 (chez C. fiber) à 40 (chez l'espèce moderne de C. canadensis. Cette fusion de chromosomes explique probablement l'absence d'hybrides entre les deux espèces là où elles cohabitent, selon Lahti et Helminen en 1974 par exemple[17].
Il y aurait aujourd'hui en Amérique du Nord 24 sous-espèces du castor improprement nommé canadensis puisqu'une population relictuelle vit encore au Mexique[18]. Cependant ces sous-espèces et leurs sous-populations ont pu être perturbées, mélangées par les nombreuses translocations et opérations de réintroductions faites depuis le début du XXe siècle.
Chez les deux espèces, au nord de leur aire de répartition, des types physiques ou une couleur de poil plus foncée pourraient correspondre à une adaptation à l'environnement paléarctique[19].
Description
Son corps massif se termine par une queue aplatie recouverte d’écailles coriaces et de quelques poils rugueux. La queue d’un castor de grande taille mesure jusqu’à 30 cm de longueur et peut atteindre 18 cm de largeur et 4 cm d’épaisseur. Le castor canadien mesure de 1 à 1,2 m pour un poids allant de 15 à 25 kg. C'est le deuxième des plus grands rongeurs d'Amérique après le capybara (que l'on trouve en Amérique du Sud).
Ses incisives, longues, solides et tranchantes, grandissent continuellement et sont durcies par une couche d’émail orange foncé qui recouvre leur face extérieure. Ainsi, à mesure que l’animal frotte ses incisives supérieures contre ses incisives inférieures, l'extrémité externe de ces dents conserve le tranchant d'un ciseau neuf.
La fourrure du castor du Canada est composée d'une bourre très fine et de poils plus longs et plus durs. Sa couleur est généralement brun foncé, quoique pouvant varier. Le pelage est brillant et imperméable, notamment grâce à une sécrétion huileuse produite par le castoréum et deux glandes anales.
Anatomie

Queue
La queue du castor est épaisse, flexible et musclée ; elle l'aide à accomplir diverses tâches, dans l’eau et la terre ferme : elle sert de gouvernail à quatre sens et d'appui sur la terre ferme lorsqu’il s’assoit ou se dresse sur ses pattes postérieures. Elle lui sert aussi à garder l’équilibre et à le supporter lorsqu’il marche sur ses pattes postérieures en transportant dans celles de devant des matériaux de construction, comme de la boue, des pierres ou des branches. Elle lui permet également de signaler la présence d'un intrus et de donner l'alarme en faisant un grand « plouf » dans l'eau, qui peut être entendu à des centaines de mètres (voir la section Communication). Elle sert enfin de réserve de graisse et d'échangeur thermique en été.
Adaptation au milieu aquatique
Outre l'imperméabilisation du pelage, le castor présente d'autres adaptations au milieu aquatique : ses yeux sont protégés par une membrane qui lui offre la possibilité de voir sous l'eau, une fine couche de graisse sous sa fourrure le protège contre le froid.
Glandes
Le castor dispose d'un système glandulaire particulier. Outre un amas de petites glandes de type prostatique présentes à la base de la vessie chez le mâle, les mâles et femelles disposent d'une grosse paire de glandes (dite castoréum, en anglais castor musk gland, parfois glande prépuciale) débouchant indépendamment l'une de l'autre dans le cloaque de l'animal et de deux glandes anales débouchant sous la queue de part et d'autre de l'ouverture urogénitale du cloaque[20]. L'appellation de « glande prépuciale » est impropre car cette glande existe aussi chez la femelle[20]. La paroi externe du castoréum est formée d'un tissu conjonctif riche en fibres musculaires qui lui donne l'apparence d'un scrotum (ce qui a probablement entretenu la confusion entre cette glande et les testicules, alors que ces derniers sont situés plus haut, derrière la membrane dite « vagina » chez le castor mâle et que ce pseudo-scrotum est aussi présent chez la femelle)[20].
Le même système de glandes existe chez C. fiber[21] mais la couleur des sécrétions (comparée aux couleurs d'un nuancier) et leur viscosité sont différentes, au point que lors d'une expérience faite en Norvège en 1999, vingt volontaires inexpérimentés ont pu différencier les deux espèces, sans erreur dans 100 % des cas (pour 46 échantillons provenant de 23 mâles et 23 femelles de C. fiber et 34 mâles et femelles de C. canadensis[21] provenant de plusieurs régions nord-américaines).
Comportement


Le castor du Canada est un rongeur terrestre, semi-aquatique, qui vit à proximité des lacs, mares et cours d'eau douce. Il n'hiberne pas, mais accumule des réserves près de son terrier (ou de sa hutte) et dort plus longtemps en hiver.
C'est un animal territorial (en grande partie nocturne s'il se sent menacé) et à l'odorat développé : il distingue olfactivement un grand nombre de composés odorants[22] qui le renseignent sur le sexe et le rang social (individus dominants ou non-dominants) d'autres castors susceptibles d'entrer sur son territoire, ainsi que sur leur prédisposition sexuelle et probablement sur certains aspects de leur état de santé[23].
Des analyses par chromatographie en phase gazeuse ont confirmé que les profils individuels de sécrétion de glandes anales ne changent presque pas dans le temps ou selon la position du castor[23], et que les variations de ce profil sont plus faibles chez un individu qu'entre plusieurs individus[23], ce qui semble faire de cette odeur l'équivalent d'une carte d'identité[23]. Il discrimine aussi les odeurs de ses prédateurs[24]. Il distingue aussi les relations de parenté via les phéromones et odeurs des autres castors[23]. Il dépose ses sécrétions odorantes sur de petits monticules de terre qu'il fabrique ou, plus rarement, sur des éléments du paysage (touffe d'herbacées, roche, sol).
La disposition de ces marques ne semblent pas correspondre à une barrière odorante, ni défendre spécifiquement certaines parties de son territoire. Il en produit moins en été et en automne. Il semble que le castor se sente rassuré quand il sent l'odeur de son « clan » familial, et inquiet quand il sent l'odeur d'un castor étranger. Il dépose plus de marques odorantes quand il y a plus d'autres familles de castors dans son environnement proche[25].
Potentiel d'invasivité (hors de son environnement naturel)
Sur un territoire dépourvu de « concurrents » et vierge de grands prédateurs, malgré une faible diversité génétique[26], il montre de bonnes capacités de reproduction (environ 100 000 individus appartenant à une dizaine de lignées, toutes issues d'une population originale introduite de 25 femelles et 25 mâles) et de colonisation (ex : 736 km de cours d'eau colonisé en 46 ans à partir d'un noyau initial[27]). En Terre de Feu (Argentine) où il a été introduit en 1946 comme source potentielle de fourrure et où il n'a aucun prédateur, il se montre même invasif (densités de 0,2 ± 5,8 colonies/km de rivière en 40 ans[27]). Il semble plus actif de ce point de vue que son cousin européen, dont la moindre performance pourrait être expliquée par le fait qu'il sort à peine d'un goulot d'étranglement génétique[28].
En Europe, là où le castor eurasiatique est confronté à la concurrence de castors canadiens introduits dans la nature ou échappés de parcs, zoos ou élevages de producteurs de fourrure, il est souvent dominé et disparait ou régresse. « La récente découverte de castors nord-américains (Castor canadensis) dans trois pays voisins de la France a soulevé une question importante. Cette espèce peut supplanter C. fiber dans les endroits où les espèces entrent en contact ». Un programme de piégeage et de suivi génétique est en cours dans certains pays pour « éradiquer cette espèce non indigène »[29] - [30].
Locomotion
Trapu et rondelet, le castor se déplace lentement sur le sol. Ce n'est pas le cas dans l’eau où il est un nageur habile et très gracieux, en plongée comme en surface. Il atteint une vitesse de près de 7 km/h s'il fuit ou est alerté. Il passe facilement 4 à 6 minutes consécutives en apnée et jusqu'à une quinzaine de minutes[31].
Construction de barrages et de retenues d'eau

La retenue, tant qu'elle est entretenue par le castor, est souvent plus riche en truites et saumons, où ils sont plus gros qu'en leur absence[32].
Le castor du Canada est connu pour construire des barrages naturels sur les cours d'eau au moyen de branches et de troncs de peupliers, de saules, d'érables et de trembles qu'il coupe avec ses incisives, mais aussi de buissons divers[33].
Selon Aeschbacher and Pilleri (1983) qui ont observé des castors canadiens construire en captivité, il travaille habituellement solitairement, sauf en cas d'incident ou accident majeur risquant de mettre en péril le barrage ou le toit de la hutte par exemple ; dans ce cas les castors d'une famille travaillent de concert, mais seulement jusqu'à ce que la réparation soit achevée[34].
Il peut fermer ses lèvres derrière les incisives et ainsi ronger des ramilles sous l’eau. Le castor canadien est capable d’abattre de gros arbres et fait des barrages plus importants et plus hauts que le castor européen (qui est pourtant parfois légèrement plus gros que lui). Le record actuel serait de 850 m, au Canada[35]. À partir de l'étang qui s'accumule en amont de son barrage, il peut creuser des tranchées larges environ de 1,5 m et profondes jusqu'à 1 mètre[36].
De nombreux castors vivent dans des tanières creusées dans les berges ; d'autres fabriquent des tanières en forme de cône, constituées de petites branches et de boue au milieu de l'eau[33]. Dans les deux cas, la partie habitable est émergée et les sorties immergées. Le barrage sert à éviter que l'habitation du castor soit inondée en cas de crue, ou les sorties exposées à l'air libre et donc aux prédateurs en cas de décrue. Pendant tout l'hiver, il sert également à assurer l'accès sous la glace à la réserve de nourriture.
Toutes les essences européennes et nord-américaines d'arbres ont coévolué avec le castor. Presque tous les arbres coupés recèpent et produiront des taillis et des racines qui continueront à stabiliser les berges, tout en laissant plus de lumière éclairer la zone du barrage, alors que les arbres coupés par les castors introduits en Amérique du Sud pour leur fourrure ne recèpent pas. Dans ce dernier cas, loin de son habitat naturel, le castor devient un déprédateur, et a des effets négatifs pour la biodiversité. Il pourrait même devenir invasif. C'est néanmoins une espèce qui sur les petits cours d'eau est très facile à piéger.
Alimentation
Il se nourrit surtout de l'écorce, et moindrement du bois et des feuilles des arbres qu'il coupe, en choisissant spécifiquement certaines essences[37], qu'il utilise aussi pour la construction de ses barrages là où doit en faire pour conserver un niveau d'eau qui lui convienne[38].
En été, il se nourrit aussi d'herbacées et de plantes aquatiques. En hiver il se nourrit en grande partie des réserves qu'il a accumulées les mois précédents (voir ci-dessous).
Communication
Le castor communique par des marqueurs physiques et par des bruits. Le long des sentiers, il sème des « galettes de boue » portant ses empreintes et un dépôt d’huile musquée qu’il sécrète. Il communique aussi par des geignements de faible intensité et par des mugissements.
Afin d’avertir les autres castors de la proximité d’un danger, il peut faire un bruit de détonation en frappant l'eau avec sa queue (voir ci-contre).
Reproduction
Les castors sont des mammifères à reproduction sexuée.
Le mâle et la femelle sont physiquement très semblables, mais présentent un comportement légèrement différent : chez les adultes, la femelle passe plus de temps à se nourrir en fin de printemps et en été, puis consacre plus de temps à se constituer des réserves alimentaires de la fin de l'été à la fin de l'automne, de même pour le temps passé à consolider la hutte et à construire des cachettes et y stocker des aliments pour la saison froide.
Inversement, les mâles mangent moins et se déplacent plus, dont dans la hutte et pour la consolider (de la fin du printemps au début de l'été). Ensuite, ils circulent moins et mangent plus, tout en consolidant la hutte.
Il semble exister un partage des tâches et celles-ci sont exécutées avec des temporalités différentes. La femelle (adulte) consacre plus de temps à s'occuper directement des petits, alors que les mâles passent du temps à les protéger et à approvisionner la famille en nourriture, à défendre le territoire de la famille et à construire et entretenir les infrastructures[39].
La maturation du jeune castor passe par trois phases distinctes[40] :
- les 4-5 premières semaines, les nouveau-nés restent dans la hutte ou le terrier. Leur maturation physique est rapide (développement de la locomotion, sevrage, apprentissage des soins à la fourrure et de certains comportements sociaux…)[40] ;
- au printemps suivant, les jeunes sortent de la hutte. Ils développent en jouant leur capacité d'apnée et explorent la partie aquatique de leur environnement proche, tout en perfectionnant leur habileté à nager, saisir des objets, etc. Aucun nouveaux comportements n'apparait durant cette phase[40] ;
- de nouveaux comportements apparaissent (dont de construction et de cueillette), préparant la dispersion des jeunes vers l'âge de 2 ans[40].
Ces trois phases sont également observées en captivité. Elles sont proches de celles observées chez d'autres rongeurs hystricomorphes à faible taux de développement[40].
Intérêt hydraulique et écologique des barrages
Les barrages de castors modifient fortement l'environnement physique, biochimique et écologique du réservoir d'eau qu'ils créent[41] - [42].
Alors que le Castor régressait rapidement en Amérique du Nord, Chateaubriand s'en inquiétait et évoquait en 1829 leur utilité hydraulique dans Voyages en Amérique : « Ces républiques [groupes de castors] comptoient autrefois cent et cent cinquante citoyens ; quelques unes étoient encore plus populeuses. On voyoit auprès de Québec un étang formé par des castors, qui suffisoit à l'usage d'un moulin à scie. Les réservoirs de ces amphibies étoient souvent utiles, en fournissant de l'eau aux pirogues qui remontoient les rivières pendant l'été. Des castors faisoient ainsi pour des sauvages, dans la nouvelle France, ce qu'un esprit ingénieux, un grand roi et un grand ministre ont fait dans l'ancienne pour des hommes policés[43]. »
Selon les études aujourd'hui disponibles, les castors et leurs barrages sont aussi globalement très favorables à la biodiversité grâce aux vastes zones humides qu’ils créent et entretiennent en amont de leurs barrages. Par exemple :
- le coléoptère Brychius hungerfordi, devenu rare en Amérique du Nord, est presque toujours associé à la zone aval des barrages de castors, et la disparition des barrages situés en amont des populations de ces coléoptères est considérée comme une menace importante pour eux[44]. On compte trois fois plus de trous d'émergence de grands Cerambycidae près des huttes ou terriers qu'ailleurs[45] ;
- les étangs créés par les castors permettent une succession de macrophytes et des ceintures nouvelles de macrophytes et de tourbières qui n'existeraient pas sans eux. Des chercheurs ont étudié les successions de macrophytes dans 36 étangs à castor du Minnesota, âgés de 4 à 40 ans, en zone de tourbière afin qu'ils soient bien isolés des autres masses d'eau, et « moins susceptibles au délavage ». Ils ont constaté que « la richesse et la diversité en espèces augmente de façon linéaire dans les étangs au cours des quatre premières décennies. L'âge de l'étang et le produit de la dimension de l'étang par le nombre d'étangs voisins dans un rayon de 250 m explique 64 %[46] de la variation dans la richesse ». Concernant la composition floristique, elle s'explique le mieux par les modes de dispersion des graines (apportées par le vent, les oiseaux ou d'autres animaux qui viennent profiter de ce nouveau point d'eau ou de la flore, faune ou fonge ou des microorganismes qu'il abrite). Dans la zone étudiée, les étangs âgés de 11 à 40 ans présentaient la plus forte diversité en macrophytes, tant pour les espèces à feuilles flottantes que submergées. Ensuite, quand l'étang est plus ancien, les nymphéas (plante consommée par les castors) se montrent plus densément présents, avec plusieurs espèces de Potamogeton. Cette étude a permis de mettre au point un « modèle de prédiction pour la succession des macrophytes dans les étangs à castors » qui pourra faciliter l'étude des processus écologiques liés aux macrophytes favorisés par les castors qui se montrent donc espèce facilitatrice autant qu'espèce-ingénieur[47] ;
- dans les cours d’eau où les castors font des barrages[48], les accumulations de sédiments et de feuilles mortes dans les quelques dizaines de mètres en amont du barrage défavorisent ou font disparaître dans cette zone certaines espèces — par exemple, les moules perlières de Louisiane (en)[49], une espèce appartenant à la super-famille Unionoidea ; par contre, les nouvelles zones inondées sont d'une productivité biologique importante et la zone de fuite du barrage continue à abriter, quoiqu'en moins grand nombre, les espèces des courants rapides ;
- on a remarqué que les grands barrages du castor du Canada sont aussi des obstacles partiels à la migration d’espèces de poissons qui sont hôtes de ces moules[50], mais on a des preuves archéopaléontologiques que ces espèces ont coexisté depuis des millions d'années (y compris depuis 10 000 ans durant l'Holocène où les mulettes, les salmonidés et les castors ont coexisté en Amérique du Nord).
Adaptation au froid

En zone boréale où il doit subir des hivers bien plus rigoureux qu'en Californie par exemple[51], le castor bénéficie de plusieurs adaptations lui permettant de supporter un important gradient thermique[52], de répondre à un besoin énergétique plus grand[53] et de mieux résister aux grands froids de l'hiver[54] : allongement de son rythme circadien en hiver[55], fourrure épaisse, thermorégulation[56] - [57], avec capacité à créer un microclimat plus favorable dans sa hutte[58], métabolisme adaptatif[59] et accumulation durant l'été[60] de réserves de graisse et de provisions lui permettant de survivre durant la saison hivernale, notamment en zone froide[61]. Ses besoins énergétiques hivernaux et sa consommation réelle de nourriture ont été longtemps méconnus. Ils ont pu être expérimentalement évalués au début des années 1990 au Canada dans un microhabitat artificiel simulant des conditions hivernales : dans ce contexte, un castor moyen passait 140,5 minutes (cumulées) dans l'eau (soit 10 % environ de chaque période de 24 h) ; il consommait chaque jour un peu plus d'un demi kilo (0,52 kg/j) de matériel ligneux, lui apportant environ 6 547 kJ/j. Le besoin énergétique métabolique hivernal a été évalué à 2,87 W/kg, soit seulement 1,7 fois le taux de base connu pour l'espèce C. canadensis. Le métabolisme d'un castor consomme 3 800 kJ/j, sans lien avec la durée cumulée d'immersion quotidienne ni avec le nombre de sorties sous l'eau. Selon ce que l'on sait de l'apport énergétique et de la digestibilité[62] des aliments provisionnés par cet animal pour l'hiver, ces réserves ne semblent pas pouvoir suffire à tous ses besoins hivernaux en énergie[63]. L'accumulation d'eau permise par ses barrages[64] joue aussi un certain rôle de tampon et d'inertie thermiques[65].
Habitat
Ces rongeurs vivent dans des cours d'eau à eaux lentes ou moyennement rapides, ou dans des plans d'eau naturels ou créés par leurs barrages, du moment qu'ils soient environnés de feuillus. Ils semblent préférer les cours d'eau à courant faible et assez profonds pour qu'ils puissent y installer en sécurité leur terrier ou une hutte. Mais en présence d'un petit cours d'eau à débit suffisant, le castor américain peut construire d'importants barrages et créer ou recréer ses propres zones humides. Ces habitats n'existeraient pas sans lui, et ils profitent à de nombreuses autres espèces (« Grâce à leurs activités de construction de barrages et au stockage subséquent de l'eau, les castors ont le potentiel de restaurer les écosystèmes riverains et de compenser certains des effets prévus du changement climatique en modulant le débit du ruissellement et des cours d'eau. »[66]. Pour ces raisons, le castor américain classé parmi les « espèces ingénieur », « clé » et « facilitatrices ». Il est réputé plus actif dans cette activité de création de nouveaux milieux que son cousin européen.
La prédation par le loup (principal prédateur) semble avoir peu d'influence sur la répartition des populations et la qualité de son habitat, de même que les activités anthropiques, tant qu'elles ne suppriment pas les arbres qui sont sa source hivernale de nourriture. L'occurrence de l'espèce « augmente toutefois dans les zones où la richesse de la classe végétale est plus élevée et où les proportions d'eau libre, de tourbière riche en éléments nutritifs et de marécage caducifolié sont plus élevées »[67]. Une étude récente (2018) dans le nord-est de la Colombie-Britannique n'a trouvé aucune preuve que le risque de prédation ou les activités industrielles réduisent la présence de castors ; bien que des changements d'abondance (nombre d'individus par km2) puissent se produire sans changements de globale de distribution de l'espèce[67].
Des modèles informatiques prédictifs de l'habitat du castor à grande échelle sont en cours de mise au point, qui aideront à prévenir des dommages que les castors peuvent faire aux infrastructures et à mieux gérer les espèces (faune, flore) qui dépendent de la présence d'étangs et barrages de castors[68].
Répartition et densité de populations


Le Castor est une « espèce facilitatrice ».
Son aire naturelle de répartition couvre presque toute l'Amérique du Nord, s'étendant de la zone péri-arctique (Canada et Alaska) au Mexique en passant par les États-Unis. Il a beaucoup régressé après l'arrivée des colons européens et avait au début du XXe siècle disparu d'une grande partie de son aire potentielle de répartition. Quelques noyaux de populations se sont établis en Europe dont certains se sont éteints et d'autres sont en croissance (voir ci-dessous).
L'animal peut être discret. C'est en hiver qu'on en repère le mieux les traces au sol, et en avion là où il construit des barrages[69]. Au Québec, l’inventaire aérien fait sur 45 000 km2 de 1989 à 1994 au sud du 50e parallèle (hors territoires des réserves à castor et ne faisant pas l’objet d’exploitation par le piégeage) a conclu à une densité moyenne de 2,3 colonies par 10 km2 (variant de 1 à 7 colonies par 10 km2 selon les sites survolés). Ce bilan a valeur d’état initial pour évaluer l’impact des politiques publiques sur le piégeage et les variations temporelles de populations de castors[70].
Introductions hors de son aire naturelle de répartition
Le castor canadien ne devrait pas être présent en Europe ni en France, mais plusieurs populations sont en Europe du Nord ou de l'est issues d'animaux introduits ou échappés d'élevages.
Quelques individus ont été introduits en Finlande[71] et ont formé des populations qui se sont localement bien développées, en repoussant le Castor européen Castor fiber.
En France, une petite population d'une vingtaine d'individus (tous issus d'au moins trois individus échappés d'un parc de vision) s'était installée entre 1975 et 1977 près de Saint-Fargeau dans l'Yonne[72], sur le réservoir du Bourdon. Étant donné la proximité de ce réservoir avec la Loire concernée par une population avérée de Castors européens et par des projets de réintroduction, afin de limiter les risques d'interactions négatives avec l'espèce autochtone (certains craignaient une pollution génétique mais ces deux espèces, bien que physiquement très proches, ne semblent pas être interfécondes), les 24 membres de cette colonie ont été capturés en 2 ans (1984-1985) et aucun autre C. canadensis n'a récemment été observé en France[73].
Réintroduction ou confortement de population
Après avoir fortement régressé au Canada et aux États-Unis, il a fait l'objet de nombreuses translocation et réintroductions, pour que l'on puisse continuer à exploiter sa fourrure et son castoréum ou pour des raisons plus écologiques, voire pour lutter contre les inondations et les incendies :
Ainsi, on a même testé (de la fin des années 1940 au début des années 1950) à assez grande échelle et avec succès des ‘parachutages de castors’ pour lutter contre les inondations dans l'Idaho, afin qu'il restaure ses petits barrages dans les petits cours d’eau forestiers[74].
L’administration de l'État a permis à Elmo W. Heter basé à McCall (Idaho) (de la direction Pêche et chasse de l’état de l’Idaho, soit "Fish and Game Dept.") d’expérimenter cette méthode originale de réintroduction ou de translocation dans des zones très boisées et éloignées des routes[75].
Auparavant, des castors avaient déjà été capturés dans des zones habitées ou cultivées où ils posaient problèmes, puis acheminés par cheval ou mule vers un camion, qui les amenait le plus près possible de la zone de relâcher, jusqu’où un nouveau voyage à dos de cheval ou mule devait être fait en pleine forêt.
Ce processus de transport était long, fastidieux et très stressant pour l’animal, notamment sur les pistes poussiéreuses et quand il faisait chaud (en été le castor a alors besoin d’être constamment rafraichi). Une part importante des castors mouraient en chemin[75].
L’idée est venue de les transporter plus rapidement « sur zone » par avion et de les parachuter précisément là où ils seraient plus utiles pour juguler les crues qui faisaient déborder les cours d’eau plus en aval des sous-bassins versant concernés, mais aussi avec un objectif de conservation des sols[75]. Elmo W. Heter qui travaillait aussi à protéger et améliorer les ressources halieutiques piscicoles semblait aussi avoir compris qu’on améliorerait au passage l’état des habitats des poissons et du gibier, deux ressources importantes pour les populations humaines éparpillées dans ces régions[75].
Différentes tailles de parachutes et plusieurs types de caisses ont été préalablement testés, lestés de manière à avoir le poids d’un ou deux castors. Le résultat le plus satisfaisant a été obtenu avec un petit parachute en rayonne de 24 pieds (provenant de surplus militaires acquis auprès du « Forest service ») apportant au sol deux castors[75]. Des cages en osier tressé ont été testées par Heter et son équipe, permettant un atterrissage souple et pouvant ensuite être rongées par les castors, mais ceux-ci les rongeaient trop rapidement et facilement pour que ce moyen convienne. Ce sont finalement des boîtes épaisses en bois qui ont été choisies[75].
Les animaux sélectionnés pour être parachutés (à partir d’une altitude de 500 à 600 pieds) étaient, autant que possible, des castors signalés par des riverains de cours d’eau comme leur posant des problèmes dans une zone habitée ou cultivée. Chaque castor était piégé par le « Gardien-trappeur régional» (Regional Caretaker-Trapper) » qui était tenu de fournir à cette fin 10 % du nombre total des castors qu’il piégeait chaque année ; ces castors étaient ainsi « relocalisés » par petits groupes (3 femelles + 1 mâle en général, ou 2 mâles + 2 femelles) vers des zones où l’administration souhaitait faire jouer les fonctions régulatrices de leurs barrages[75].
EW Hetter a constaté que les jeunes castors parachutés en juillet ou en août étaient les plus prompts à fonder une famille et à créer ou restaurer des barrages freinant et retenant l’eau ; relâchés plus tôt, ils avaient tendance à migrer plus en amont ou en aval avant de s’installer. Les sites de parachutage étaient choisis par les « Conservation Officers » du Département « Pêche et chasse » de l’état de l’Idaho en fonction des besoins jugés prioritaires pour la lutte contre les inondations en aval[75].
À titre d’exemple ; durant l'une des premières opérations, à l'automne 1948 ce sont 76 jeunes castors qui ont été déposés dans les forêts de l’Idaho, avec un seul échec (un des castors a réussi à ouvrir sa boite avant qu’elle n’ait touché le sol ; les caisses de bois percées de trous d’aération, conçues pour s’ouvrir dès leur arrivée au sol, ont été améliorées à la suite de cet accident)[75]. Selon le responsable de l’expérimentation, à la fin de 1949 toutes les réimplantations avaient été couronnées de succès. Chaque groupe de castors avait déjà construit un ou des barrages, des huttes et fait des provisions alimentaires, et ils semblaient tous prêts à fonder une famille[75]. Par la suite leur population s’est probablement stabilisée en fonction des ressources et de la prédation (Lynx, Cougar…). Au regard du coût, cette méthode s’est avérée bien plus avantageuse que le transport par le sol au travers de la forêt. Il en coûtait 2 dollars (de l’époque) pour les boîtes, $ 16.00 pour le parachute et $ 12 pour les frais de vol/carburant soit $ 30,00 par parachutage[75]. Les jeunes castors ainsi parachutés peuvent construire leur premier petit barrage en quelques mois et ainsi commencer à réguler le flux de l’eau dans des zones souvent quasi-inaccessible aux engins et aux travaux publics.
Cette méthode a été décrite en avril 1959 dans un article scientifique dans la revue The Journal of Wildlife Management (p. 143-147) par le fonctionnaire et biologiste qui l'a mise en œuvre[75] et par un court article de la revue américaine Mechanix Illustrated[76].
Remontée vers le nord
On ignore dans quelle mesure le retour du castors dans l'Arctique est due au réchauffement de ce biome et à la croissance des ligneux qui l'accompagne et/ou à la récupération de territoires perdus par le piégeage aux 18e et 19e siècles, mais plusieurs décennies de suivi satellital montre que le castor (re)gagne peu à peu des territoires arctiques[77] : Dans la taïga riche en arbres, par leurs barrages et leurs canaux, les castors stockent de l’eau en été, limitant les risques d’incendie et d’érosion (tout en contribuant en hiver à libérer un peu de CO2 et de méthane)[78].
En périphérie nordique de cette zone, c'est-à-dire dans la toundra (dépourvue d’arbres) ils peuvent, dans les zones buissonnantes; créer de nouveaux chenaux accélérant le dégel du pergélisol (or, le pergélisol planétaire est estimé contenir deux fois plus de carbone que l'atmosphère) ce qui signifie que dans ce paysage arctique, ils exacerbent localement le changement climatique[79]. Un suivi satellital de 3 bassins hydrographiques du nord-ouest de l'Alaska (de Noatak, Wulik et Kivalina) a trouvé 83 lieux d’activité potentielle de castor dont 70 avec apparition de zones humides (80 % de ces sites présentaient des barrages associés à la formation d'étangs, 9 % étaient d’origine incertaine et 11 % n'étaient pas dus aux castors) et 13 marqués par une tendance à l’assèchement (parmi ceux-ci, 31 % présentaient des signes d’activité de castors (assèchement des étangs en raison de l'abandon des barrages), 62 % n'étaient pas liés aux castors et 7 % étaient de causes indéterminées)[79]. Le long de ces chenaux créés par les castors, la forêt et les tourbières pourraient aussi gagner de l’espace vers le nord. Le castor peut contribuer à drainer ou remodeler des zones humides thermokarstiques (étendues d’eau issues de la fonte du pergélisol), produire des tourbières thermokarstiques et peut-être au développement de taliks.
Enfin l'activité des castors combinée à la dynamique du pergélisol pourrait contribuer à l’apparition ou réapparition d'habitats propices au saumon du Pacifique[79].
L'activité des castors dans la toundra peut (de manière non-linéaire) modifier ou amplifier les effets du changement climatique sur les paysages de pergélisol et conduire à des réponses écopaysagères (positives et/ou négatives) encore difficiles à anticiper et prendre en compte dans les modèles écosystémiques[79].
Maladie et potentiel zoonotique
Malgré des conditions de vie très rudes et peut être en raison de son mode de vie et de sa nourriture (les écorces contiennent de nombreuses molécules permettant à l’arbre de se défendre contre la plupart des infections) il semble assez peu vulnérable à de nombreux parasites et microbes transportés par les rongeurs terrestres ou leurs carnivores prédateurs. Il semble par exemple épargné par les Cryptosporidium spp (dans une étude ayant porté sur les fèces de 481 mammifères à fourrure capturés dans le Maryland dont 87 castors (les autres étant des renards, rats musqués, loutres et ratons-laveur), seuls 8 % étaient infectés par au moins une espèce de Cryptosporidium spp. Mais aucun des 87 castors américains de l'étude[80].
Diverses études ont recherché d’autres microbes potentiellement zoonotiques chez les castors américains ou européens. ex. : Une étude a recherché durant 3 ans chez 62 castors du Massachusetts trois groupes de parasites (Microsporidia sp, Cryptosporidium spp et Giardia sp.) : 6,4 % de ces castors se sont avérés porteurs de Protistes parasites (tous ces porteurs étaient jeunes ou subadultes) ; aucun ne portait de microsporidies, 4 portaient des Giardia spp et deux des Cryptosporidium spp (découverts pour la 1re fois à cette occasion chez des castors américains)[80] ; Chez son cousin eurasiatique une étude avait en 2004 trouvé deux sujets infectés par des Cryptosporidium (sur 19 examinés)[81].
Dans les années 1940 (avant la diffusion des stations d'épuration des eaux usées), la population de castors du nord de l'Ontario a presque disparu à cause du piégeage et d'une épidémie de tularémie (maladie zoonotique également transmissible à l'Homme)[82].
État des populations, pressions, menaces
Parmi les prédateurs naturel du castor, on trouve d'autres mammifères que l'Homme, tels que le coyote, le loup gris, le lynx, la loutre et le renard roux.
Ses dynamiques de population varient selon la richesse du milieu (y compris en prédateurs) et la pression de piégeage ou des activités humaines[83], avec des modes de gestion ou de pression sur l'espèce qui ont pu beaucoup varier dans le temps pour un même territoire[84]. En général là où il est réintroduit, la population croit lentement durant 10-15 ans, puis rapidement, puis décline et se stabilise sur le long terme[85].
Il est parfois considéré comme « nuisible » en raison des arbres qu'il endommage ou coupe et surtout à cause des barrages qu'il construit et qui peuvent localement provoquer des inondations. Sous l'égide de l'USDA et d'autorités locales, des programmes de mesures visant à concilier les activités humaines et celles du castor ont été mis en place aux États-Unis où vivent selon l'USDA[86] 6 à 12 millions de castors et environ 317 millions d'habitants[87] Lorsque ces derniers sont endommagés, s'il dispose de branches et de terre, le castor les répare efficacement, mais on sait maintenant contrôler le niveau de l'eau des barrages par des siphons silencieux (un courant de fuite et le bruit de l'eau qui coule sont deux stimuli déclenchant les travaux de surélévation ou de consolidation du barrage, mais uniquement si le castor l'associe à une situation « anormale » selon Hartman (1975)[88]).
Aujourd'hui, on estime la population des castors à 10 ou 15 millions en Amérique du Nord, mais (bien que moins que son cousin européen) il a néanmoins subi un goulot d'étranglement génétique, qu'on peut maintenant mieux évaluer[89] et « gérer » (en termes de biologie de la conservation grâce aux progrès de la biologie moléculaire (microsatellite loci[90] - [91], métabarcoding, etc.).
Le castor est parfois involontairement tué ou empoisonné à la place d'autres animaux tels que le rat musqué.
Le castor canadien a été introduit en 1946, sur la Terre de Feu en Argentine, ce qui a engendré d'importants déséquilibres dans l'écosystème local. Présent dans le parc national Tierra del Fuego, il est sujet à controverse.
Histoire
Pour les Amérindiens
Le castor (qui pouvait se piéger sous l'eau), était chassé par les Amérindiens (qui utilisaient ses dents pour fabriquer des hameçons, et le rognon supposé être un remède à large spectre (« la panacée de la forêt »[92]), et qui pouvait être conservé en vue des maladies de l'hiver[93]), et selon Rousseau (1958) chez certains Amérindiens, autrefois en hiver « A part les fruits sèches, les concrètes de bluets et la tripe-de-roche, le seul aliment végétal provenait de la panse des caribous et des orignaux, de la sauce verte de l'estomac du lièvre et de la pâtée de pulpe à demi- digérée des castors »[92] ; mais selon Chateaubriand la peau du castor, « fine sans être chaude » n'était pas considérée comme ayant de la valeur par les Amérindiens[94], et selon ce même auteur « la chair des castors ne vaut rien, de quelque manière qu'on l'apprête ; les sauvages la conservent cependant : après l'avoir fait boucaner à la fumée, ils la mangent lorsque les vivres viennent à leur manquer »[94].
La collecte et recherche par les colons blancs de peaux de castor les a poussé à pénétrer toujours plus avant les territoires amérindiens vers l’ouest et vers la forêt boréale, appuyés en cela par les expéditions et comptoirs financés par les compagnies de commerce des fourrures[92]. La peau de castor y fut un temps la première monnaie (un beaver valait une peau de castor). Les trappeurs se sont appuyés sur les Amérindiens pour tuer un nombre croissant de castors (la compagnie de la Baie d’Hudson en a vendu à elle seule près de trois millions de peaux de 1853 à 1877[92]. Dans les années 1860-1870 selon le naturaliste Thomas Seton chaque année les Indiens et les trappeurs tuaient environ un demi-million de castor au point qu'après quelques décennies, au début du XXe siècle l'espèce était presque exterminée[92].
A la fin des années 1700 et au début des années 1800, J. Tanner signale déjà chez les Ojibwa des périodes de pénurie de castor qu'il présente comme dues tantôt à la maladie et tantôt au piégeage[95].
Lewis Henry Morgan (1818-1881), jeune juriste, part explorer une partie du Midwest à partir de 1855. Il y est rapidement fasciné par le castor et la manière dont il modèle le paysage. Il constate aussi que cet animal a une grande importance pour les Amérindiens, en particulier pour les Ojibwés qui ont — précise-t-il — au moins six mots différents pour le nommer selon son aspect, son âge et son sexe, et six mots pour décrire ses constructions, et qui le chasse pour sa viande et sa fourrure, mais qui parfois aussi l'adoptent comme un enfant de la famille : dans son journal Indien, il observe, à Fort-Union, une Amérindienne en train d'allaiter un jeune castor (environ six semaines selon Morgan, qui ajoute « Ce sont d’excellents animaux de compagnie, propres et inoffensifs, ils s’apprivoisent et deviennent affectueux. J’en veux un ! ». Il cite par leur nom les personnes qui lui apportent des histoires ou témoignages et va lui-même mesurer la hauteur, longueur et profondeur des barrages de castor[92]. Là où il est il les dénombre, décrit et cartographie les territoires et ramifications des canaux creusés par les castors, il observe et récolte des bois tranchés par les dents de castor, et fait même collecter des crânes (98, p.51) parmi ceux que disposent les piégeurs autochtones sur les buissons et branches d’arbres (p. 279)[92]. En 1861 pour enregistrer des témoignages des barrages qui régressent sous la pression de piégeage du castor, il fait venir des photographes estimant qu'il « était impossible de donner même une faible représentation de ces barrages par le dessin. Seul l’art photographique pouvait rendre compte d’un sujet aussi complexe et en fixer pour l’éternité les particularités » (p. 17)[92].
Enjeux de la colonisation de l'Amérique du Nord
Mais il y a deux siècles, les iroquois considéraient la chasse au castor, dont les peaux étaient vendues aux blancs certes comme « la plus fatigante car pratiquée en hiver dans la neige et la glace », mais aussi comme « la plus lucrative »[96]. Pourchassé par les trappeurs partout où les hommes étaient présents, le castor a failli disparaître au XIXe siècle à cause de la traite des fourrures pratiquée en Amérique du Nord, notamment par des colons qui venaient alimenter le marché européen qui avait largement surexploité ses populations de castor européen. Sa fourrure était utilisée pour confectionner des vêtements et des toques. Les coureurs des bois en consommaient aussi parfois la chair.
.jpg.webp)

En Nouvelle-France, la fourrure destinée au marché européen était surtout celle du castor, lequel était très demandé en Europe, notamment, en raison de la demande de fourrure pour les chapeaux alors que le piégeage en Europe avait déjà fortement fait régresser le Castor européen.
Gestion des populations
D'après les données scientifiques disponibles pour les populations gérées (par le piégeage en général, et parfois par stérilisation) et non gérées[97] de castor, cette espèce est territoriale et adaptable, et elle stabilise sa population une fois que les territoires lui convenant sont colonisés (avec en général une zone tampon d'environ 1 km entre chaque colonie, maintenue par le marquage olfactif du castor lui-même).
Selon les écologues Müller-Schwarze & Schulte (1999) « les castors sont adaptables et ont besoin de peu de gestion par les humains ; cette gestion et le contrôle du nombre de castor découle des conflits castor-humains, et ne sont pas justifiés par les besoins des castors eux-mêmes »[97]. Cependant l'histoire récente des barrages de castors et des zones humides qu'ils créent, ou de leur réintroduction est parfois aussi une histoire de conflits sociaux ou avec certaines activités humaines, qui fait l'objet d'études[98].
Sur la base de retours d'expérience de nombreuses solutions techniques ont été développées et testées au Canada pour gérer les effets de la présence du castor (bois coupé, barrages, obturation de ponceau etc.) là où ces effets gênent les activités humaines. Ces solutions ont été réunies dans un guide technique par le ministère chargé de l'environnement[99].
Symbole du Canada
Voir Catégorie :symbole du Canada
Un symbole associé à l'histoire du développement du pays

Le castor a une valeur économique et symbolique très importante au Canada parce qu'il est associé à l'histoire du développement du pays, en particulier au commerce des fourrures à l'époque coloniale (à cette époque les peaux de castor canadien se vendaient très cher en Europe où le castor européen avait été pourchassé jusqu'à la limite de l'extinction)[100] La Compagnie de la Baie d'Hudson a ainsi fondé sa prospérité sur la trappe du castor. Aujourd'hui, grâce aux techniques de préservation de la faune, le castor, le plus gros rongeur du Canada, survit et prospère à nouveau dans une grande partie du pays[101].
Armoiries proposées par Frontenac
En 1673, le gouverneur Frontenac propose des armoiries pour la ville de Québec, mais celles-ci ne sont pas autorisées; sa proposition combine des fleurs de lys du Royaume de France, avec le castor sur un même écu, preuve que l'animal est considéré comme un important symbole canadien[102].
Commémoration de la bataille de Québec (1690)
En 1690, pour commémorer la résistance victorieuse de Frontenac à la Bataille de Québec, la médaille Kebeca Liberata (Québec libérée) est frappée : une femme assise y symbolise la France, tandis qu'un castor à ses pieds symbolise le Canada[102].
Timbres-poste et monnaie

Cet animal, reconnu comme patient et travailleur, figure sur plusieurs timbres et pièces de monnaie. Il a été confirmé comme emblème officiel du Canada le , lorsqu'une « loi portant reconnaissance du castor (castor canadensis) comme symbole de la souveraineté du Canada » reçut la sanction royale. Notons que le castor faisait déjà partie de l’identité canadienne bien avant l'adoption de cette loi.
Emblème des Canadiens-Français
_7.001_Titel-crop.jpg.webp)

Le castor est aussi un symbole des Canadiens-Français, et on le retrouve sur certaines versions du drapeau des Patriotes. En 1833, Jacques Viger, le premier maire, donne à la ville de Montréal ses armoiries. La devise Concordia Salus, Le salut par la Concorde, exprime le souhait d'une bonne entente entre les différents groupes ethniques formant le tissu démographique urbain à cette époque très troublée. Les symboles représentent: les Canadiens-Français (le castor), les Anglais, les Écossais et les Irlandais.
Mascotte officielle des Jeux olympiques
Le castor a été choisi comme mascotte officielle des Jeux olympiques de Montréal en 1976. Baptisée « Amik », qui signifie « castor » en algonquin, la mascotte est ceinturée d'une bande rouge arborant l'emblème officiel et symbolisant le ruban auquel est attachée la médaille remise aux vainqueurs[103].
Autres apparitions comme symbole
- Le castor en tant que symbole national du Canada, figure sur les pièces de monnaie de 5 cents, et sur au moins un timbre Canadien.
- Le castor est l'emblème du Royal 22e Régiment de l'armée royale canadienne.
- Il apparaît sur certains variantes du drapeau des Patriotes
- Le castor est aussi l'emblème des États américains de l'Oregon et de New York, du California Institute of Technology et du Massachusetts Institute of Technology.
Images
 Affiche des Jeux olympiques de Montréal 1976.
Affiche des Jeux olympiques de Montréal 1976. Armoiries de Montréal de 1938.
Armoiries de Montréal de 1938. Insigne du Royal 22e Régiment.
Insigne du Royal 22e Régiment.
Notes et références
- Bailey V (1922) Beaver habits, beaver control, and possibilities in beaver farming (No. 1078). US Dept. of Agriculture.
- Kay CE (1994) The impact of native ungulates and beaver on riparian communities in the Intermountain West. Natural Resources and Environmental Issues, 1(1), 6.
- Naiman R., Johnston C. & Kelley J., (1988) Alteration of North American Streams by Beaver, Biscay, 38 (II):753 - 762 (PDF, 10 pages)
- Coleman R & Dahm C (1990) Stream geomorphology : effects on periphyton standing crop and primary production, J. N. Am. Benthol. Sot., 9 : 293 - 302
- Hammerson G.A (1994), Beaver (Castor canadensis) Ecosystem Alterations, Management and Monitoring Natural Areas Journal, 14 : 44 - 57
- Gurnella.M.(1998), The hydrogeomorphological effects of beaver dam-building activity, Progressin Physical Geography, 22 (2):167-189 (PDF, 24 p)
- Aslan A. & Blum M. D. (1999), Contrasting styles of Holocene avulsion, Texas Gulf Coastal Plain. In : N.D. Smith et J.J. Rogers (eds.), Fluvial Sedimentology VI, International Association of Sedimentologists Special Publication, 28 : 193 - 209
- Woo M.K. & Waddington J.M. (1990), Effects of beaver dams on subarctic wetland hydrology, Arctic, 43 : 223 - 230 (PDF, 8 pages)
- (en) L.S. Lavrov, « Evolutionary development of the genus Castor and taxonomy of the contemporary beavers of Eurasia », Acta zoologica Fennica, no 174, , p. 87-90 (ISSN 0001-7299)
- Backhouse F (2002) Rethinking the beaver ; Has there ever been a national symbol more loathed or misunderstood? Has there ever been a more important time for the beaver to flourish? (2 pages) ; Canadian geographic
- Rupert P Un long voyage de 90 000 km, qui a commencé par un simple pas en avant: voici la vie extraordinaire de David Thompson, le plus grand géographe d’Amérique du Nord., Parks Canada
- Litalien, R., Palomino, J. F., & Vaugeois, D. (2007) La mesure d’un continent. Atlas historique de l’Amérique du Nord, 1492-1814.
- Sheridan TE (2012) Arizona: A History, Revised Edition ; University of Arizona Press, 1er février 2012 (voir p. 52/488)
- « Angels of Hudson Bay - Ottertooth », sur www.ottertooth.com (consulté le )
- « HBC Heritage — James et Maud Watt », sur www.patrimoinehbc.ca (consulté le )
- Lavrov, L.S. & Orlov, V.N. (1973) Karyotypes and taxonomy of modern beavers (Castor, Castoridae, Mammalia). Zoologische Zhurnal, 52, 734–742.
- (en) S. Lahti et M. Helminen, « The beaver Castor fiber (L.) and Castor canadensis (Kuhl) in Finland », Acta Theriologica, vol. 19, no 13, , p. 177-189 (DOI 10.4098/AT.arch.74-13)
- Mellink E a Luévano J (1998) Status of beavers (Castor canadensis) in Valle de Mexicali, Mexico. Bulletin of Southern California Academy of Sciences 97(3): 115–120
- Lavrov L. S. 1974. Morphological types of Palaearctic beavers ofCastor genus and some aspects of their taxonomy. [In: First International Theriological Congress, Moscow, 1974. Transactions, Vol. 1]. Nauka, Moscow: 344.
- Svendsen GE (1978), Castor and anal glands of the beaver (Castor canadensis). Journal of mammalogy, 59(3), 618-620. extrait (1re page)
- Rosell, F., & Sun, L. (1999). Use of anal gland secretion to distinguish the two beaver species Castor canadensis and C. fiber.
- Muller-Schwarze, D., Morehouse, L., Corradi, R., Zhao, C. H., & Silverstein, R. M. (1986). Odor images: responses of beaver to castoreum fractions. In Chemical Signals in Vertebrates 4 (p. 561-570). Springer US (résumé).
- Sun, L., & Müller‐Schwarze, D. (1998). Anal gland secretion codes for relatedness in the beaver, Castor canadensis. Ethology, 104(11), 917-927 (résumé)
- Engelhart A & Müller-Schwarze D (1995), Responses of beaver (Castor canadensis Kuhl) to predator chemicals. Journal of Chemical Ecology, 21(9), 1349-1364.
- Svendsen GE (1980) Patterns of scent-mounding in a population of beaver (Castor canadensis). Journal of chemical ecology, 6(1), 133-148 (résumé et extrait)
- Lizarralde, M. S., Bailliet, G., Poljak, S., Fasanella, M., & Giulivi, C. (2008). Assessing genetic variation and population structure of invasive North American beaver (Castor canadensis Kuhl, 1820) in Tierra del Fuego (Argentina). Biological Invasions, 10(5), 673-683.
- Lizarralde, M.S. (1993), Current status of the introduced beaver (Castor-canadensis) population in Tierra-del-Fuego, Argentina. Ambio 22, 351±58
- Saveljev, A. & Milishnikov, A. (2002) Biological and genetic peculiarities of cross-composed and aboriginal beaver populations in Russia Acta Zoologica Lituanica, 12, 397–402
- Dewas et al. 2012
- Parker, H., Nummi, P., Hartman, G., & Rosell, F. (2012) Invasive North American beaver Castor canadensis in Eurasia: a review of potential consequences and a strategy for eradication. Wildlife Biology, 18(4), 354-365.
- Castor canadensis American Beaver
- L. Lafontaine & C. Caroff (1999) http://www.reseau-loutres.org/docsliste/castimpact.pdf version française de Collen, P. (1997). Review of the potential impacts of re-introducing Eurasian beaver Castor fiber L. on the ecology and movement of native fishes, and the likely implications for current angling practices in Scotland. Scottish Natural Heritage Review , 86 : 1-53 ; traduction/adaptation : L. Lafontaine & C. Caroff - © G.M.B. 1999. Voir chap 4 http://www.reseau-loutres.org/docsliste/castimpact.pdf L. 4 : Impact de l'activité du castor sur les biocénoses aquatiques (synthèse bibliographique) in Lafontaine, L. et coll., 2000. Dispersion des populations de castors Castor fiber galliae réintroduits dans les Monts d'Arrée (Finistère).
- James Kavanagh (1994) Nature of California p. 28 Waterford Press. (ISBN 0-9640225-9-1)
- Aeschbacher A. and Pilleri G. (1983) Observations on the building behaviour of the Canadian beaver (Castor canadensis) in captivity. [In: Investigation on beavers. G. Pilleri, ed.]. Brain Anatomy Institute, Berne, 1: 83 - 98
- Photo aérienne mappée Barrage de castor considéré comme le plus long du monde, avec Google Earth
- Service canadien de la faune (1987) Le castor. Ministère des Approvisionnements et Service Canada édition, Ottawa, Environnement Canada, 6 p. (Collection La faune de l'arrière-pays) (Table GIR)
- Busher, P. 1996. “Food caching behavior of beaver (Castor canadensis): Selection and use of woody species.” American Midland Naturalist 135: 343-348
- Barnes, D. M. and A. Mallik (1996). Use of woody plants in construction of beaver dams in northern Ontario ; Canadian Journal of Zoology 74: 1781-1786.
- Buech, R (1995) Sex differences in behavior of beavers living in near-boreal lake habitat ; Canadian Journal of Zoology 73: 2133-2143 (résumé).
- Françoise Patenaude (1984) The Ontogeny of Behavior of Free-living Beavers (Castor canadensis) ; Blackwell Verlag GmbH Issue Zeitschrift für Tierpsychologie Zeitschrift für Tierpsychologie ; Vol. 66, no 1, pages 33–44, January-December 1984 DOI:10.1111/j.1439-0310.1984.tb01353.x (résumé))
- Naiman, R.J., Pinnay, G., Johnston, C.A. & Pastor, J. (1994) Beaver influences on the long-term biogeochemical characteristics of boreal forest drainage networks. Ecology, 75, 905–921.
- Naiman, R.J., Elliott, S.R., Helfield, J.M. & O’Keefe, T.C. (2000) Biophysical interactions and the structure and dynamics of riverine ecosystems: the importance of biotic feedbacks. Hydrobiologia, 410, 79–86.
- François-René Chateaubriand (vicomte de) (1829), Voyages en Amérique, en Italie, etc. Lefèvre ; 464 pages (Voir p. 105-106)
- U.S. Fish and Wildlife Service (1994) Endangered and threatened wildlife and plants; determination of endangered status for Hungerford’s crawling water beetle (Brychius hungerfordi). Federal Register, 59, 10580-10584
- Mourant, A., Lecomte, N., & Moreau, G. (2018). Indirect effects of an ecosystem engineer: how the Canadian beaver can drive the reproduction of saproxylic beetles. Journal of Zoology, 304(2), 90-97|résumé.
- (p=0,001)
- Ray, A. M., Rebertus, A. J., & Ray, H. L. (2001). Macrophyte succession in Minnesota beaver ponds. Canadian Journal of Botany, 79(4), 487-499 (résumé)
- Ils n’en font pas au travers des grandes rivières ou des grands fleuves.
- US Fish and Wildlife Service, 1993
- (en) P.D. Johnson et K.M. Brown, « Intraspecific life history variation in the threatened Louisiana pearlshell mussel, Margaritifera hembeli », Freshwater Biology, vol. 40, , p. 317–329 (lire en ligne)
- Aleksiuk, M., and Cowan, I.McT. 1969. The winter metabolic depression in Arctic beavers (Castor canadensis Kuhl) with comparisons to California beavers. Can. J. Zool. 47: 965 -979.
- Smith, D.W., Peterson, R.O., Drummer, T.D., and Sheputis, D.S. (1991) Over-winter activity and body temperature patterns in northern beavers. Can. J. Zool. 69: 2178-2182.
- Novakowski, N.S. 1967. The winter bioenergetics of a beaver population in northern latitudes. Can. J. Zool. 45: 1107 - 11 17
- Buech, R.R. 1987. Environmental relations and adaptive strategies of beavers (Castor canadensis) in a near-boreal region. Ph. D. thesis, University of Minnesota, Minneapoli
- Claude L. Potvin, Jacques Bovet (1975), Annual cycle of patterns of activity rhythms in beaver colonies (Castor canadensis) ; Journal of comparative physiology 1975, Volume 98, Issue 3, p. 243-256 (résumé)
- Coles, R.W. 1967. Thermoregulation of the beaver. Ph. D. thesis, Harvard University, Cambridge, Mass
- MacArthur, R. A., and Dyck, A. p. 1990. Aquatic thermoregulation of captive and free-ranging beavers (Castor canadensis). Can. J. Zool. 68: 2409-2416
- Dyck, A.P., and MacArthur, R.A. 1993. Seasonal variation in the microclimate and gas composition of beaver lodges in a boreal environment. J. Mammal. 74: 180 - 188
- MacArthur, R. A. 1989. Energy metabolism and thermoregulation of beaver (Castor canadensis). Can. J. Zool . 67: 65 1 - 657
- Belovsky, G.E. 1984. Summer diet optimization by beaver. Am. Midl. Nat. 111: 209-222
- Aleksiuk, M. (1970). The seasonal food regime of arctic beavers. Ecology, 264-270 (résumé)).
- Schwartz, C.C., Regelin, W.L., and Franzmann, A.W. (1988), Estimates of digestibility of birch, willow, and aspen mixtures in moose. J. Wildl. Manage. 52: 33-37
- Dyck, A. P., & MacArthur, R. A. (1993). Daily energy requirements of beaver (Castor canadensis) in a simulated winter microhabitat. Canadian journal of zoology, 71(10), 2131-2135.
- Naiman, R.J., Melillo, J.M., and Hobbie, J.E. (1986), Ecosystem alteration of boreal forest streams by beaver (Castor canadensis) ; Ecology, 67: 1254 - 1269.
- Lowry, M.M. (1993), Groundwater elevations and temperature adjacent to a beaver pond in central Oregon. thèse de l'Université de l'Oregon, PDF, 134 pages
- Dittbrenner, B. J., Pollock, M. M., Schilling, J. W., Olden, J. D., Lawler, J. J., & Torgersen, C. E. (2018). Modeling intrinsic potential for beaver (Castor canadensis) habitat to inform restoration and climate change adaptation. PloS one, 13(2), e0192538.
- Mumma, M. A., Gillingham, M. P., Johnson, C. J., & Parker, K. L. (2018). Where beavers (Castor canadensis) build: testing the influence of habitat quality, predation risk, and anthropogenic disturbance on colony occurrence. Canadian Journal of Zoology, (ja).
- Touihri, M., Labbé, J., Imbeau, L., & Darveau, M. (2018). North American Beaver (Castor canadensis Kuhl) key habitat characteristics: review of the relative effects of geomorphology, food availability and anthropogenic infrastructure. Ecoscience, 25(1), 9-23|résumé.
- Payne NF (1981) Accuracy of aerial censusing for beaver colonies in Newfoundland. The Journal of Wildlife Management, 1014-1016 (résumé)
- Lafond, R., Leblanc, Y., Pilon, C., & Société de la faune et des parcs du Québec. Direction du développement de la faune. (2003). Bilan du plan d'inventaire aérien des colonies de castors au Québec(1989-1994). [Québec]: Société de la faune et des parcs du Québec, Direction du développement de la faune, PDF, 81 p
- Castor canadensis sur le site de l'UICN (en)
- Jean-Louis Senotier, Pierre Cabard, Roger Dupuis, Jean-Pierre Jolivet, Denis Miege, « Recensement de la population de Castor d’Europe (Castor d’Europe (Castor fiber L.) de la Loire et de ses affluents en région Centre », Recherches Naturalistes en Région Centre, no 2, , p. 33-43 (ISSN 1287-3748, lire en ligne)
- selon Jean-Pierre Quéré, Henri Le Louarn in "Les rongeurs de France: Faunistique et biologie" et selon l'ONCFS
- LUCY SHERRIFF, « Why beavers were parachuted into the Idaho wilderness 73 years ago », sur nationalgeographic.com,
- Elmo W. Heter : transplanting beavers by airplane and parachute- (https://www.jstor.org/stable/3796322) The Journal of Wildlife Management. » Vol 14 no 2, avril 1959 p. 143-147
- Article d’ intitulé « Airborne Beavers Fight Floods » Des castors aérotransportés combattent les inondations, Mechanix Illustrated.
- Jones BM (2017) ; C21C-1135 Landsat time series analysis documents beaver migration into permafrost landscapes of arctic Alaska ; New Orleans Ernest N. Morial Convention Center - Poster Hall D-F ; 12 décembre
- (2017) Beavers accelerate thawing of Arctic’s permafrost | Science News, 22 décembre
- Jonse BM & al. (2017) C21C-1135: Landsat time series analysis documents beaver migration into permafrost landscapes of arctic Alaska ; New Orleans Ernest N. Morial Convention Center - Poster Hall D-F 12 décembre
- Fayer R., Santín M., Trout JM, DeStefano S, Koenen K & Kaur. (2006), “Prevalence of Microsporidia, Cryptosporidium spp., and Giardia spp. in beavers (Castor canadensis) in Massachusetts”. Journal of Zoo and Wildlife Medicine, 37(4), 492-497
- Zhou, L., R. Fayer, J. M. Trout, U. M. Ryan, F. W. Schaeffer, and L. Xiao (2004), Genotypes of Cryptosporidium species infecting fur-bearing mammals differ from those of species infecting humans. Appl. Environ. Microbiol. 70: 7574–7577.
- Beaver, Ontario Fur Managers Federation.
- Bloomquist CK (2007), Demographic characteristics and spatial organization ofunexploited beavers in southern Illinois M.S.thesis, Southern Illinois University, Carbondale
- Carillo CD, Bergman DL, Taylor JD, Viehover P et Disney M (2009) An overview of historical beaver management in Arizona. Proceedings of the Wildlife Dama ge Management Conference 13:234–242.
- Peter E. Busher & Paul J. Lyons (1999) Long-Term Population Dynamics of The North American Beaver Castor Canadensis on Quabbin Reservation, Massachusetts, and Sagehen Creek, California ; in "Beaver Protection, Management, and Utilization in Europe and North America" 1999, voi rpp 147-160 (résumé)
- "Beavers are the largest rodents in North America, and their population is estimated to be between 6 and 12 million animals", Animal and Plant Health Inspection Service ; United States Department of Agriculture
- (en) https://www.census.gov/main/www/popclock.html Current Population Clock]- U.S. Census Bureau, évaluation mise à jour chaque minute
- Hartman AM (1975) Analysis of conditions leading to the regulation of water flow by a beaver. Psychol. Rec. 25: 427 - 431
- Cornuet JM et Luikart G (1996), Description and power analysis of two tests for detecting recent population bottlenecks from allele frequency data. Genetics 144:2001–2014
- Crawford J, Liu, Z, Nelson, Nielsen C & Bloomquist C (2008), Isolation and characterization of microsatellite loci in the beaver (Castor canadensis). Molecular Ecology Resources 8:616–618 (résumé)
- Pelz-Serrano K, Munguia-Vega A, Piaggio AJ, Neubaum M, Munclinger P, Pártl A, Van Riper III C & Culver M (2009), Development of nine new microsatellite loci for the American beaver, Castor canadensis (Rodentia: Castoridae), and cross-species amplification in the European beaver, Castor fiber. Culver M. Mol Ecol Resour. 2009 Mar; 9(2):551-4. Epub 2009 Jan 31.
- Rousseau J (1958) L'Indien de la forêt boréale, élément de la formation écologique. National Museums of Canada., voir p 46
- Saillant F (1991) Le rhume et la grippe: Recettes québécoises de médecine populaire. Ethnologie française, 126-134|résumé
- François-René Chateaubriand (vicomte de) (1829), Voyages en Amérique, en Italie, etc| Lefèvre, 464 pages (voirp 105)
- J. Tanner Trente ans de captivité chez les Ojibwa [1789-1823], Pierrette Désy (éd.). Classiques uqac.ca.
- Sane AM (1801) "Tableau historique, topographique et moral, des peuples des 4 parties du monde.(etc.)" (Vol. 2). Buisson. Voir pages 410,
- Müller-Schwarze D& Schulte BA (1999) Behavioral and ecological characteristics of a “climax” population of beaver (Castor canadensis). In "Beaver protection, management, and utilization in Europe and North America" (p. 161-177). Springer US (résumé)
- Pilliod, D. S., Rohde, A. T., Charnley, S., Davee, R. R., Dunham, J. B., Gosnell, H.,... & Nash, C. (2018). Survey of Beaver-related Restoration Practices in Rangeland Streams of the Western USA. Environmental management, 61(1), 58-68|résumé.
- Guide de gestion de la déprédation du castor
- Brève histoire du Canada
- À propos du Castor canadien
- encyclopédie canadienne
- Le castor, représenté sur les rubans des jeux olympiques de Montréal.
Voir aussi
Bibliographie
- Blond G (1956) La vallée des castors, d'après le film de Walt Disney, images Milotte A et E, prod. Barraud M, Payot - Lausanne
- (en) M Dewas, J Herr, L Schley, C Angst, B Manet, P Landry et M Catusse, « Recovery and status of native and introduced beavers Castor fiber and Castor canadensis in France and neighbouring countries », Mammal Review, vol. 42(2), , p. 144-165 (lire en ligne)
- (en) Buech RR (1985) Methodologiesfor observing beavers (Castor canadensis) during theactivity period. In: BrookesRP (ed) Nocturnal Mammals. Pennsylvania StateUniversity, Pennsylvania, p. 29–34
- (en) Gallant, D., C.H. Bérubé, E. Tremblay, & L. Vasseur, « An extensive study of the foraging ecology of beavers (Castor canadensis) in relation to habitat quality », 2004, in Canadian Journal of Zoology, [lire en ligne].
- (en) Kim Long, Beavers : A Wildlife Handbook, Boulder, Johnson Books, , 182 p. (ISBN 978-1-55566-251-6, OCLC 43657168, LCCN 00035234), p. 37
- (en) Hood GA, Bayley SE (2008) The effects of high ungulate densities on foraging choices by beaver (Castor canadensis) in the mixedwood boreal forest. Can J Zool 86:484–496. doi:10.1139/Z08-029
- (en) Hood GA, Bayley SE (2009) A comparison of riparian plant community response to herbivory by beavers (Castor canadensis) and ungulates in Canada’s boreal mixed-wood forest. For Ecol Manag 259:1979–1989. doi:10.1016/j.foreco.2009.07.052
- (en) Johnston CA & Naiman RJ (1987) Boundary dynamics at the aquatic-terrestrial interface: the influence of beaver and geomorphology. Landscape Ecology, 1(1), 47-57.
- (en) King SL, Keeland BD. & Moore JL (1998), Beaver lodge distribution and damage assessments in a forested wetland ecosystem in the southern United States ; Forest Ecology and Management 108: 1-7 NA(2119)
- (en) McDowell DM, Naiman RJ (1986) Structure and function of a benthic invertebrate stream community as influenced by beaver (Castor canadensis). Oecologia 68:481–489. doi:10.1007/BF00378759
- (en) Müller-Schwarze D& Schulte BA (1999) Behavioral and ecological characteristics of a “climax” population of beaver (Castor canadensis). In Beaver protection, management, and utilization in Europe and North America (p. 161–177). Springer US (résumé).
- (en) Rosell F, Bozsér O, Collen P, Parker H (2005) Ecological impact of beavers Castor fiber and Castor canadensis and their ability to modify ecosystems. Mamm Rev 35:248–276. doi:10.1111/ j.1365-2907.2005.00067.x
- (en) Russell KR, Moorman CE, Edwards JK, Metts BS, Guynn DC (1999) Amphibian and reptile communities associated with beaver (Castor canadensis) ponds and unimpounded streams in the piedmont of South Carolina. J Freshw Ecol 14:149–158
- (en) Stevens CE, Paszkowski CA, Lee Foote A (2007) Beaver (Castor canadensis) as a surrogate species for conserving anuran amphibians on boreal streams in Alberta, Canada. Biol Conserv 134:1–13. doi:10.1016/j.biocon.2006.07.017
- (en) Golden Doug (2006) When the Beaver Was the King ; Infinity Publishing, 100 pp (avec Google book)
- Ennos A. Mills (trad. A.R. Béhuret), Dans le monde des castors, Éditions Béhuret, , 194 p..
Références taxinomiques
- (fr) Référence INPN : Castor canadensis Kuhl, 1820 (TAXREF) (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Castor canadensis Kuhl, 1820 (consulté le )
- (en) Référence Brainmuseum : Castor canadensis (consulté le )
- (en) Référence North American Mammals : Castor canadensis (consulté le )
- (fr) Référence DORIS : espèce Castor canadensis
- (en) Référence Fauna Europaea : Castor canadensis Kuhl, 1820 (consulté le )
- (en) Référence GISD : espèce Castor canadensis (consulté le )
- (fr+en) Référence ITIS : Castor canadensis Kuhl, 1820 (consulté le )
- (en) Référence Paleobiology Database : Castor canadensis Kuhl 1820 (consulté le )
- (en) Référence Animal Diversity Web : Castor canadensis (consulté le )
- (en) Référence NCBI : Castor canadensis (taxons inclus) (consulté le )
- (en) Référence UICN : espèce Castor canadensis Kuhl, 1820 (consulté le )
- (fr+en) Référence CITES : espèce Castor canadensis Kuhl, 1820 ssp. frondator Mearns, 1897 (+ répartition) (sur le site de l’UNEP-WCMC) (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
Liens externes
- (en) Écologie du castor
- (en) Wildlife Species: Castor canadensis : nombreuses données sur le site du service des forêts des États-Unis
- (fr) Le castor comme symbole national
- « Fiche d'information sur le Castor (fédération canadienne de la faune du Canada) sur hww.ca »
Vidéographie
- Grey Owl's strange Guest documentaire noir et blanc (1936) tourné dans un parc national du Canada
- Beaver Assisted Restoration (« Renaturation assistée par castors ») OPB 2010-10-28 ; (Les castors ont longtemps été pourchassés par les agriculteurs à cause de leurs barrages et modification du paysage. Maintenant des biologistes tentent de mettre ces mêmes compétences sur des terres publiques au service des saumons.) (2010), Documentaire court, produit par Ed Jahn
- Documentaire intitulé Les Ruses du castor (NatureAndDiscovery), 47 min
