Barrage de castors
Un barrage de castors est un barrage naturel, construit en travers d'un petit cours d'eau par des castors. Il lui permet de conserver de l'eau en été et de protéger son gîte contre les prédateurs (coyotes, loups, ours, cougars, gloutons, lynx, loutres), et aussi de garantir un accès facile aux provisions de branches stockées sous l'eau comme réserve hivernale de nourriture.



Ces structures, dont on peut trouver des traces fossiles[1] - [2], modifient depuis des millions d'années l'environnement naturel et comptent parmi les processus clés des écosystèmes alluviaux et forestiers de l'hémisphère nord. Le castor augmente ainsi le nombre, la proportion et la taille des zones humides, des eaux libres et du linéaire de berge. Il crée des zones de sédimentation et de puits de carbone. Il augmente la proportion des zones humides et d'eau libre dans le paysage forestier et alluvial. Il complexifie la forme des petits cours d'eau, la composition et la répartition de la faune des cours d'eau et de la végétation alluviale ainsi que les cycles biogéochimiques des éléments nutritifs. Il améliore la recharge des nappes, la qualité de l'eau. Il limite la fréquence, la gravité et la durée des incendies de forêt et des crues et ses barrages filtrent les sédiments (qui pourraient en aval colmater les frayères). En été, grâce à l'eau mieux accumulée en hiver, les mares de castors soutiennent les étiages. Les barrages favorisent ainsi de nombreuses espèces (poissons dont salmonidés, amphibiens, mammifères, oiseaux d'eau, invertébrés et plantes aquatiques et palustres notamment), en enrichissant l'écosystème global. Ceci fait du castor une espèce facilitatrice et « clé de voûte »[3].
Les petits barrages sont étroits et souvent en grande partie faits de terre, alors que les grands barrages sont solidement construits avec une large base, des morceaux de bois plus solides et un sommet habituellement incliné vers l'amont pour résister à la force du courant. Les castors y travaillent surtout de nuit, portant boue et pierres et pouvant tracter de gros morceaux de bois en s'aidant de leurs dents. Ils cherchent à réparer leur barrage principal dès qu'il se dégrade, puis entretiennent les barrages secondaires quand ils existent.
Le paysage, sa géologie et la quantité d'eau présente en été ou en hiver ont une grande influence sur le fait que le castor construira ou non un barrage : le castor ne fait pas de barrage là où la hauteur d'eau lui suffit (sur le cours moyen et aval de la Loire par exemple en France), et bien entendu pas là où il n'y a ni forêts ni zones buissonneuses denses sur les berges.
Différences entre barrages de castors eurasiens et américains
Le castor d'Europe et le castor du Canada sont très proches pour la plupart de leurs comportements et de leurs effets environnementaux, mais ils n'ont pas tout à fait la même activité de constructeurs :
- Le castor du Canada construit des barrages plutôt plus hauts et plus longs que son homologue eurasien[4].
- Plus de castors sont constructeurs de barrages en Amérique. Les études comparatives disent que le castor eurasien fait des barrages moins nombreux et moins imposants que son parent américain, mais que leurs effets environnementaux sont qualitativement comparables[5].
Barrages des castors du Canada introduits en Europe
C'est de même là où le castor du Canada a été introduit en Europe ; ainsi dans le nord-ouest de la Russie où les deux espèces cohabitent depuis plusieurs décennies, Danilov, spécialiste russe du castor, a évalué dans les années 1980 que 66,3 % des colonies de castors nord-américains avaient fait un ou plusieurs barrages, contre seulement 45,2 % pour les castors européens. Ces derniers semblent dans cette région préférer vivre dans des huttes (dans 75 % des cas) et dans des terriers sous berge (dans 25 % des cas). Danilov a aussi montré en 1995 que dans le nord-ouest de la Russie, plus on est au nord, moins le castor eurasien est constructeur : près de la moitié des castors édifient des huttes dans la zone méridionale du nord-ouest de la Russie (régions de Pskov et de Novgorod, 58°N), contre seulement 10 % au nord (réserve de Laponie)[6].
Localisation, forme et profondeur des barrages

.svg.png.webp)
Le castor ne fait pas toujours de barrage. Par exemple, en 1999 en Lituanie où plus de 23 500 castors avaient recolonisé environ 5900 sites lacustres ou de rivière[8]) dans les plaines sableuses ou tourbeuses le castor a préféré s'installer sur des rives de lacs (60 % des individus recensés, dont 83 % vivent dans des huttes) alors que dans les hautes terres vallonnées et morainiques aux paysages plus ouverts il a presque toujours choisi les cours d'eau (88 %) où il fait des barrages ou le plus souvent (75 % des cas) et vit dans un terrier-hutte ou un terrier profond[8].
De manière générale, ses barrages sont construits en tête de bassin et dans certaines petites plaines alluviales étroites, là où l'eau risque de manquer en été, presque toujours près d'une saulaie ou d'une ripisylve, et dans des zones où de la terre (ou de la tourbe) est présente. Les barrages sont donc plus communs quand on se rapproche des sources et absents des grands fleuves et de l'aval des grandes rivières.
La largeur du barrage, et sa hauteur sont principalement influencées par la configuration du paysage, et la profondeur et largeur du cours d'eau[9].
Le castor, après avoir fait remonter le niveau de l'eau dans le lit mineur, peut ensuite allonger son barrage dans le lit majeur de manière à étendre la pièce d'eau. Quand la famille s'agrandit, le barrage peut être rehaussé.
Certains barrages sont maintenus au même endroit durant des décennies de génération en génération, et d'autres sont plus ou moins provisoires, pouvant être reconstruits un peu plus en amont ou en aval dans les années suivantes. Cette hétérogénéité spatiotemporelle est favorable à la biodiversité du cours d'eau et des ripisylves (permettant notamment aux espèces pionnières de trouver des habitats à (re)coloniser).
En Europe
Une étude suédoise a porté sur la largeur et profondeur du cours d'eau dans la retenue de 74 barrages de castors, et sur la profondeur de l'eau près de 39 huttes de castors construites sans barrages. La profondeur moyenne était de 1,16 m (variant de 55 centimètres à 2 mètres) devant les huttes seules, contre 36 cm en moyenne dans les barrages (de 10 cm à 0,85 mètre). Les huttes sans barrage étaient toujours construites sur des cours d'eau larges (11,15 m en moyenne, allant de 1 m à 40 m) alors que les huttes associées à un barrage étaient construites sur de petits cours d'eau (2,5 m en moyenne, allant de simples ruisseaux de 50 cm de large à des rivières de 6 m de large) ; une analyse discriminante a correctement classé 93 % des sites comme huttes seules ou associées à un barrage .
Le castor sait aussi profiter d'opportunités telles qu'un arbre spontanément tombé en travers d'un ruisseau. Il peut alors en faire l'ossature principale de son futur barrage (c'est un phénomène par exemple décrit (et photographié[10]) pour l'un des barrages construits dans le lit mineur de la Lienne en Belgique.
À titre d'exemple, en Bretagne (Ouest de la France), le barrage de castor le plus haut mesuré depuis la réintroduction du castor à l'an 2000 était de 1,10 m, mais ce sont jusqu'à 28 petits barrages qui étaient en place l'été 1996 sur 1 255 mètres de ruisseau sur l'Elez dans les Monts d'Arrée (ruisseau de Margily) ; soit un barrage en moyenne tous les 46 mètres[11].
En Amérique
La hauteur moyenne d'un barrage au Canada est d'environ 1,8 mètre, avec une profondeur moyenne de l'eau derrière le barrage de 1,2 à 1,8 mètre. L'épaisseur du barrage est souvent autour de 1,5 mètre ou plus. La longueur dépend de la topographie locale (qui « contrôle » la largeur et forme du cours d'eau), mais est en moyenne d'environ 4,5 mètres de long.
Records
- Records de taille : les plus grands barrages sont trouvés au Canada (parfois exceptionnellement longs et plus hauts que les autres, et bien plus que leurs homologues eurasiens).
Un record est un barrage qui en environ 30 ans a atteint plus de 850 m de long, dans la plaine boréale du parc national Wood Buffalo, au Canada (où un barrage sur 1000 seulement dépasse 500 m). Le précédent record était de 652 m, dans le Montana, près de la frontière avec l'Alberta aux États-Unis[12] - [13]. - Records de hauteur : un record (5 m de hauteur environ) a été décrit dans une forêt du Wyoming (ailleurs les barrages dépassent rarement 2 m) et même moins que ça en Eurasie.
- Records en quantités de barrage par km de rivière : dans les zones protégés du grand nord canadien, on trouve encore localement en zone protégée des fréquences de 8,6 à 16 barrages par km de rivière (par exemple au Québec en la limite nord de la région du golfe du Saint-Laurent), et même plus de 5 barrages par 200 m de rivière dans le Waterton-Glacier International Peace Park, comme l’ont montré Naiman & al; en 1988, (cités par les travaux de David R Butler sur la capacité du castor à construire et entretenir de vastes zones humides et à remodeler les paysages grâce à ses barrages)[14].
Séries de barrages en escalier
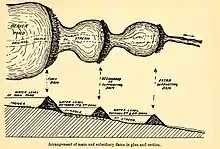
C. fiber peut aussi comme son homologue canadien créer des séries de barrage en escalier (Zurowski en 1989 rapporte le cas d'une famille de castors ayant construit sur 1,3 km de cours d'eau 24 barrages (de 1,50 m à 60 m de long, et ayant accru la colonne d'eau de 20 cm à 1,50 m selon les cas). Des séries de plus de 10 barrages ont aussi décrits par d'autres auteurs (ex : Medwecka-Korna's & Hawro en Pologne en 1993[15] et F. Rosell & Parker en 1995 en Norvège[16]). Des travaux moins spectaculaires mais aux effets comparables sont décrits par de nombreux auteurs dont par exemple par Curry-Lindahl, en Suède en 1967[17]; Myrberget en Norvège en 1967[18]; Zharkov & Sokolov en 1967en URSS[19] ; Wilsson en 1971[20] et Richard en 1983[21].
Construction du barrage


Le castor ne s'installe que dans un endroit où il y a toujours au moins 60 cm d'eau ou là où, grâce à un barrage, il peut maintenir un niveau d'eau minimum de 0,6 à 0,9 mètre, d'une part pour empêcher que l'entrée sous-marine de sa hutte ou de son terrier soit hors d'eau en été, et d'autre part pour éviter qu'elle ne soit bloquée par les glaces dans les régions aux hivers froids. Si l'eau n'est pas assez profonde, les castors construisent un barrage pour remonter son niveau, il peut faire de quelques centimètres à plus d'un mètre de hauteur et souvent jusqu'à plus de 2 mètres au Canada. Si le courant est trop fort pour les castors, ils peuvent en détourner provisoirement le flux pour réduire la pression d'écoulement de l'eau.
Les petits barrages (de quelques centimètres) peuvent n'être fait que de tourbes et de branchettes, mais les grands barrages sont construits de manière organisée : des branches et petits rondins sont enfoncés dans la boue du lit du cours d'eau pour former une base. Ensuite, des branches mortes ou fraichement coupées sont apportées et plus ou moins entrelacées, avec parfois des pierres plates (s'il y en a à proximité). Puis les interstices sont soigneusement colmatés par des pierres, de la boue, de la tourbe, des touffes de racines, des feuilles, des plantes pour construire la superstructure.
Les castors adaptent le type de construction du barrage et leur façon de le construire aux ressources naturelles disponibles, mais aussi au contexte hydrographique et notamment à la vitesse du courant :
- Dans un cours d'eau lent, ils construisent un barrage droit ;
- Dans une zone à courant plus rapide, ils lui donnent une forme plus courbe ; de même si le niveau de l'eau est élevé.
Un ou plusieurs déversoirs sont construits au sommet du barrage et entretenus de manière qu'il ne devienne pas une brèche dans le barrage. Ils sont aussi utiles au castor lorsqu'il faut descendre sur la face aval du barrage pour l'inspecter et, si besoin est, le réparer. Ces passages font souvent également office de passe à poisson.
En terrain plat, certains plans d'eau créés par le castor couvrent plusieurs hectares. Sur les terrains en pente, ils sont plus petits, mais plusieurs plans d'eau peuvent se succéder « en escalier » là où il n'existait qu'un ruisseau, éventuellement à sec plusieurs mois par an en été.
Quand une famille s'installe, elle cherche à construire sa hutte près d'un segment du barrage assez haut pour garantir une bonne profondeur à l'entrée de la future hutte. Arthur Radclyffe Dugmore (en), observateur passionné du castor notait en 1914 dans son livre « The Romance of the Beaver[22] » que le castor sait aussi profiter du courant et des contre-courants (pour faire moins d'effort pour apporter son bois de construction ou entrer ou sortir de sa hutte)[23].
Résistance du barrage


Un barrage actif (c'est-à-dire entretenu) ou non (« barrage abandonné ») est confronté à quatre principaux facteurs de perte d'intégrité ou pouvant causer sa destruction (plus ou moins vite et fortement selon le contexte climatique et paysager).
- les crues[24], plus ou moins selon le débit maximum de crue, la brutalité et la durée de la crue (et selon les matériaux utilisés pour faire le barrage[24]) ;
- la pression de l'eau (d'autant plus élevée que la hauteur d'eau retenue est grande) ;
- le vieillissement naturel (le bois dur et écorcé y pourrit relativement lentement car les interstices sont colmatés par de la terre à la construction puis au fur et à mesure qu'ils se forment, mais le petit bois, les rhizomes de roseaux s'y dégradent plus rapidement[24]) ;
- la glace (au moment de la débâcle dans les régions froides) et le gel.
Ruptures de barrages : Les ruptures franches sont rares, survenant souvent à l'occasion d'une crue. Si la rupture est brutale et que le barrage était haut, l'onde de crue est amplifiée dans la section située à l'aval du barrage, jusqu'à ce qu'un équilibre soit retrouvé (après la vidange partielle du réservoir)[25]. Un « effet domino » sur un ou plusieurs barrages en aval est parfois constaté.
Par exemple dans une région du désert de Sonora dans le centre-ouest de l'Arizona où les crues peuvent être violentes, une étude américaine[24] a porté durant la décennie 2000-2010 sur les phénomènes de résistance, dégradation ou de rupture de barrage (pour un ensemble de plus de 80 barrages (suivis durant 7 ans et sur 58 km de cours d'eau). Le suivi a été fait par photos aériennes et survol héliporté et/ou au sol, et en mesurant aussi les liens entre barrage et vitesse du courant et la longueur de l'étang (déterminée par la mesure de la limite lentique-lotique en amont ; sous 0,2 m/s le système passe du lotique au lentique).
Trois « crues expérimentales » ont été libérées à partir d'un barrage de retenue d'eau proche (le barrage d'Alamo) afin de mesurer l'effet sur les barrages de castors de crues intenses à violentes (avec des débits de pointe allant de 37 à 65 m3 s−1). Un délai de 11 mois entre chaque expérience laissait aux castors le temps de réparer leurs aménagements[24].
Ces crues artificielles ont effectivement induit (sur environ 20 % des barrages contrôlés) des dommages importants (c'est-à-dire une brèche de plus de 3 m de large au sommet du barrage et allant jusqu'à la destruction totale du barrage) et une proportion similaire ou supérieure de barrage a été légèrement endommagé. Malgré cela les barrages ont fortement lissé l'effet de la crue[24]. En général les trois ou quatre premiers barrages subissant de tels fronts de crue sont balayés ou gravement endommagés, et les suivants y résistent mieux (avec néanmoins une vidange de l'étang du castor parfois), mais pouvant être assez rapidement réparés. Lors de la crue provoquée la plus violente (65 m3 s−1), 9 barrages ont cédé ou ont été gravement endommagés, et deux cas particuliers ont été signalés : deux barrages essentiellement construites en rhizomes de roseaux (typha sp.) enchevêtrés ont été poussés vers l'aval d'une seule pièce par la crue[24]. L'eau est passée au-dessus d'une trentaine d'autres barrages sans destructions majeures.
Les chercheurs n'ont détecté ni relation entre la taille du barrage et la gravité des dommages, ni un seuil de débit de crue au-dessus duquel des dommages importants seraient systématiques. Associé à l'ampleur et la brutalité de la crue, le facteur le plus explicatif ou prédictif des dommages seraient les matériaux constitutifs du barrage[24]. Dans cette zone désertique où les crues peuvent être subites et violentes, les zones d'habitat lentique créées par le castor seront donc périodiquement perturbées[24]. Dans des situations similaires ou des contextes anthropisés ou de gestion de la nature, les auteurs jugent qu'examiner à la fois les conséquences désirables et indésirables de l'ingénierie écologique assistée par le castor est important chaque fois qu'on souhaite optimiser les flux environnementaux pour atteindre des objectifs à la fois écologiques et socio-économiques[24].
Effets environnementaux et écologiques
Importance surfacique des effets

Il existe des effets physicochimiques et écologiques, immédiats et différés, qu'on peut observer dans le temps, mais aussi dans l'espace et le paysage.
Certains effets directs sont facilement mesurables (sur photo aérienne par exemple pour la surface en eau). Les effets indirects et de moyen et long termes sont nombreux et importants (par exemple recharge de nappe améliorée, avec remontée de sources et de niveau piézométrique) mais plus difficile à quantifier.
Tous ces effets varient en outre selon les contextes géomorphologiques et écologiques, l'agrandissement des surfaces en eau étant parfois discret, parfois spectaculaires (en plaine dans la zone des ruisseaux et petites rivières). Ainsi :
- dans un secteur de 250 km2 de la Péninsule de Kabetogame (Minnesota), le retour des castors s'est traduit par une restauration de la surface de plan d'eau permanent (passés de 1 à 13 % de la zone) avec une stabilisation quand la densité de population a atteint environ une famille par km2[26].
- Au Québec là où les populations de castors se sont reconstituées, 30 à 50 % du linéaire des cours d'eau d'ordre 2 à 4 (larges de 1 à 10 m) en ont été modifiés[27]
- Inversement, dans le sud de la Norvège le castor a été réimplanté dans une région de 3500 hectares de forêt essentiellement résineuse. Bien que densément présent, il y est surtout constructeur de terriers et huttes-terrier et n'a inondé que 0,2 % seulement de la surface[28].
En amont des vallées et micro-vallées encaissées boisées, une succession de petits barrages étroits suffit au castor pour retenir une quantité importante et suffisante d'eau, mais en plaine un barrage moins haut inondera une surface bien plus importante (Johnston & Naiman, 1987).
Effets hydrographiques

Chaque barrage a un effet hydrographique local, mais aussi sur l'amont et l'aval. Là où il y a peu d'eau en été, le castor construit fréquemment non pas un seul barrage, mais une succession de barrages, ce qui donne au cours d'eau qu'il aménage un profil typiquement «en escalier». Ce faisant le castor augmente considérablement à la fois la surface totale du cours d'eau, sa profondeur et donc son volume global d'eau (sous réserve que l'eau ne soit pas turbide au point d'apporter assez de sédiment pour combler les étangs créés par le castor)[29]. Le castor était autrefois présent à haute altitude et en zone froide, et il l'est encore ou à nouveau localement, comme dans le Glacier National Park des Rocky Mountains dans le Montana où les effets hydrogéomorphologiques de ses barrages ont été clairement démontrés en 1999 par deux géographes (Meentemeyer et Butler[30] - [31]) ; David R. Butler fait même du castor un archétype ou une espèce modèle d'intérêt pédagogique en matière d'espèce animale facteur de changement « biogéomorphique » ; il recommande aux enseignants d'intégrer l'étude des effets du castor dans le cadre des exercices donnés aux étudiants[25].
Les barrages allongent et complexifient les profils en large et en long du cours d'eau ; les écotones « eau-susbstrat » et linéaire « eau-forêt » (habitats rivulaires) en sont notamment très fortement enrichis[32]. Une partie significative de l'eau stockée dans les chaines d'étangs (et dans les petits canaux de castors) est évaporée et évapotranspirée[33], mais en partie réappropriée (et recyclée) par l'écosystème via les eaux météoritiques (brumes, pluies, givres et rosées) et avec un bilan annuel positif grâce à une compensation de l'évapotranspiration par un meilleur stockage/infiltration de l'eau lors des périodes de crue[34] (là où les barrages restent fonctionnels)[35].
L'élévation du niveau de l'eau, de la nappe et le lissage de la « lame d'eau » dans le bassin ou en amont de chaque barrage a plusieurs conséquences hydrographiques remarquables, dont :
- une forte augmentation importante de la surface totale toujours en eau (surtout en plaine ; un peu en situation de ravin) ;
- une forte augmentation du volume total d'eau de l'amont de la rivière et de ses annexes hydrauliques ;
- une modification du ratio volume/surface (plus ou moins importante selon le contexte géomorphologique) ;
- une modification des débits de pointes et d'étiage (dans le sens d'un effet-tampon et d'inertie) ; Les barrages diminuent le débit maximal de crue, retardent le moment du pic de crue, et ils « étalent » la crue en surface et dans le temps. La temporisation et l'atténuation de l'écoulement du volume d'eau diminuent ainsi à la fois les risques d'inondation et d'érosion des berges ou du fond[36]. De manière générale, les barrages des zones amont (où les pentes sont plus fortes) atténuent davantage l'énergie cinétique du flux d'eau que les barrages de plaines alluviale plaine[29]. Un unique barrage de castor a un impact modeste et relativement momentané sur l'écoulement, mais une série de barrages sur plusieurs cours d'eau situés en amont d'un bassin versant peuvent avoir un effet très significatif[37] surtout spectaculaire durant la crue et d'étiage. En particulier, ils atténuent les effets érosifs des crues[38] - [39] ;
- une augmentation de l'eau (eau biodisponible et dans les nappes superficielles) en été et fin d'été : Duncan a montré en 1984 en Oregon que plus de 30 % de l'eau présente en saison sèche l'est dans les réservoirs créés par les barrages de castors[40]. Dans l'amont de certains cours d'eau permanents, sans les castors, il n'aurait parfois plus d'eau du tout en été ou en période de sécheresse[41] - [42]. Selon Parker (1986) les barrages en série augmentent notamment le débit des cours d'eau en fin d'été[39] ;
- une recharge plus rapide et efficace de la nappe (sauf si le substrat est totalement imperméable) ;
- un effet consécutif à la recharge de la nappe est l'accroissement de l'importance et de la durée et du volume des résurgences et du niveau et du débit de celles des sources proches ou de l'aval qui sont alimentées par la nappe en lien avec le cours d'eau[29], au profit notamment de la forêt riveraine, ce qui fait aussi dire à Bergstrom (en 1985) que les forestiers américains redécouvrent dans le castor une ressource naturelle[43] ;
Effets sédimentologiques et géomorphologiques
Chaque barrage a un effet sur la sédimentation locale et globale : les matières en suspension se déposent en amont du barrage au fur et à mesure que le courant est ralenti et selon leur poids. Il y a donc moins de matière et suspension juste en aval du barrage (provisoirement quand le barrage est temporaire). Naiman et al. (1988) ont montré que des barrages de taille modestes peuvent déjà retenir de 2 000 à 6 500 m 3 de sédiments, voire plus[44]. Le barrage de castors peut ainsi réduire l'incision fluviale dans les zones soumises à érosion régressive du lit[38] - [36]
Or, des millions d'étangs de castors et de barrages existaient en Amérique du Nord avant l'arrivée des colons européens. De même en Eurasie il y a plus de 1000 ans. Après chaque glaciation les castors sont remontés vers le nord, piégeant dans leurs retenues de grandes quantités de sédiments fins et grossiers, freinant le transit sédimentaire.
Quelques données paléontologiques attestent de l'accumulation inexpliquée d'importantes quantité de lœss dans des environnements très forestiers (d'après les analyses polliniques) et au moins dans un cas en présence de restes de castor[45]. Dans ce cas (couches du Villafranchien du bassin de l'Isère à Saint-Vallier), deux couches de lœss semblent s'être accumulées dans un environnement riche en arbres (dont cèdres rares en France à cette époque)[46]). Les lœss ne sont pas supposés se déposer en forêt, mais dans de grands espaces ouverts (où l'on devrait donc trouver des pollens de toundra et de steppe), bien que des indices de forêts-galeries ou de zones de forêts claires soient cités par divers auteurs (Bastin en 1971[47], Frenzel en 1964[48] ; Girard-Tamain en 1965[49] ; Leroi-Gourhan en 1967[50]. Au total des centaines de milliards de mètres cubes de sédiments ont été piégés par les barrages et mares de castors sur chacun des deux continents de l'hémisphère nord[51]. Sans ces barrages, ces sédiments auraient été en grande partie emportés par les rivières et les fleuves jusqu'à l'océan. Les castors ont contribué à modeler les paysages hormis ceux qui leur étaient inaccessibles car recouverts par les glaces[51].
Le recul des castors (il y a plus de 1000 ans en Europe, et du XVIe au XIXe siècles en Amérique du Nord) a eu pour conséquence d'assécher de vastes zones humides[51], en relançant les processus d'érosion et les risques d'incendies de forêt et l'érosion hydrique et éolienne, tout en libérant d'importantes quantités de sédiments dans les fleuves, ce qui a dû contribuer à augmenter leur turbidité, ainsi qu'à l'envasement des estuaires et à accroître le phénomène de bouchon vaseux de certains estuaires.
La nature physicochimique et la granulométrie du sédiment du barrage : elle reflètent la nature géologique du substratum située en amont du barrage.
Dans les régions montagneuses on y trouve des galets, cailloux ou graviers, alors que dans une tourbière, il s'agira d'un sédiment fin et noir.
Le sédiment est aussi saisonnièrement influencé par la composition et la nature de la végétation rivulaire (feuilles mortes, aiguilles de résineux, pollens, fleurs tombées, etc.).
Le castor recherchant une zone dont le sol est assez facile à creuser, on y trouve souvent dans son étang un sédiment sablo-limoneux, qu'il pourra en partie réutiliser pour colmater son barrage.
Effets géomorphologiques
L'érosion du fond et des berges par l'eau dépend du degré de pente, du climat et de la fragilité/dureté du substrat.
Depuis des millions d'années dans les sections de l'amont de cours d'eau concernées par un important transit sédimentaire (actif dès le niveau des sources parfois ; sous les glaciers notamment[30]), quand le castor est présent et qu'il dispose d'assez de bois pour faire des barrages, ses réservoirs peuvent piéger et répartir (sur une surface bien plus large qu'en leur absence) des quantités importantes de sédiments.
La profondeur et le volume de sédiments piégés augmentent considérablement avec l'âge de la retenue. Les barrages de castors diminuent aussi la vitesse du flux et donc sa puissance érosive en aval (de chaque barrage). Il a été montré[30] que plus un barrage est grand et ancien (deux paramètres souvent liés), plus il réduit efficacement la vitesse du courant et mieux il piège les sédiments. Trois barrages anciens étudiés par Meentemeyer[30] ont suffi à empêcher le transfert des sédiments en aval, en filtrant et redistribuant l'eau de manière hyporhéique[30], ce qui fait classer le castor parmi les espèces actives dans le domaine de la « biogéomorphologie ». À l'échelle d'une rivière ou d'un basin, l'importance de l'atténuation de l'énergie de flux dépend aussi du nombre de barrages et de la distance qui les sépare. Le bilan global en termes de degré de réduction du potentiel érosif de l'eau (sous-chargée relativement à ce qu'elle serait en l'absence de castor) en aval de chaque barrage est difficile à quantifier précisément, mais il existe maintenant un consensus pour reconnaître au castor - là où il est présent ou de retour - un rôle important dans la (re)configuration des paysages[30], même en quelques années ou décennies après son retour (comme en Wallonie[52]).
Même en quelques années ou dizaines d'années après le retour des castors là où ils avaient disparu, un barrage ralentit considérablement la vitesse de progression de la charge de fond, y compris pour des sédiments fins ; ainsi en Wallonie, les castors dans les secteurs où ils sont récemment réapparus ont pu piéger jusqu'à 8 t/km²/an de sédiment, soit 10 fois ce qu'était le transport de charge de fond avant leur retour. Au cours des siècles et millénaires, le castor peut ainsi créer de véritables plaines alluviales où il allonge de plus considérablement le linéaire de berge et de petits cours d'eau anastomosés[53].
Effets sur l'absorption du CO2
Le stockage du carbone dans les zones alluviales est l’une des formes majeures de puits de carbone. Il fut autrefois à l'origine du charbon, et de la plupart des tourbières et des riches sols alluviaux.
Le volume de carbone ainsi stocké dans le lit mineur ou majeur et ses annexes hydrauliques n'avait jamais été mesuré avant 2012. Au vu des premières données, il s'avère important. Il a été quantifié dans divers types de vallées d'une zone peu anthropisée (en amont du Parc national de Rocky Mountain aux États-Unis)[54]. Les résultats (publiés fin 2012 dans la revue Nature) montrent que dans la partie haute et alluviale des bassins versants, les aménagements faits par les castors sont de loin les meilleurs puits de carbone des cours d'eau, de leurs annexes hydrauliques et de la zone alluviale[54]. Dans cette région riche en forêt ancienne, le castor n'est présent que sur moins d'1/4 du linéaire de rivière, mais ce seul segments contenait 75 % de tout le carbone stocké dans le lit majeur et mineur. Il s'agit essentiellement de sédiments accumulé par les barrages et de bois mort coupé ou accumulé par le castor. Selon Ellen Wohl et ses collègues, les changements historiques dans la complexité des cours d’eau, notamment lié au recul du castor ont probablement significativement réduit le stockage du carbone[54] dans l'hémisphère nord.
Comme les zones humides restaurées par le castor atténuent aussi les chocs thermiques (par leur évapotranspiration intense et leur inertie thermique), et qu'elles diminuent les risques d’incendies de forêt et d’érosion, le retour du castor pourrait donc aussi contribuer à la lutte contre le réchauffement climatique, au profit notamment des espèces appréciant les eaux fraiches (salmonidés).
Effets écopaysagers


Là où le castor construit des barrages, il modifie profondément et rapidement le cours d'eau mais plus largement le paysage et l'écologie du paysage. Il a selon les scientifiques un effet rapide d'enrichissement de la biodiversité et de la biomasse animale et végétale[52] ; ce pourquoi le castor est classé espèce ingénieur mais aussi comme « espèce facilitatrice » et une espèce ombrelle[55].
Parmi les effets les plus évidents on observe :
- un effet sur la ripisylve (et les communautés rivulaires[56]). Pour faire son barrage, le castor prélève du bois dans la ripisylve en s'adaptant au contexte selon l'âge de la ripisylve et sa structure[57], et ce faisant il met une tache de sol (et parfois de sédiment) en lumière (on peut parler de tache, car il ne s'éloigne jamais beaucoup de l'eau pour pénétrer la ripisylve et s'y nourrir[58] - [59]). Dans le même temps son barrage fait monter le niveau de l'eau (de quelques centimètres à plus de 2 mètres parfois), ce qui crée un plan d'eau bien ensoleillé[60] et est également favorable à la ripisylve (qui risque ainsi moins de manquer d'eau en été). Ces deux nouveaux types de milieux n'existeraient sur le site sans le barrage, et le castor les entretient. Enfin, il creuse aussi quelques canaux à partir de son étang pour mieux circuler et tirer du bois coupé vers son gîte ou son barrage. Ces actions s'apparentent à certaines des actions menées par les gestionnaires de milieux naturels pour améliorer ou préserver la biodiversité des réserves naturelles, ce pourquoi il est souvent qualifié d'aménageur et de gestionnaire de son milieu[61]. Le bois mort et les branches coupées sont utiles à la biodiversité et à l'humus forestier[62] et le castor a une grande préférence pour les salicacées qui recèpent très facilement et qui apprécient l'eau[63].
- un effet de stockage d'eau ; très favorable au maintien ou à la restauration des zones humides. Cet effet est notamment important en zone aride (Arizona par exemple) ou en forêt boréale[64] (où le risque d'incendie estival sera ainsi réduit), et grâce au ralentissement du courant et à une plus large répartition de l'eau.
« Les barrages de castors créent de larges zones humides, amplifient les superficies des étangs et s'étendent ainsi à de larges échelles. En outre, ils allongent les cours d'eau en détournant l'eau dans la plaine alluviale et créent ainsi un réseau de chenaux distributaires doté d'un style alluvial anastomosé[65]. »
- un effet de frein à l'érosion hydrique (et indirectement éolienne), et de diminution de la turbidité moyenne de l'eau. La construction d'un barrage (et d'un terrier ou terrier hutte) est source d'avulsion, mais il est plus encore facteur de sédimentation ; autrement dit : le castor fixe globalement plus de matériaux qu'il n'en met en suspension ou n'en perd lors d'un « bris de barrage »), il est ainsi à long terme créateur de paysages de petites terrasses ou plaines alluviales humides, et plus en aval (en plaine ou en vallées ouvertes) de larges zones de décantation, drainées par ses microcanaux et des ruisseaux devenant plus sinueux. Ceci est considéré comme très bénéfique à la biodiversité et à l'intégrité biologique de la plaine inondable. Il protège aussi l'aval du cours d'eau et des estuaires d'apports excessifs ou irréguliers de sédiments[66]. Butlera et Malanson considèrent même - à la suite d'une étude qu'ils ont publiée en (2005) sur l'influence géomorphologique des castors et sur le bris des barrages - que les barrages actuels de castors en Amérique du Nord, bien que ne constituant qu'environ un dixième de ce qu'ils étaient autrefois, sont encore responsables du confinement d'importants volumes de sédiments[67] ;
- un effet sur la température de l'eau : par la masse d'eau qu'il retient notamment dans les ruisseaux à débit intermittent, ou exposés à de longues périodes de sécheresse, chaque barrage a un effet d'inertie thermique sur son étang, plus ou moins selon sa surface et sa profondeur. L'eau s'y réchauffe moins vite en été et se refroidit moins vite en hiver (de même pour le jour et la nuit.
En Californie, Gard (1961) a relevé le 4 août 1955 un pic de température de l'eau à 22,5 °C (ce qui reste dans la marge de tolérance, selon Embody[68], des 3 espèces de truites sauvages qui vivaient dans la retenue)[69], Fry[70] et selon Adams qui a constaté que l'omble de fontaine survit 5,5 heures dans une eau à 80 degrés Fahrenheit (26,67 °C)[71]. Ces barrages atténuent les effets des canicules, mais ne permettent cependant pas de compenser les effets globaux sur l'eau du changement climatique, en particulier quand la température de l'eau a augmenté dès la source. - un effet sur le taux d'oxygène : dans les cours d'eau vive, le taux d'oxygène dissout diminue dans l'eau qui traverse le réservoir[27], plus ou moins selon les contextes. L'arrêt de la photosynthèse la nuit y contribue, de même que l'activité des décomposeurs qui sont plus nombreux juste en amont du barrage et au niveau du fond vaseux. Une zone anoxique peut être présente au fond en été (Avery, 1992) et parfois en hiver sous la glace (taux descendu à 0,1 mg/l dans un barrage du Wisconsin, mais resté nettement supérieur aux valeurs minimales estimées correspondre aux besoins des salmonidés dans les eaux froides dans des mares de castor étudiées au Nouveau-Brunswick - même en périodes prolongées de neige et de gel[72]). De même pendant que le castor construit son barrage avant que les plantes aquatiques ne s'y soient installées.
L'eau se réoxygène complètement en sortie de la mare, en ruisselant sur la chute du barrage et dans les 250 m en aval.
En hiver, les besoins en oxygène de la plupart des organismes aquatiques diminuent, mais 5–6 mg/l sont jugés être le minimum nécessaire pour les truites et saumons, les autres espèces étant plus tolérantes[11]. Selon Smith et al. (1991), Il n'y a pas de chute prolongée de l'oxygène dissous du fait de la seule activité des castors sur un cours d'eau de petit ordre, non pollué et encadré de boisements[73]
Selon Smith a al (1991), en écologie du paysage, « les théories courantes sur les écosystèmes lotiques, telles le concept du continuum fluvial, devraient tenir compte d'événements circonstanciels comme ceux créés par la présence d'un barrage de castor »[73].
Effet sur les insectes
De nombreux organismes aquatiques ne peuvent survivre que dans les eaux stagnantes ou dans les eaux vives; lorsqu'un nouveau barrage retient un cours d'eau, nombre des organismes qui y vivent disparaissent et d'autres espèces les remplacent.
« Les larves de la mouche noire Simulium, par exemple, ne vivent que dans l'eau courante, de sorte que lorsqu'un cours d'eau est retenu, il est probable que la population de ces pestes soit réduite dans la région. [...]. Par contre, il peut y avoir une augmentation des populations de moustiques, qui se reproduisent dans l'eau stagnante[74]. »
Effet général de renaturation

Le retour des barrages dans l'aire naturelle de répartition du castor contribue à la « revitalisation de cours d'eau »[75], car la présence du castor permet de multiplier, restaurer et enrichir les "niches écologiques" du cours d'eau, et rapproche ainsi le milieu de son écopotentialité et du bon état écologique notamment car par rapport aux cours d'eau sans barrage. Un cours d'eau barré par le castor, ainsi que ses petits canaux associés augmentent la naturalité et la complexité du milieu, tout en y conservant mieux l'eau. Un cours d'eau où plusieurs barrages se succèdent connaît une alternance de sections d'eaux lentes et profondes (à forte inertie thermique) et de sections d'écoulements rapides à lame d'eau moins profonde (et à moindre inertie thermique). En complexifiant également la berge et les écotones le castor augmente fortement le nombre de habitat disponibles, dans la ripisylve et sous l'eau.
Effets halieutiques
Les barrages et leurs mares profitent logiquement aux espèces des eaux lentiques et plutôt tièdes[76], mais (de manière contre-intuitive) aussi salmonidés[77] - [78] - [79] et des ripisylves.
Une étude allemande[80] a comparé (en 1995) plusieurs groupes d'organismes (Odonata, Mollusca, Trichoptera, Ephemeroptera et Diptera) dans 2 ruisseaux des Monts Spessart (Hesse, Allemagne), dont l'un accueillait une série de barrages de castors. Là où le courant était ralenti par un barrage de castor, trois espèces n'ont pas été retrouvées (Drusus anulatus, Trich., Sericostoma personatum, Trich., Radix peregra, Gastr.), mais chaque retenue de castors abritait « un nombre nettement plus élevé d'espèces de libellules et demoiselles, d'oiseaux, de mollusques et de trichoptères que les ruisseaux situés à leur amont »[80]. Les barrages de castor en augmentant l'hétérogénéité des sections de ruisseaux et rivières permettent une coexistence d'organismes aquatiques à la fois typiques des eaux vives et des eaux lentes, en augmentant la biomasse globale produite, en augmentant grâce aux étangs de castors l'abondance des éphémères (ex Cloeon dipterum) plus que dans les zones lentiques sans castor (où les chironomes dominaient[80]). Dans les secteurs à fort courant en aval de chaque barrage les organismes caractéristiques des eaux vives étaient également présents[80]. La plupart des insectes trouvés lors de cette étude sont à la base de l'alimentation des poissons non herbivores[80].
En comparant en Ontario un étang de castor récent (petit et peu profond) à d’autres milieux aquatiques de la région, les chercheurs s’attendaient à y trouver 1) moins d’espèce que dans les grands lacs, 2) des poissons principalement de petite taille, 3) des espèces aléatoirement distribuées sur les microhabitats de cet étang et 4) un fort degré de chevauchement des régimes alimentaires entre espèces et classes d'âge[81]. En réalité, les 2 premières prédictions se sont avérées en partie exactes (10 espèces de poissons étaient présentes dans la mare, c’est moins que les 13,2 espèces présentes en moyenne dans les grands lacs proches, mais c’est plus qu’attendus dans un étang de cette taille sans castor). La plupart des poissons étaient effectivement plus petits que dans les grands lacs, mais pas la perche soleil, ni la perchaude et la barbotte brune (Ameiurus nebulosus)[81]. L'occupation de l'habitat n'était pas aléatoire, et une séparation des niches alimentaires a été observée même quand la nourriture était moins abondante. L'étude a conclu que même si les étangs de castors ne présentent pas une gamme d'habitats et une diversité en espèces aussi élevées qu'en milieux lacustres, une relativement faible densité en proies et une forte densité en poissons y semble néanmoins permettre et favoriser le partage des ressources par les différentes espèces[81]. Les aménagements du castor créent de nouveaux microhabitats eux-mêmes sources de nourriture pour les poissons, et assez complémentaires pour satisfaire les besoins de toutes les classes d'âge de la truite par exemple, même en période de forte et longue sécheresse[82]
On a cherché à savoir ce que les truites mangeaient dans les étangs de castor. Pour cela 142 truites (de trois espèces différentes) ont été capturées à différents moments de l'année (par pêche électrique) dans des étangs de castor en Californie[69]. Les chercheurs ont identifié dans leurs estomac 72 espèces différentes d'invertébrés encore identifiables, soit 11 espèces de plus que les 61 invertébrés trouvés dans les estomacs de truites de torrent ou rivière[69]. De manière surprenante, ils y ont trouvé beaucoup d'espèces de courants rapides et assez peu d'espèces typiques des eaux lentes[69]. Un piège à deux voies a donc été posé en été en amont d'un des étangs de castor étudiés pour savoir si les truites vivant dans les eaux de retenues de barrages de castor ingéraient ces invertébrés dans l'étang même ou plus en amont dans une zone de courant plus rapide. En trois semaines seules 2 truites sont passées par le piège[69], ce qui laisse supposer que ces insectes d'eaux vives venaient donc de l'amont (porté par le courant) (et/ou des interstices du bois du barrage ?). Il est à noter aussi que les insectes des eaux vives ne se reproduisent généralement qu'une fois par an, alors que ceux des eaux lentes (comme dans les mares de castor) peuvent souvent produire plusieurs générations par an[69] ; de plus alors que les sédiments de graviers sont plus oxygénés mais peu productifs en termes de biomasse, les sédiments argileux qui se déposent devant le barrage sont parmi les plus productifs en biomasse[69]. Quelques études ont cependant montré que les vieilles mares de castor sont un peu moins riches en espèces que les mare récentes (5 % d'espèces en moins)[69]. Dans l'étude de Gard (en Californie), les 3 espèces de truites cohabitant dans un même étang de castor avaient (selon leur contenu stomacal) une alimentation variant selon la saison mais aussi légèrement différente selon l'espèce, et la truite se montre sélective, ne consomme pas nécessairement la nourriture la plus abondante[69]. La plupart des autres études faites dans une même région géographique trouvent au moins autant de truites par ha de plan d’eau ou par km de cours d’eau dans les étangs de castors que dans le reste du cours d’eau, et parfois nettement plus (une étude a trouvé quatre fois plus de truites dans les étangs mais pourraient avoir été biaisée par la méthode de la pêche électrique qui dans les cours d’eau rapide sous-estime souvent le nombre réel de poissons). À titre d'exemple, en Californie Gard & al. comptaient à la fin des années 1950 en moyenne 747 truites par ha dans les 14 étangs de castor qu'ils ont étudié, contre 664/ha dans le reste du cours d'eau (différence qu'il ne juge cependant pas statistiquement significative[69], par contre une différence très significative était que dans tous les cas (malgré des variations annuelles), les truites étaient nettement plus grosses et grandes (37 mm de plus en moyenne) dans les étangs de castor que dans le reste du cours d'eau[69], comme cela avait déjà été remarqué par Rutherford dans le Colorado en 1955[83]).
A des fins de restauration de ripisylves et d'habitats pour les oiseaux, le castor a été réintroduit dans les la forêt rivulaire de la rivière San Pedro dans le désert d'Arizona, et il y fait l'objet d'un suivi scientifique[84].
Effets sur les amphibiens

Les larves de grenouille, crapauds, tritons et salamandres (et parfois les adultes dans le cas de la rainette ou de la grenouille verte...) profitent fortement de l'eau et de la nourriture qu'offrent le réservoir[85].
Une étude canadienne a ainsi trouvé en Alberta 5,7 fois plus de grenouilles des bois récemment métamorphosés, 29 fois plus de crapauds et 24 fois plus de rainettes boréales faux-grillons près des mares à castor que près des sections de cours d'eau à écoulement libre à proximité[86]. Dans le Devon, dans une zone humide où le castor a été récemment réintroduit dans le cadre du « Devon Beaver Project »[87] et où ses effets font l'objet d'un suivi, le nombre de pontes d'amphibiens a augmenté ; passant de 12 (en 2011) à 521 (en février 2015)[88].
Alors que les mares tendent à disparaitre des paysages agricoles, les castors peuvent restaurer des milieux de sustitution dans les petits cours d'eau situés dans des environnements forestiers ou bordé d'arbres ou de buissons[89], à tel point que des biologistes ont proposé le castor comme auxiliaire de la protection des anoures, notamment dans les zones boréales riches en petits cours d'eau (car là, les mâles appelants d'anoures tels que Pseudacris maculata, Rana sylvatica et Bufo boreas ne sont jamais observés dans les « cours d'eau non barrés », alors qu'ils sont fréquents ou abondants dans les mares de castors où ils trouvent une nourriture plus facile et où leurs têtards trouvent une nurserie idéale[90]. Plus l'environnement est riche en étangs de castor, plus les chercheurs trouvent de jeunes de l'année pour ces espèces[90].
Effets sur les oiseaux
Les étangs à castor sont un habitat de choix et d’une grande importance pour la sauvagine. Le ministère des Ressources naturelles et de la Faune du Québec note cette importance particulièrement pour «le canard noir, le canard huppé, le bec-scie couronné, le morillon à collier et le garrot commun». On ajoute que «Le succès de nidification y est élevé en raison de la forte présence de couvert qui limite la prédation»[91].
Effets sur les mammifères
Il concerne des prédateurs du castor (le loup et le coyote quand ils sont présents), des animaux piscivores tels que la loutre ou piscivores occasionnels (ours, lynx), mais aussi des animaux insectivores (plusieurs espèces de chauve-souris spécialistes des milieux forestiers ou aquatiques profitent de la manne d'insectes émergeant de nuit à partir des mares de castors ou venant y pondre[92] - [93] dans les petites vallées.
Effets sur les macrophytes
Chaque étang de castors permet l'apparition d'une succession de macrophytes et de nouvelles ceintures de végétation qui n'existeraient pas (ou bien moindrement) sans ce plan d'eau[94].
Ray & al. (2001) ont étudié 36 étangs de castor canadiens (étangs âgés de 4 à 40 ans, isolés d'autres masses d'eau dans une zone de tourbière) : Ils ont montré que « la richesse et la diversité en espèces augmente de façon linéaire dans les étangs au cours des quatre premières décennies. L'âge de l'étang et le produit de la dimension de l'étang par le nombre d'étangs voisins dans un rayon de 250 m explique 64 %[95] de la variation dans la richesse », avec une composition floristique qui semble fortement déterminée par les modes de dispersion des graines (apportées par le vent, les oiseaux ou d'autres animaux qui viennent profiter de ce nouveau point d'eau ou de la flore, faune ou fonge ou des micro-organismes qu'il abrite)[94].
Ici, ce sont les étangs les plus anciens (de 11 à 40) qui abritaient la plus grande richesse en macrophytes (tant émergées, flottantes que submergées). Ces derniers étaient dominés par les nymphéas (plante consommée par les castors) devant les potamots (Potamogetonaceae). À l'occasion de cette étude, les auteurs ont produit un « modèle de prédiction pour la succession des macrophytes dans les étangs à castors », qui pourra faciliter l'étude des processus écologiques liés aux macrophytes favorisés par les castors[94].
La flore immergée profite aussi à l'orignal, le seul mammifère non aquatique pouvant brouter sous l'eau.
« Effet épuration de l'eau»
Il découle de la combinaison des effets décrits ci-dessus que la mare fonctionne comme un lagunage naturel. L'autoépuration du milieu colonisé par le castor en est renforcée[96], y compris concernant l'azote[97] (eutrophisant devenu problématique dans tous les pays riches).
Un « effet filtration » existe : la partie haute du barrage bloque et filtre une grande partie des objets flottants et le cas échéant les algues filamenteuses et les lentilles d'eau (et dans les zones anthropisées il n'est pas rare de trouver des bouteilles ou sacs en plastiques réutilisés par le castor dans son barrage. Occasionnellement, des barrages peuvent aussi intercepter des nappes d'hydrocarbures ; ainsi, dans la forêt boréale canadienne en 2011 un barrage de castor a efficacement bloqué le pétrole issu d'une rupture d'un oléoduc de la compagnie pétrolière Plains Midstream Canada, évitant une marée noire sur le territoire des Indiens du lac Lubicon situé en aval (six castors ont néanmoins été empoisonnés ou ont été euthanasiés, et quelques-uns soignés ; une dizaine de canards sont également morts) ; La fuite était équivalente à 28 000 barils de pétrole dont une partie avait abouti à la rivière[98] - [99].
Un effet d'épuration chimique existe aussi, plus ou moins marqués selon le volume d'eau et de sédiment accumulé par le castor, selon les paramètres amont de qualité de l'eau, et selon les paramètres antérieurs à l'installation des castors. Lafontaine et al. (2000) donne quelques exemples de l'importance du contexte : « si les éléments nutritifs sont au préalable peu abondants, un accroissement des nitrates et phosphates du fait des castors aura un impact positif sur la productivité en salmonidés, alors que l'impact sur un site eutrophe riche peut être négligeable, voire négatif ».
De même, dans un écosystème acide ou exposé à des pluies acides, l'eau ressort toujours de l'étang du castor nettement moins acide qu'elle n'y est entré. Le barrage a comme effet indirect d'augmenter le « potentiel de neutralisation de l'acide » (PNA)[100], au profit de nombreuses espèces, dont les salmonidés (sauf dans les eaux naturellement alcalines)[11]. Or, dans les eaux non-acides, les métaux lourds sont moins solubles, circulent moins et sont moins biodisponibles. Le castor ne peut pas les faire disparaître car ils ne sont pas biodégradables, mais une partie d'entre eux sera plus ou moins durablement piégée et dans une certaine mesure inertée dans les sédiments des mares à castor (où les plombs de chasse et d'agrès de pêche perdus sur place ou apporté par le courant poseront donc a priori moins de risque de saturnisme animal, tant qu'ils ne seront pas directement ingérés par un animal).
Ceci ne vaut pas cependant pour le mercure (qui est Amérique du Nord très présent dont dans des régions industrielles et là où les mines d'or en ont rejeté des quantités importantes). Dans les régions boréales ou froides on en a trouvé dans l'eau de mares de castor sous sa forme la plus écotoxique (le méthylmercure) avec une double fluctuation saisonnière. Dans trois étangs de castor du sud-ouest du Québec, 58 à 80 % du mercure était présent sous forme méthylée en fin d'hiver, en raison du pic hivernal d'anoxie dans le sédiment des étangs recouverts de glace[101]. Un pic moins important a été constaté en été, très élevé dans l'étang le plus récent, là et quand les bactéries responsables de la méthylation du mercure sont les plus actives, avec dans ce cas jusqu'à 2,8 nanogrammes de méthylmercure par litre d'eau dans un étang récent (taux comparable aux taux les plus élevés trouvés dans les fleuves nord-américains[102] ou dans l'eau de prairies ou forêts inondées depuis quelques mois, ou dans un réservoir expérimental créé en forêt boréale[103]), alors que dans un étang ancien (20 ans environ), ce taux (0.456 à 0.727 ng L−1 sur 3 ans) était élevé, mais similaire à celui trouvé en aval de zones humides boréale[104]. Dans ces 3 étangs, 34 à 67 % du mercure était présent sous sa forme méthylée et 80 % environ de ce méthylmercure l'était sous une forme soluble et non sous forme particulaire. Quand l'eau est claire, une partie du méthylmercure de la mare peut être dégradé par photochimie[105].
Les effets du castor sur l'azote et le carbone sont particulièrement intéressants : Le castor et tous les organismes vivant dans sa mare ont besoin de protéines, et donc de carbone et d'azote biodisponible. Les aménagements du castor ont pour effet de renforcer la captation de l'azote ambiant (par les microbes puis le réseau trophique).
Effets sur le cycle de l'azote et du phosphore
Le cycle de l'azote a été étudié au Québec dans des cours d'eau de 2e ordre où les castors aménagent le plus de barrage. Naiman & Melillo (1984) ont montré que les sédiments que les castors y stockent sont - par mètre linéaire de cours d'eau - près de 1000 fois plus riches en azote que les sédiments adjacents de même profondeur. De plus, alors qu’ailleurs (dans les creux ou évasements du lit mineur) l’azote provient essentiellement et saisonnièrement des feuilles mortes, dans le réservoir de castor, il provient aussi et surtout de la fixation microbienne de l’azote. C'est une des explications à la forte bioproductivité animale et végétale des étangs de castor. L'année suivante (1985), Francis et al. estiment que grâce aux barrages de castor, l'accumulation totale d'azote par leurs sédiments est - par tronçon unitaire - multiplié par 9 à 44, sans eutrophiser la rivière, l’estuaire ou la mer[106]. Cet azote sera en grande partie récupéré par les racines et plantes de la ripisylve et les espèces pionnières qui s’y réinstallent quand un barrage est abandonné.10 ans plus tard (1995), Songster-Alpin & Klotz, en mesurant la respiration et la biomasse microbiennes des mares de castors, confirment que l'activité microbienne globale du cours d'eau en est fortement augmentée « 13 à 35 fois plus grande dans les étangs que dans les tronçons d'amont. Exprimée par unité de longueur du cours d'eau (microgrammes d'O2 par mètre par heure), l'activité était 460 à 2180 fois plus grande. »[107]. Le castor joue donc un rôle qui a été beaucoup sous-estimé dans les cycles biogéochimiques de l'hémisphère nord.
Selon Devito et Dilon (2011), « L'accumulation initiale de matériaux forestiers submergés et l'apport de matière organique par les castors peuvent être très importants pour la dynamique de P (phosphore) et N (Azote), ce qui représenterait une source à long terme de matières nutritives pour l'eau de l'étang et son exutoire »[108]
Effets climatiques et microclimatiques
Dans une région de l'Alberta où le castor avait disparu au XIXe siècle mais qu'il a récemment progressivement recolonisée (depuis 1954) une étude a cherché dans quelle mesure les barrages et leurs retenues d'eau influençaient les microclimats voire les climats loco-régionaux (en termes d'hygrométrie, température, précipitations et de leurs fourchettes et variations)[109]. Elle a montré qu'en forêt mixte boréale, des eaux libres estivales réapparaissent depuis le retour de C canadensis, grâce à ses barrages. L'extension et les modifications de surfaces en eau sur la période de recolonisation (période comprenant des épisodes humides et secs)[109] a facilement été suivie grâce à des photos aériennes faites de 1948 à 2002. L'étude a conclu que le nombre de huttes occupées « expliquait » plus de 80 % de la variabilité de la présence d'eau libre durant ce demi-siècle[109], et que les variables climatiques températures et précipitations avaient statistiquement « beaucoup moins d'importance » que la présence/absence de castor dans le maintien de ces zones d'eau libre[109].
« En outre, les années humides et sèches, l'étendue totale d'eaux libre était multipliée par 9 dans la zone où le castor était revenu (par rapport aux zone où il est resté absent) »[109]. Les auteurs en déduisent que le castor a une influence considérable en termes de création et entretien des zones humides, y compris durant une sécheresse extrême, et que pour cette raison, sa disparition doit être considérée comme néfaste aux zones humides et aux services écosystémiques qu'elles procurent[109]. Ceci expliquerait en partie les fréquentes observations d'une augmentation de la biodiversité associée au retour du castor.
Cette étude porte sur le castor canadien, mais les chercheurs considèrent que les effets qualitatifs sur l'environnement du castor européen sont comparables (là où il fait des barrages)[110] même si les barrages canadiens sont souvent plus imposants.
Barrages abandonnés ou provisoires
Certains barrages sont provisoires (ne servant qu'en été ou lors d'une période exceptionnellement sèche). On trouve aussi des barrages abandonnés (par exemple dans l'est de la Lituanie où le castor a reconstitué d'importantes populations, mais où il est aussi fréquemment la proie des loups[111], alors que la population de castors augmentait de 1983 à 2001, les sites de castors abandonnés composaient 44 à 58 % des sites connus. Un suivi sur près de 20 ans a montré que dans les marais et les cours d'eau lituaniens petits et de faible profondeur (peut-être en réponse à l'abondance des prédateurs tels que loutre, ours, loup...) l'activité du castor est particulièrement dynamique (la durée moyenne d'utilisation continue d'un site était en 2001 en moyenne de 2,61 ans et une grande partie des sites abandonnés (≥ 43 %) l'étaient après une courte période de temps (2,72 ans en moyenne), mais ensuite à nouveau recolonisés par des castors après quelques mois ou années).
Un barrage peut être abandonné soit en raison d'une épidémie qui a tué la famille, soit en raison du braconnage, soit à la suite d'une prédation (par des loups souvent). Généralement, une partie du barrage (la partie centrale souvent) se délite alors peu à peu. La brèche en s'agrandissant (souvent à l'occasion d'une crue) provoque la vidange plus ou moins complète et rapide de l'étang. Ensuite sur le monticule formé par le bois en décomposition du barrage et de la hutte, ainsi que sur les sédiments du réservoir mis à nu, la végétation se réinstalle très rapidement, souvent au profit d'espèces pionnières forestières ou de zones humides... jusqu'à ce qu'une nouvelle famille revienne éventuellement construire un nouveau barrage.
Effets de la destruction d'un barrage
La destruction intégrale et brutale d'un barrage (par l'Homme ou une forte crue) a des effets immédiats ou différés, étudiés lors de la destruction expérimentale de barrages par des crues provoquées, ou dans le cadre d'études hydrographiques ou écologiques lors desquelles une crue est survenue et a détruit un ou plusieurs des barrages de la zone étudiée.
Les effets observés sont :
- une diminution immédiate du volume d'eau, un abaissement de la hauteur d'eau, une accélération du courant dans le lit mineur avec ensuite une exacerbation de l'amplitude des variations changements de température et de courant.
- un changement (souvent radical) de la nature du fond. Si le barrage a été détruit par une crue, la quasi-totalité du sédiment peut avoir disparu (emporté vers l'aval par l'eau), avec mise à jour du fond (gravier, galets) ou de la roche-mère (éventuellement sensible à l'érosion). Si la destruction est due à l'homme et qu'elle a été progressive, une partie du sédiment peut subsister sur les côtés du lit mineur.
- un changement de la faune et de la flore du lit du cours d'eau. Les espèces d'eaux vives dominent le nouveau milieu, mais la biomasse animale totale fortement diminuée, de même que la diversité des organismes[69] (ex pour deux barrages détruits par une crue sur la Sagehen Creek lors d'une étude écologique : division par plus de sept de la masse d'organismes vivant sur le fond, passant de 2,29 à 0,31 grammes par pied au carré ; et division par 22 de la biomasse totale sèche des autotrophes photosynthétiques, c'est-à-dire du total des plantes aquatiques enracinées, libres et du phytoplancton[69].
L'Homme et les barrages de castors
Durant la préhistoire
On connait encore peu de choses des interactions entre les activités de l'homme préhistorique et les barrages de castors, notamment durant les interglaciaires précédents. On sait que cet animal était chassé et mangé par les hommes préhistoriques, en Europe et en Asie. Mais certains auteurs pensent qu'il a joué un rôle bien plus important que celui de proie et de gibier pour l'Homme de Néandertal et de Cro-Magnon.
Selon Coles & Orme[112], le castor est un aménageur dont le rôle sur les paysages a pu être très sous estimé, et les préhistoriens ont attribué à l'Homo sapiens des changements de paysages post-glaciaires qui ont en réalité peut-être ou probablement été directement induits par le castor et sa capacité à retenir l'eau et freiner les eaux douces dans leurs course vers l'océan, à accumuler du bois et ouvrir les ripisylves.
Le castor, peut-être même avant le retour post-glaciaire d'Homo-sapiens régulait le débit de l'eau et amélioraient la capacité de charge des eaux douces (plus de poissons en particulier, y compris salmonidés) tout en améliorant la vitesse et l'importance de la recharge des nappes (cf loi de Darcy).
Mais aussi, la succession de ses barrages a pu jouer un rôle très important de rétention des sédiments qui ont participé à la création de riches plaines ou microplaines alluviales[110] - [113] - [114]. Une étude récente a montré en Belgique que les barrages y interceptaient les sédiments (à raison de 25 cm en moyenne en 7 ans dans un sous-bassin des Ardennes belges).
Nuisances des barrages

Les castors sont source de débris ligneux et d'embâcles en abattant des arbres ou en construisant des barrages et des huttes, mais ils captent et stockent également ces débris, dans des zones humides (ce qui limite les risques d'incendie). Comme les morceaux de bois sont souvent coupés en morceaux relativement petits, ils posent peu de problèmes en cas de rupture de barrage (bien moins qu'un arbre grand entier déraciné à partir de la berge par exemple).
Les barrages les plus hauts peuvent gêner l'activité de canoë-kayak, et les entrelacs de branches, quoique favorables aux poissons, peuvent gêner les pêcheurs quand les hameçons s'y accrochent.
Les deux gênes ou problèmes les plus importants sont
- la montée du niveau de l'eau quand elle concerne une zone cultivée, pâturée ou occupée par l'Homme. Le barrage demande alors à être contrôlé (voir chapitre suivant) ;
- la dégradation ou coupe d'arbres de rentes cultivés en bordure de cours d'eau (qu'il est possible de protéger par un grillage, un répulsif ou un fil électrifié).
Gestion des barrages
Il arrive qu'un barrage puisse être gênant pour les activités humaines, par exemple parce qu'inondant un champ ou un chemin ou bouchant un ponceau ou un exutoire de drain. La baisse du niveau de l'eau juste à son aval peut aussi déstabiliser les constructions ou seuils présents à cet endroit. On détruisait autrefois ces barrages gênants à la main, puis au moyen d'engins, voire (en Amérique du Nord) de dynamite. Mais détruire un barrage sans autres précautions est souvent sans effet à long terme, d'une part parce qu'en cas de destruction brutale une « vague de crue » est produite, avec un risque d'« effet domino » en aval, et d'autre part car les castors risquent de chercher à le reconstruire rapidement.
Divers moyens[115] permettent maintenant soit d'en contrôler le niveau sans avoir à le détruire, soit d'encourager le castor à construire son barrage à un autre endroit.
Il a été démontré que le castor se met à réparer son barrage quand l'eau baisse anormalement, quand il entend de l'eau couler ou qu'il perçoit un accroissement local du courant qui indique une fuite importante. Grâce à cela, on sait aujourd'hui que la pose d'un siphon silencieux permet de contrôler le niveau du plan d'eau créé par un barrage de castor. La prise d'eau de ce siphon doit être située à quelques mètres en amont du barrage et le rejet doit être situé à quelques mètres en aval. L'entrée de la prise d'eau doit être entourée d'une crépine (grillage de protection), sinon le castor le boucherait ou risquerait de s'y noyer, et le siphon risquerait de se boucher avec des feuilles mortes. Ce dispositif suffit à contrôler le niveau de l'eau[91]
Si le castor a commencé à construire un barrage ou qu'il risque de le faire à l'entrée d'un ponceau, il est possible de créer un peu en amont un pré-barrage : ce pré-barrage « invite » le castor à faire son barrage là où on le souhaite (le site doit aussi convenir au castor, en particulier le fond qui doit permettre l'ancrage du nouveau barrage)[116];
Sauf en cas de crue brutale et exceptionnelle, grâce à l'entrelacement des pièces de bois et parfois des racines des plantes qui y poussent, un barrage de castor ne cède pas brutalement, et il se montre même difficile à « démonter » manuellement (une technique consiste à utiliser un puissant jet d'eau pour dégager la terre poussée par le castor entre les branches, qui vont alors plus aisément pouvoir être retirées du barrage).
Un cas particulier est celui d'un barrage ancien et qui ne serait plus entretenu par un groupe de castor (par exemple décimé par une maladie). Généralement, il perd peu à peu son eau et sur la zone asséchées enrichie en sédiments la forêt se reconstitue rapidement, mais dans un contexte anthropisé, une analyse de risque mérite d'être faite et aboutir à un traitement adapté du problème (si un problème est mis en évidence)[51].
Enjeux de conservation
Comprendre les rôles et services écosystémiques autrefois et actuellement joué par les barrages et plans d'eau construits par les castors est un enjeu écopaysager et de biodiversité, mais aussi un enjeu pour l'eau et le climat.
Denise Burchsted & son équipe notaient en 2010 que des milliards de dollars sont dépensés aux États-Unis, depuis quelques décennies par des instances publiques, associatives ou privés pour restaurer les rivières. De même en Europe des efforts importants sont faits pour retrouver le bon état écologique des cours d'eau et donc de leurs bassins versants[117]. Après avoir dégradé les cours d'eau et les zones humides durant des siècles, il s'agit dans ces deux cas de retrouver un « état de référence souhaité »[117]. Cet état n'est cependant pas clairement défini, ou pour ce qui concerne le castor et ses effets, il sous-estime l'écopotentialité des bassins versants (faute d'études et de connaissance sur les paléoenvironnements et leur fonctionnement écologique)[117]. Les grands barrages artificiels posent indiscutablement des problèmes majeurs pour la migration des poissons, mais par crainte des inondations, de nombreuses collectivités suppriment les embâcles naturels dès qu'ils se forment, et un paradigme récemment devenu dominant chez les techniciens et gestionnaires de cours d'eau est qu'il faudrait rétablir une « libre circulation des poissons » en supprimant tous les obstacles significatifs à l'écoulement de l'eau au motif qu'ils seraient défavorables à la circulation des poissons[117]. Toutes les études[118] ayant porté sur le bilan des effets directs et connexes les barrages de castors sur les plans physique (hydrogeomorphie[119], géomorphologie[51].), climatiques et écologiques montrent que la somme et le bilan de ces effets sont au contraire positifs pour la faune (salmonidés y compris[120] et pour la biodiversité des poissons en général[121]), la flore, les écosystèmes, la recharge des nappes, la qualité de l'eau, les microclimats, et que la gêne qu'ils occasionnent parfois pour les activités humaines peut presque toujours être réduite, annulée ou compensée. Quand cela ne semble pas possible, reste la possibilité de déplacer les castors.
Selon Burchsted & al., il est urgent d'introduire dans les critères de restauration des milieux aquatiques une notion de discontinuité dynamique qu'ils nomment « beaver-mediated discontinuity » ; car dans la Nature, « les processus géologiques et écologiques créent des systèmes fluviaux épars et discontinus ». Les barrages faits par les castors nord-américains généraient autrefois en permanence de telles discontinuités, tout au long des parties amont des systèmes fluviaux « pré-coloniaux » d'Amérique du Nord[117].
Dans le contexte contemporain, les barrages de castors créent encore (là où ils existent) des séquences dynamiques d'étangs et de prairies humides entrecoupées de segments à écoulement libre[117]. Le territoire d'une seule famille peut dépasser 1 km de cours d'eau, mais aussi inonder la vallée latéralement, et fondamentalement modifier les cycles biogéochimiques et les structures écologiques en place, à plusieurs échelles spatiale et temporelles[117].
Notes et références
- Kraus S M. & Wells T. (1999) “ Recognizing avulsion deposits in the ancient stratigraphical record”, in : N.D. Smith et J. Rogers (eds.), Fluvial Sedimentology VI, International Assoc iation of Sedimentologists, Special Publication, 28 : 251 - 268
- John S. & Klein A (2004), « Hydrogeomorphic effects of beaver dams on floodplain morphology : avulsion processes and sediment fluxes in upland valley floors (Spessart, Germany) ; Les effets hydro-géomorphologiques des barrages de castors sur la morphologie de la plaine alluviale : processus d'avulsions et flux sédimentaires des vallées intra-montagnardes (Spessart, Allemagne) », Quaternaire, 15 (1-2) : 219 - 231. ([PDF], avec Persée)
- AFP, « Le plus grand barrage de castors découvert grâce à Google Earth », Libération, (lire en ligne)
- Danilov, P.I. & Kan’shiev, V.Ya. (1982). Some morphological and ecological features of the Eurasian and Canadian beaver in the USSR northwest. in : Fauna : ecologiya ptic (mlekopitajvscic) Severo-Zapada SSSR, Petrozavodsk : 109-123.
- Nolet BA (1996) La gestion du castor (Castor fiber) : vers la restauration de son ancienne répartition et de sa fonction écologique en Europe. Ed. Conseil de l'Europe, coll. Sauvegarde de la Nature, 86 : 7-34.
- Danilov PI (1995) Canadian and Eurasian beavers in Russian North-west (distribution, number, comparative ecology). In : The third Nordic beaver symposium. Helsinki, Finland : 10, 16pp.
- Munther, G.L. (1983) Integration of beaver into forest management. Proceedings of the l8th Annual Meeting of the American fisheries Society, Laramie, Wyoming.
- Pupininkas S (1999)The State of the Beaver (Castor Fiber) Population and Characteristics of Beaver Sites in Eastern Lithuania ; Acta Zoologica Lituanica ; Vol.9, no 1, janvier 1999, p. 20-2 (résumé)
- Hartman G & Törnlöv S (2006) Influence of watercourse depth and witdth on dam building behaviour by Eurasian beaver, Castor fiber. Journal of zoology ; 268:127-131 (résumé)
- voir photo p 5/13, in Petit, F., Denis, A. C., Levecq, Y., Houbrechts, G., Hallot, E., Van Campenhout, J., & Peeters, A. (2012) L'effet des barrages de castors sur le système hydrographique ; Université de Liège (PDF]) ; 6e rencontre entre acteurs de la rivière : « La cohabitation avec le castor en Wallonie »
- L. Lafontaine & C. Caroff (2000) Impact de l'activité du castor sur les biocénoses aquatiques (synthèse bibliographique) adaptation française ; G.M.B. 1999, d'après : Collen, P. (1997). Review of the potential impacts of re-introducing Eurasian beaver Castor fiber L. on the ecology and movement of native fishes, and the likely implications for current angling practices in Scotland. Scottish Natural Heritage Review, 86 : 1-53
- sur Google maps
- 20 minutes ; article intitulé Le plus grand barrage de castors du monde Plusieurs générations de castors ont réalisé un barrage à faire pâlir d'envie les ingénieurs les plus ambitieux. Il s'agit du plus grand barrage du monde construit par des castors., 06 mai 2010
- Butler D.R & Malanson G.P (1994) Beaver landforms. Canadian Geographer/Le Géographe canadien, 38(1), 76-79. résumé/1ère page
- Medwecka-Kamna’s, A. & Hawro, R. (1993). Vegetation on beaver dams in the Ojców National Park (Southern Poland). Phytocoenologia 23 : 611-618
- Rosell F & Parker H (1995) Forvaltning av bever : dagens tilstand og fremtidig behav. Hogskolen : Telemark, Avdeling for okonomi - miijo-og idrettsfag, Bø, 137pp.
- Curry-Lindahl K (1967) The beaver, Castor fiber L.1758, in Sweden extermination and reappearance. Acta Theriol 12(1) : 1-15.
- Myrberget S (1967) The beaver in Norway. Acta Theriol. 12(2) : 17-26.
- Zharkov IV & Sokolov VE (1967) The European beaver (Castor fiber L.1758) in the Soviet Union. Acta Theriol. 12(3) : 2746
- Wilsson, L. (1971). Observations and experiments on the ethology of the European beaver (Castor fiber L.). Viltrevy 8(3) : 113-266.
- Richard, P.B. (1983). Mechanisms and adaptation in the constructive behaviour of the beaver (C. fiberL.) ; Acta Zool. Fennica 174 : 105-108.
- Wycliffe 1914
- , consulté 2014-07-27
- David R. Butler (1991) Beavers as Agents of Biogeomorphic Change: A Review and Suggestions for Teaching Exercises Beavers as Agents of Biogeomorphic Change: A Review and Suggestions for Teaching Exercises ; Journal of Geography Volume 90, Issue 5 ; p. 210-217 ; DOI:10.1080/00221349108979304 (résumé)
- Johnston CA & Naiman RJ (1990) Browse selection by beaver : effects on riparian forest composition. Can. J. For. Res. 20:1036-1043
- Naiman RJ, Melillo JM & Hobbie JE (1986) Ecosystem alteration of boreal forest streams by beaver (Castor canadensis). Ecology. 67(5) : 1254-1269
- Rosell F & Parker H (1995) Forvaltning av bever : dagens tilstand og fremtidig behav. Hogskolen : Telemark, Avdeling for okonomi-miijo-og idrettsfag, Bø, 137pp.
- Johnston CA & Naiman RJ (1987) Boundary dynamics at the aquatic-terrestrial interface : the influence of beaver and geomorphology. Landscape Ecology, 1(1) : 47-57.
- Meentemeyer RK & Butler DR (1999) Hydrogeomorphic effects of beaver dams in Glacier National Park, Montana. Physical Geography, 20(5), 436-446 (résumé).
- Wendy Bigler, David R. Butler & Richard W. Dixon (2001) Beaver-pond sequence morphology and sedimentation in Northwestern Montana sequence morphology and sedimentation in Northwestern Montana ; Physical Geography Volume 22, Issue 6, pages 531-540 DOI:10.1080/02723646.2001.10642758 (résumé)
- DeBano LF, Heede BH (1987) Enhancement of riparian ecosystems with channel structures. Water Resour Bull 23:463–470. doi:10.1111/j.1752-1688.1987.tb00824.x
- Reid KA (1952) Effects of beaver on trout waters. Md. Cons. 29(4) : 21-23.
- Woo, M.K. & Waddington, J.M. (1990) Effects of beaver dams on subarctic wetland hydrology. Arctic 43(3) : 223-230.
- E Woo & Waddington (1990)
- Parker M, Wood FJ, Smith BH & Eider RG (1985) Erosional downcutting in lower order riparian ecotosystems : have historical changes been caused by removal of beaver ? in : Riparian ecosystems and their management reconciling conflicting uses. (Johnson et al. tech. Records). Cen. Tech. Rep. RM-120, Fort Collins, Ce : US. Dept. Agr. For. Serv. Rocky Mountain Forest.
- Grasse JE (1951) Beaver ecology and management in the Rockies. J. For. 49(1) : 3-6.
- Apple LL, Smith BH, Dunder JD & Baker BW (1984) The use of beavers for riparian/aquatic, habitat restoration of cold desert gulley cut stream systems in southwestern Wyoming. In Proceedings, Arnerican Fisheries Society/Wildlife Society Joint Chapter Meeting, Feb. 8-10, Logan, Utah. vArnell, N.W., Jenkins, A.. & George, D.G. (1996). The implications of climate change for the National, Rivers Authority. HMSO, London.
- Parker M (1986) Beaver, water quality and riparian systems. Compte-rendu de : Wyoming water and streamside zone conference. Wyoming Water Research Centre, Université du Wyoming, Laramie
- Duncan, S.L. (1984). Leaving it to beaver. Environment 26(3) : 41-45
- Yeager LE & Hill RR (1954). Beaver management problems in western public lands. Transactions of the North American Wildlife and Natural Resources Conference 19:462-479
- Rutherford WH (1955) Wildlife and environmental relationships of beavers in Colorado forests. J. For. 53(11) : 803-806.
- Bergstrom D (1985) Beavers : biologists "rediscover" a natural resource. Forestry research west-United States Department of Agriculture, Forest Service (USA)
- Naiman R, Johnston C & Kelley JC (1988) Alteration of North American streams by beaver. Bio. Science 38(11) : 753-762.
- Viret J. (1954) « Le lœss à bancs durcis de Saint-Vallier (Drôme) et sa faune de mammifères villafranchiens », Nouv. Arch. Museum Hist. nat. Lyon, fasc. IV, p. 1-200, 43 fig., 33 pi. h.t.
- Leroi-Gourhan Arlette (1973) Les cèdres « villafranchiens » de Saint-Vallier (Isère). In: Bulletin de l'Association française pour l'étude du quaternaire - Vol.10 no 1 p. 25-30. doi:10.3406/quate.1973.1215
- Bastin B (1971) « Recherches sur l'évolution du peuplement végétal en Belgique durant la glaciation de Wurm », Acta Geographica Lovaniensia, vol. 9, p. 1-136.
- Frenzel F (1964) « Zur Pollenanalyse von Lossen. Untersuchungen der Lôssprofile von Oberfellabrunn und Stïllfried (Niederosterreich) », Eiszeitalter und Gegenwart, 15, p. 5-39.
- Girard M & Tamain G (1965) « Les lœss des Hautes-Bruyères, Villejuif (Seine) », Bulletin de la Société préhistorique française, LXI, no 2, p. 261-270.
- Leroi-Gourhan (Arl. et al.) (1967) « Contribution à l'étude du climat de la station de vadastra du paléolithique supérieur à la fin du néolithique) Bulletin de l'A.F.E.Q., no 4, p. 271-279
- Butler DR & Malanson G (2005) The geomorphic influences of beaver dams and failures of beaver dams ; Dams in Geomorphology, 33rd Annual Binghampton International Geomorphology Symposium Geomorphology, Volume 71, Issues 1–2, 1 October 2005, Pages 48–60 (résumé).
- Plunus J (2009) Paramètres hydrologiques et impacts hydrologiques et géomorphologiques des barrages de castors en région wallonne. Mémoire de Master en Sciences géographiques. Université de Liège, Liège.
- le mot anastomose est ici à comprendre comme « style de ruisseau à chenaux multiples, mais stables, sinueux, étroits et profonds (ratio largeur/profondeur faible) et à pente plutôt faible, isolant des îles de grandes dimensions par rapport à la taille des chenaux ». (Malavoie et Bravard (2010), « Éléments d'hydromorphologie fluviale »)
- Ellen Wohl, Kathleen Dwire, Nicholas Sutfin, Lina Polvi & Roberto Bazan (2012) Mechanisms of carbon storage in mountainous headwater rivers ; Nature Communications 3, Article 1263 ; doi:10.1038/ncomms2274,publié 2012-12-11 (résumé)
- Stoffyn-Egli P & Willison J.H.M. (2011) Including wildlife habitat in the definition of riparian areas: The beaver (Castor canadensis) as an umbrella species for riparian obligate animals ; Environmental Reviews, 19(NA): 479-494, 10.1139/a11-019 (résumé)
- Naiman RJ, Decamps H and McClain ME (2005) Riparia: ecology, conservation, and management of streamside communities. Academic Press.
- Keeton WS, Kraft CE and Warren DR. 2007. Mature and old-growth riparian forests: structure, dynamics, and effects on Adirondack stream habitats. Ecological Applications. 17(3): 852-868.
- Pinkowski B. 1983. Foraging Behavior of Beavers (Castor-Canadensis) in North-Dakota. Journal of Mammalogy. 64(2): 312-314.
- Raffel TR, Smith N, Cortright C and Gatz AJ. 2009. Central Place Foraging by Beavers (Castor canadensis) in a Complex Lake Habitat. American Midland Naturalist. 162(1): 62-73.
- Halley DJ, Rosell F (2003) Population and distribution of European beavers (Castor fiber). Lutra 46:91–101
- Baker BW & Hill EP (2003) Beaver (Castor Canadensis) Feldhamer GA, Thompson BC and Chapman JA (Eds), Wild Mammals of North America : Biology, Mangement and Conservation. The Johns Hopkins University Press: Baltimore, Maryland, p. 288-310
- Harrison, A.M., J.C. Stella. 2010. Engineering the forest ecosystem: impacts on woody vegetation structure and composition by beaver, a central place forager. Meeting of the Ecological Society of America, Pittsburgh, PA.
- Haarberg O and Rosell F. 2006. Selective foraging on woody plant species by the Eurasian beaver (Castor fiber) in Telemark, Norway. Journal of Zoology. 270(2): 201-208. DOI: 10.1111/J.1469-7998.2006.00142.X.
- Breton, M. N., Darveau, M., & Beaulieu, J. (2005). Développement d'une méthode de classification automatisée des milieux humides et des milieux riverains en forêt boréale. Canards illimités.
- Stefan, J. et Andreas, K. (2004). Hydrogeomorphic effects of beaver dams on floodplain morphology: avulsion processes and sediment fluxes in upland valley floors (Spessart, Germany) [Les effets hydro-géomorphologiques des barrages de castors sur la morphologie de la plaine alluviale : processus d'avulsions et flux sédimentaires des vallées intra-montagnardes (Spessart, Allemagne)] ; Quaternaire, vol 15, no 1-2, p. 219 à 231. voir notamment p.219 & figure 2.1
- Smith, D.P., Diehl, T.H., Turrini-Smith, L.A., Maas-Baldwin, J. et Croyle, Z. (2009). River restoration strategies in channelized, low-gradient landscapes of West Tennessee, USA. Geological Society of America Special Papers, vol. 451, p. 215-229.
- Butlera, D.R. et Malanson, G.P. (2005). The geomorphic influences of beaver dams and failures of beaver dams. Geomorphology, vol. 71, no 1-2, p. 48-60
- Embody GC (1921) Concerning high water temperatures and trout. Trans. Amer. Fish. Soc., 51:58-64
- Gard R (1961) Effects of beaver on trout in Sagehen Creek, California. Journal of Wildlife Management 25 (3): 221–242. doi:10.2307/3797848. JSTOR 3797848 télécharger PDF, 22p.
- Fry F, HART & Walker KF (1946) Lethal temperature relations for a sample of young speckled trout, Salvelinus fontinalis. Univ. Toronto Stud. Biol. Ser. No. 54, Pub. Ont. Fish. Res. Lab., (66):9-35.
- Adams AK (1953) Some physicochemical effects of beaver dams upon Michigan trout streams in the Watersmeet area. Unpubl. doctoral thesis, Univ. Mich., Ann Arbor. 316pp
- Komadina-Douthwright, S.M. (1994) Effects of beaver (Castor canadensis) on stream water quality under conditions of prolonged snow and ice cover (winter 1991-1992). Can. Tech. Rep. Fish. Aquat.Sci. 1986 : 34pp.
- Smith, M.E., Driscoll, C.T., Wyskowski, B.J., Brooks, C.M. & Consentini, C.C. (1991). Modification of stream ecosystem structure and function by beaver (Castor canadensis) in the Adirondack Mountains, New York. Can. J. Zool. 69 : 55-61 (résumé).
- Baxter et Glaude 1980
- Revitalisation de cours d’eau : le castor est notre allié ; Guide pratique n° UW-1417-F (présentation) ; Office fédéral de l'environnement OFEV, Centre Suisse de Cartographie de la Faune CSCF
- Hanson, WD & Campbell RS (1963) The effects of pool size and beaver activity on distribution and abundance of warm-waterfishes in a North Missouri stream. American Midland Naturalist 69:136–149
- Kemp PS, Worthington TA, Langford TE, Tree AR & Gaywood MJ (2012) Qualitative and quantitative effects of reintroduced beavers on stream fish. Fish and fisheries, 13(2), 158-181. (résumé)
- Collen P & Gibson RJ (2000) The general ecology of beavers (Castor spp.) as related to their influence on stream ecosystems and riparian habitats, and the subsequent effects on fish—a review. Rev Fish Biol Fish 10:439–461. doi:10.1023/A:1012262217012 (résumé)
- Avery, E.L. (1983) A bibliography of beaver, trout, wildlife, and forest relationships with special references tobeaver and trout. Technician Bulletin, 137, 1–23. Wisconsin Department of Natural Resources, Madison,WI
- Harthun M (1999) The influence of the European beaver (Castor fiber albicus) on the biodiversity (Odonata, Mollusca, Trichoptera, Ephemeroptera, Diptera) of brooks in Hesse (Germany) ; Limnologica - Ecology and Management of Inland Waters ; vol. 9, no 4, Novembre 1999, Pages 449–464 résumé
- Keast A & Fox MF (1990) Fish community structure, spatial distribution and feeding ecology in a beaver pond. Env. Biol. Fishes 27, 201-214 (résumé)
- Seth M. White & Frank J. Rahel (2008) Complementation of Habitats for Bonneville Cutthroat Trout in Watersheds Influenced by Beavers, Livestock, and Drought Complementation of Habitats for Bonneville Cutthroat Trout in Watersheds Influenced by Beavers, Livestock, and Drought ; Transactions of the American Fisheries Society Volume 137, Issue 3, p. 881-894 DOI: 10.1577/T06-207.1 (Transactions of the American Fisheries Society Vol. 137, no 3 (résumé)
- Rythervord WH (1955) Wildlife and en- vironmental relationships of beavers in Colorado forests. J. Forestry, 53:803-806.
- Investigating the effects of re-introduced beaver on avian community dynamics along the San Pedro River, Arizona, Sonoran Joint Venture, consulté 2014-07-26
- résumé)
- "Beavers Helping Frogs And Toads Survive" ; Science Daily. 2007-01-11
- Devon Beaver Project
- https://twitter.com/devonwildlife (voir graphique intitulé : « 521 clumps of frogspawn at Beaver site today. Just 10 clumps before beavers »
- Dalbeck L, Lüscher B, Ohlhoff D (2007) Beaver ponds as habitat of amphibian communities in a central European highland. Amphib Reptil 28:493–501. doi:10.1163/156853807782152561
- Cameron E. Stevens, Cynthia A. Paszkowski, A. Lee Foote (2007) Beaver (Castor canadensis) as a surrogate species for conserving anuran amphibians on boreal streams in Alberta, Canada ; Biological Conservation, Vol.134, no 1, janvier 2007, p. 13
- Laroque, Lamoureux et Pelletier 2010
- Nummi P, Kattainen S, Ulander P & Hahtola A (2011) Bats benefit from beavers: a facilitative link between aquatic and terrestrial food webs. Biodiversity and Conservation, 20(4), 851-859.
- Mateusz Ciechanowski, Weronika Kubic, Aleksandra Rynkiewicz, Adrian Zwolicki. (2010) Reintroduction of beavers Castor fiber may improve habitat quality for vespertilionid bats foraging in small river valleys. European Journal of Wildlife Research Online publication date: 23-Dec-2010. (« Résumé »)
- Ray AM, Rebertus AJ & Ray HL (2001) Macrophyte succession in Minnesota beaver ponds. Canadian Journal of Botany, 79(4), 487-499 (résumé)
- (p = 0,001)
- Tselmovich O & Otyukova N (2006) The role of beaver ponds in the processes of self-purification of a small river. In 4th European Beaver Symposium and the 3rd Euro-Americ an Beaver Congress (p. 57), Freising, Germanie, 11 au 14 septembre 2006
- Lamsodis R & Vaikasas S (2005) The potential to retain nitrogen in beaver ponds and delta floodplains of the River Nemunas. Archiv für Hydrobiologie. Supplementband. Large rivers, 15(1-4), 225-241 (résumé)
- Mathilde Golla (2011), article du Figaro intitulé Un barrage de castors permet d'éviter une marée noire, Publié le 05/05/2011
- Article intitulé Alberta Oil Spill: Baby Beaver Caught In Spill Nursed Back To Health CP, publié dans le Huffington Post 06/12/2012
- Christopher P. Cirmo, Charles T. Driscoll, Wetlands (1993) Beaver pond biogeochemistry : Acid neutralizing capacity generation in a headwater wetland. 13 (4), 277 - 292 (résumé)
- Roy, V., Amyot, M., & Carignan, R. (2009). Seasonal methylmercury dynamics in water draining three beaver impoundments of varying age. Journal of Geophysical Research: Biogeosciences (2005–2012), 114(G2).
- Shanley, J. B., et al. (2005), Physical controls on total and methylmercury concentrations in streams and lakes of the northeastern USA, Ecotoxicology, 14(1–2), 125–134, doi:10.1007/s10646-004-6264-z.
- Hall, B. D., et al. (2005), Impacts of reservoir creation on the biogeochemical cycling of methyl mercury and total mercury in Boreal Upland Forests, Ecosystems, 8(3), 248–266, doi:10.1007/s10021-003-0094-3, pDF, 19 pages
- St. Louis, V. L., et al. (1996), Production and loss of methylmercury and loss of total mercury from boreal forest catchments containing different types of wetlands, Environ. Sci. Technol., 30(9), 2719–2729, doi:10.1021/es950856h.
- Sellers, P., et al. (1996), Photodegradation of methylmercury in lakes, Nature, 380(6576), 694–697, doi:10.1038/380694a0.
- Francis, M.M., Naiman, R.J. & Melillo, J.M. (1985). Nitrogen fixation in subarctic streams influenced by beaver (Castor Canadensis). Hydrobiologia 121 : 193-202
- Songster-Alpin, MS. & Klotz, R.L. (1995). A comparison of electron transport system activity in stream and beaver pond sediments. Can. J. Fish. Aquat. Sci. 52 : 1318-1326 (résumé.
- Devito, K. J., & Dillon, P. J. (1993). Importance of runoff and winter anoxia to the P and N dynamics of a beaver pond. Canadian Journal of Fisheries and Aquatic Sciences, 50(10), 2222-2234. (résumé)
- Glynnis A. Hood, Suzanne E. Bayley (2008), Beaver (Castor canadensis) mitigate the effects of climate on the area of open water in boreal wetlands in western Canada ; biological conservation 141 556–567, PDF, 12 pp
- Jan Nyssen, Jolien Pontzeele, Maarten De Visscher, Paolo Billi, Amaury Frankl (2012)[L’effet des barrages de castors sur l’hydrologie et la morphologie des petits cours d'eau] ; 6e rencontre des acteurs de la rivière - La cohabitation avec le castor en Wallonie. Lierneux, 6 novembre 2012, PDF
- Bluzma P (2003) Beaver Abundance and Beaver Site Use in a Hilly Landscape (Eastern Lithuania) ; Acta Zoologica LituanicaVolume 13, Issue 1, January 2003, pages 8-14
- Coles JM., & Orme BJ (1983), Homo sapiens or Castor fiber ?. Antiquity Cambridge, 57(220), 95-102 (résumé Inist-CNRS [archive]).
- Nyssen, J., Pontzeele, J., Billi, P., 2011. Effect of beaver dams on the hydrology of small mountain streams: example from the Chevral in the Ourthe Orientale basin, Ardennes, Belgium. Journal of Hydrology, 402 (1-2): 92-102.
- M. de Visscher, J. Nyssen, J. Pontzeele et P. Billi, « Spatio-temporal sedimentation patterns in beaver ponds along the Chevral river, Ardennes, Belgium », Hydrological Processes, vol. 28, no 4, , p. 1602–1615 (ISSN 0885-6087, DOI 10.1002/hyp.9702, lire en ligne, consulté le )
- Major, L., Vallières, A., & Banville, D. (1981). Rapport d'étape : expérimentation de différents dispositifs visant à contrôler le niveau de l'eau aux barrages de castors "nuisibles". Direction de la recherche faunique, Direction générale de la faune, Ministère du loisir, de la chasse et de la pêche.
- voir Fiche technique 6.3 Prébarrage in Guide de gestion de la déprédation du castor
- Denise Burchsted, Melinda Daniels, Robert Thorson, Jason Vokoun (2012) The River Discontinuum: Applying Beaver Modifications to Baseline Conditions for Restoration of Forested Headwaters ; BioScience ; Vol. 60, no 11, décembre 2010. (résumé et 1re page)
- C. Ecological & Hydrogeomorphic Feedbacks of Beaver Dams
- Gurnell AM (1998) The hydrogeomorphological effects of beaver dam-building activity. Progress in Physical Geography. 22(2): 167-189
- Rachel L. Malison, Mark S. Lorang, Diane C. Whited, Jack A. Stanford (2014), Beavers (Castor canadensis influence habitat for juvenile salmon in a large Alaskan river floodplain. Freshwater Biology 59(6), 1229-1246
- Joseph M. Smith, Martha E. Mather (2013) Beaver dams maintain fish biodiversity by increasing habitat heterogeneity throughout a low-gradient stream network., Freshwater Biology 58 (7), 1523-1538
Bibliographie
En français
- R.M Baxter et P. Glaude, Les effets des barrages et des retenues d'eau sur l'environnement au Canada : expérience et perspectives d'avenir, vol. 205F, coll. « Can. Bull. Fish. Aquat. Sc. », , 36 p. (lire en ligne)
- C. Laroque, J. Lamoureux et A. Pelletier ((août 2002, révisé 2010) notamment inspiré du guide : The Beaver handbook: a guide to understanding and coping with beaver activity, du ministère des Ressources naturelles de l’Ontario), Guide de gestion de la déprédation du castor, Ministère des ressources naturelles et de la faune du Québec, Société de faune et Parcs du Québec, Direction de l’aménagement de la faune du Bas-Saint-Laurent, , 88 p. (lire en ligne)
- Liarsou A. (2013), Incidence des activités du castor (C. fiber L.) sur la dynamique d'évolution morphologique des rivières au Tardiglaciaire et durant l'Holocène en France : tentative de relecture des dépôts alluvionnaires et résumé
- Nyssen, J., Billi, P., Pontzeele, J., De Visscher, M., & Frankl, A. (2012). L'effet des barrages de castors sur les évènements de crues des petits cours d'eau. In 6e Rencontre des Acteurs de la Rivière: La cohabitation avec le castor en Wallonie. Service Public de Wallonie; Contrat de Rivière Amblève.
- Petit, F., Denis, A. C., Levecq, Y., Houbrechts, G., Hallot, E., Van Campenhout, J., & Peeters, A. (2012) L'effet des barrages de castors sur le système hydrographique ; Université de Liège (PDF]) ; 6e rencontre entre acteurs de la rivière : «La cohabitation avec le castor en Wallonie »
- Richard PB (1967) Le déterminisme de la construction des barrages chez le castor du Rhône. La terre et la vie, 4(1967), 339-470
- Richard PB (1955) Bièvres constructeurs de barrages. Mammalia, 19(2), 293-301 (résumé)
- Richard PB (1964) Les matériaux de construction du castor (Castor fiber), leur signification pour ce rongeur. Zeitschrift für Tierpsychologie, 21(5), 592-601 (résumé)
En anglais
- Adams AK (1953) Some physicochemical effects of beaver dams upon Michigan trout streams in the Watersmeet area. Unpubl. doc- toral thesis, Univ. Mich., Ann Arbor. 316pp
- Allen GH & Claussen L (1960) Selectivity of food by brook trout in a Wyoming beaver pond. Trans. Amer. Fish. Soc., 89:80- 81
- Apple LL, Smith BH, Dunder JD & Baker BW (1985) The use of beavers in riparian/aquatic habitat restoration of cold desert, gully-cut stream systems in southwestern Wyoming ; Proc. Ann. Meeting Colorado, T. Am. Fish. Soc., 18 (1985), p. 29–35
- Avery L (1991) Impact of beaver dam removal on summer water temperatures in a northeastern Wisconsin trout stream ; Research Management Findings, 30 (6) (1991), p. 1–4
- Bailey RW & Stephens RF (1951) Effects of beavers on fish. W.V. Cons., 15(6): 11-16, 26.
- Bigler, W., et al. (2001), Beaver-pond sequence morphology and sedimentation in northwestern Montana, Phys. Geogr., 22(6), 531–540.
- Cameron E. Stevens, Cynthia A. Paszkowski, A. Lee Foote (2007) Beaver (Castor canadensis) as a surrogate species for conserving anuran amphibians on boreal streams in Alberta, Canada ; Biological Conservation, Vol.134, no 1, janvier 2007, p. 13
- Gurnell AM (1998) The hydrogeomorphological effects of beaver dam-building activity. Progress in Physical Geography. 22(2): 167-189.
- Hagglund A & Sjoberg G (1999) Effects of beaver dams on the fish fauna of forest streams ; Forest Ecology and Management 115 (1999) 259±266
- Harthun, M (1999) The influence of the European beaver (Castor fiber albicus) on the biodiversity (Odonata, Mollusca, Trichoptera, Ephemeroptera, Diptera) of brooks in Hesse (Germany). Limnologica 29 449–464.
- Harthun, M. (2000). Influence of the damming-up by beavers (Castor fiber albicus) on physical and chemical n parameters of high land brooks (Hesse, Germany) ; Limnologica 30:21–35
- Keast A & Fox MF (1990) Fish community structure, spatial distribution and feeding ecology in a beaver pond. Env. Biol. Fishes 27, 201-214 (résumé)
- Rupp RS (1955) Beaver-trout relationship in the headwaters of Sunkhaze Stream, Maine. Trans. Amer. Fish. Soc., 84:75-85.
- Rutherford WH (1955) Wildlife and environmental relationships of beavers in Colorado forests. J. Forestry, 53:803-806
- Sprules WM (1941) The effect of a beaver dam on the insect fauna of a trout stream. Trans. Amer. Fish. Soc., 70:236-248.
- Wilde SA, Youngberg T & Hoivind JH (1950) Changes in composition of ground water, soil fertility, and forest growth produced by the construction and removal of beaver dams. J. Wildl. Mgmt., 14:123-128.
- (en) The romance of the beaver; being the history of the beaver in the western hemisphere, Philadelphia : J.B. Lippincott company; London, W. Heinemann, , 330 p. (présentation en ligne, lire en ligne)
- Zurowski W. (1987) Differences in effects of the European beaver re-introduction into the lowland and mountainous tributaries of the Vistula River. Abstracts : XVIII Congr. Int. Union of Game Biologists. Krak.
- Zurowski W (1989) Dam building activity of beavers on the mountainous streams. Abstracts : Fifth Int. Theriol. Congr. Rome, 1 : 316-317.
- Żurowski W (1992) Building activity of beavers. Acta theriol. 37: 403 - 411 PL (ISSN 0001-7051)