Tularémie
La tularémie est une maladie infectieuse provoquée par Francisella tularensis, le bacille de Francis (anciennement Pasteurella tularensis), une petite bactérie qui a la propriété de traverser la peau saine. En Europe, la transmission à l’homme se fait par l’intermédiaire d’un lièvre dans la grande majorité des cas, principalement par contact direct[1]. La transmission par piqûre de tiques est également possible[1]. C'est le mode principal de transmission en Amérique du Nord. En France, l’incidence de la maladie est faible, de l’ordre de quelques dizaines de cas par an. La forme clinique ulcéro-ganglionnaire est la forme le plus fréquemment observée, mais il existe des formes pulmonaires ou septicémiques graves. Le traitement est variable selon la gravité clinique et repose sur une antibiothérapie.
| Causes | Francisella tularensis |
|---|---|
| Transmission | Transmission aéroportée (d), transmission vectorielle (d), transmission par contact (d) et contamination féco-orale |
| Incubation min | 3 j |
| Incubation max | 10 j |
| Symptômes | Fièvre, empoisonnement (d), céphalée, anorexie, exanthème, énanthème, lymphadénite, splénomégalie, hépatomégalie, malaise, nausée, vomissement, épistaxis, ulcère, bubon (en), pneumonie, pleurésie, trachéite, bronchite, diarrhée, douleur abdominale, mal de gorge (en) et lymphangite |
| Médicament | Streptomycine, ciprofloxacine, doxycycline et tétracycline |
|---|---|
| Spécialité | Infectiologie |
| CIM-10 | A21 |
|---|---|
| CIM-9 | 021 |
| DiseasesDB | 13454 |
| MedlinePlus | 000856 |
| eMedicine |
230923 emerg/591ped/2327 |
| MeSH | D014406 |
| Patient UK | Tularaemia |
![]() Mise en garde médicale
Mise en garde médicale
Historique
Dans un article de 2007, le biologiste moléculaire Siro Igino Trevisanato décrit une maladie qui a sévi en -1350 au Moyen-Orient et dont les symptômes et le mode d'infection, connus par des lettres envoyées au pharaon Akhénaton au sujet d'un fléau à Simyra, rappellent cette maladie. Une décennie plus tard, les hittites attaquent cette région et sont à leur tour contaminés. Les Arzawas voulant conquérir les terres de leur voisin hittite, ce dernier laisse volontairement dans ses villages pillés des moutons contaminés. Il s'agit du premier usage connu d'arme biologique. Cette arme se répand dès lors dans toute l'Anatolie puis sur le continent européen lors des guerres menées par les Égéens de la Grèce antique[2].
La maladie a été décrite pour la première fois en 1911 par George W.McCoy, un chirurgien militaire, sur des écureuils du lac de Tulare dans le comté de Tulare en Californie. La bactérie Francisella tularensis est isolée l'année suivante chez un patient souffrant d'une deer fly fever (fièvre de la mouche du daim), sous le nom de Bacterium tularense. En 1921, Francis décrit précisément la maladie sous le nom de tularémie[3], mais différents synonymes persistent : rabbit fever (fièvre du lapin), hare fever (fièvre du lièvre), maladie de Ohara, maladie de Francis…
En 1924, Parker, Spencer et Francis isolent la bactérie chez la tique Dermacentor andersoni (en) et démontrent le rôle des tiques dans la transmission de la bactérie. Dès 1929, Parker montre qu'il existe une transmission transovarienne de la bactérie, établissant ainsi le rôle des tiques en tant que réservoir de la maladie.
Étiologie
La tularémie est une zoonose due à un très petit coccobacille (0,3 - 0,6 micron) : Francisella tularensis. Le réservoir principal de la bactérie est constitué par les lagomorphes et les rongeurs, mais la bactérie peut infecter bien d'autres espèces de vertébrés et d'invertébrés. En France, elle atteint essentiellement les populations de lièvres et la maladie peut être transmise à l'homme par contact avec les viscères (chasse)[4]. Ainsi les lièvres et les tiques représentent les principaux vecteurs de l’infection humaine. Dans les trois quarts des cas, elle est transmise par contact direct de la peau (pénétration du germe à travers la peau saine possible mais favorisée par des égratignures) avec des animaux infectés, des végétaux, le sol, le matériel contaminé (clous, lame, etc.) ou par des éclaboussures projetées dans l’œil ou sur des plaies cutanées (lors d'une tonte de gazon ou un taillage d'arbustes par exemple[5]). Plus rarement, la contamination peut être causée par des piqures d’insectes Tabanidae et par l'ingestion d’aliments ou d’eau contaminés.
Ce germe est très rare en Europe occidentale mais relativement fréquent en Europe orientale et en Scandinavie. Il se développe dans les macrophages[6]. Il est hautement infectieux, une dizaine de germes suffisant pour déclencher une infection grave[7]. Sa prolifération est facilitée par l'inhibition de la réponse inflammatoire de l'hôte par le germe lui-même[7].
Il existe deux types de germes, A et B, sous divisés en plusieurs génotypes : A1a, A1b, A2a, et A2b. Les infections à A1b sont les plus graves[8].
La maladie reste toutefois rare.
Sémiologie
L’incubation est classiquement courte (de 1 à 3 jours), mais peut durer jusqu’à 15 jours[9].
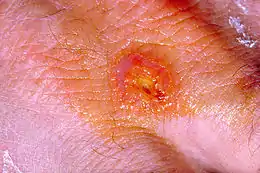
La maladie peut revêtir une forme locale (deux tiers des cas[9]) : ganglion qui évolue vers la suppuration (bubon) ou une forme typhoïde, généralisée, parfois avec éruption. Elle peut donner une forme pneumonique, grave.
Il peut exister une dissociation pouls-température, avec une fréquence cardiaque restant plutôt basse par rapport à la température[10].
Le début est souvent brutal, marqué par une forte fièvre, des frissons, une asthénie, des céphalées, des myalgies et arthralgies, et parfois des signes digestifs (nausées, vomissements).
Les signes cliniques résultent ensuite de la porte d’entrée de la bactérie. À partir de la lésion au point d’inoculation, la bactérie diffuse dans le territoire ganglionnaire de drainage, responsable d’importantes adénopathies.
La dissémination systémique peut ensuite survenir, avec une atteinte multiviscérale. Bien que la tularémie soit une maladie sévère lorsqu’elle est due à Francisella tularensis biovartularensis (biovar A), de nombreux cas occasionnés par d’autres souches de virulence atténuée sont très probablement sous-diagnostiqués.
Cette atteinte multiviscérale a pour conséquence des manifestations de la maladie sous différentes formes cliniques.
Formes typhoïdique et septicémique
La forme typhoïdique débute brutalement par un syndrome pseudogrippal non spécifique, associant diarrhée et vomissements, céphalées, frissons, myalgies et arthralgies, prostration et amaigrissement. Habituellement, aucun signe d’orientation ne permet de retrouver la porte d’entrée : il n’existe pas d’atteinte pulmonaire, d’ulcérations ni d’adénopathies inflammatoires. L’évolution peut être grave vers un choc septique avec coagulation intravasculaire disséminée, hémorragies, détresse respiratoire aiguë, confusion, défaillance d’organes et coma. Elle peut faire suite à l’ingestion ou à l’inhalation de Francisella tularensis. Une bactériémie vraie avec hémocultures positives à Francisella tularensis n’est pas toujours observée. La forme septicémique est potentiellement sévère et létale. Toutes les formes de tularémie peuvent se compliquer d’une septicémie. Les signes cliniques ne sont pas spécifiques : fièvre, douleurs abdominales, diarrhée et vomissements sont fréquemment observés à un stade précoce de la septicémie. Une dissociation pouls-température est observée dans moins de 50 % des cas. Le plus souvent, les patients évoluent vers un choc septique avec coagulation intravasculaire disséminée, hémorragies, détresse respiratoire aiguë, confusion, défaillance d’organes et coma.
Forme ganglionnaire
La forme ganglionnaire est caractérisée par la présence d’adénopathies dans un contexte fébrile, sans ulcération cutanée (de 5 % à 10 % des formes de tularémie).
Forme oculoganglionnaire
La forme oculoganglionnaire (de 1 % à 2 %) survient après contact aérosolisé ou par auto-inoculation (portage des mains). Des ulcérations de la cornée peuvent s’accompagner d’une conjonctivite purulente, d’un chémosis, d’un œdème périorbitaire, de nodules ou d’ulcérations conjonctivaux douloureux. Il existe des adénopathies préauriculaires, sous-maxillaires, carotidiennes ou cervicales. Lors de l’épidémie survenue en Suède en 1966, 26 % des cas confirmés présentaient une conjonctivite.
Forme oropharyngée
Cette forme est observée après ingestion d’eau ou d’aliments contaminés, après inoculation directe par les mains contaminées ou plus rarement par inhalation de particules aérosolisées. Il existe une angine douloureuse avec hypertrophie des amygdales et fausses membranes blanchâtres. Les stomatites sont plus rares. Un abcès rétropharyngé ou une adénite suppurée régionale peuvent être notés. Au cours de l’épidémie suédoise, 31 % des cas confirmés présentaient une pharyngite, 9 % présentaient des ulcérations buccales.
Forme pulmonaire
Elle résulte de l’inhalation de bactéries aérosolisées (pneumonie primaire) ou est secondaire à une bactériémie provenant d’une autre porte d’entrée (pneumonie secondaire). Aux États-Unis, de 10 à 20 % des cas de tularémie comprennent une atteinte pulmonaire. Lors de l’épidémie suédoise de 1966 ( Francisella tularensis de type B), parmi les 140 cas confirmés par sérologie et suspectés d’avoir été contaminés par inhalation, 14 patients (10 %) avaient des signes de pneumopathie (dyspnée, douleur thoracique). La pneumonie primaire serait la forme la plus susceptible d’être observée en cas d’acte de bioterrorisme par aérosolisation de bactéries. La radiographie pulmonaire peut montrer des infiltrats péribronchiques qui évoluent typiquement vers une pneumopathie, des épanchements pleuraux et des adénopathies périhilaires. Une pneumopathie interstitielle, des lésions cavitaires, une fistule bronchopleurale et des calcifications peuvent également être observées. Cependant, les signes radiologiques peuvent être minimes, voire absents. Ainsi, la sémiologie radiologique pulmonaire est hautement variable, pouvant faire évoquer des infections bactériennes ou fongiques autres, la tuberculose ou une pathologie tumorale. Le diagnostic de pneumonie tularémique doit être évoqué devant une pneumopathie atypique associée à une ulcération cutanée ou muqueuse et/ou des adénopathies localisées chez un patient ayant des activités en milieu rural. Une progression vers une pneumopathie extensive et sévère avec détresse respiratoire, hémoptysie, septicémie et décès peut survenir en l’absence de traitement antibiotique spécifique.
Diagnostic

Il y a une grande difficulté à mettre le germe en évidence par culture directe, même lorsqu'il est visible en grand nombre dans le pus ganglionnaire, il est rare d'obtenir un développement. Il en va de même de l'hémoculture qui est constamment négative. L'inoculation sur un tissu frais permet d'augmenter la rapidité de culture et la sensibilité[11]. Pour cette raison, il est préférable d'inoculer le prélèvement à une souris ou un cobaye et de sub-cultiver la rate de l'animal sacrifié sur milieu artificiel.
Le sérodiagnostic prend une importance primordiale. On le réalise de la même façon que la séro-agglutination de Wright, au moyen d'une suspension de Fr. tularensis récoltée sur milieu solide et tuée. Le sérodiagnostic est cependant positif qu'après deux semaines de maladie[10].
Diagnostic microbiologique
Les prélèvements biologiques pour le laboratoire de bactériologie à effectuer lors d’une suspicion de tularémie sont :
- prélèvement de sérosités au point d’inoculation
- prélèvement d’exsudats oculaires ou pharyngés
- examens des crachats, du liquide pleural
- hémoculturesLe laboratoire doit être prévenu de la suspicion du diagnostic de tularémie, afin de pratiquer l’ensemencement des prélèvements sur milieux spéciaux, et surtout afin de manipuler les liquides biologiques infectés avec la plus grande précaution en raison des risques de contamination.
Examen direct
Il est rarement positif à partir de la ponction ganglionnaire. La coloration de Gram est difficile et révèle un très fin coccobacile à Gram négatif, immobile.
Cultures bactériennes
Elles permettent l’isolement de la bactérie à partir des liquides biologiques prélevés (sang, crachats, sérosités, ponctions...). L’identification est d’abord présomptive, appuyée sur la discordance de croissance en aérobiose entre une gélose nutritive et une gélose chocolat supplémentée. Quelques caractères d’orientation peuvent aider au diagnostic : catalase faible et oxydase négative. L’isolement de la bactérie dans le sang après hémocultures est rare. Seulement 20 cas sont rapportés dans la littérature et la plupart sont décrits aux États-Unis. Seulement deux cas de bactériémies dus au type B de F. tularensis ont été rapportés en Europe. La bactériémie peut être observée en association avec toutes les formes cliniques de tularémie.
Immunofluorescence directe
La bactérie peut être identifiée par immunofluorescence directe sur des sécrétions ou par immunohistochimie sur des prélèvements anatomopathologiques, mais ces techniques ne sont pas disponibles en routine.
Sérologie
Le diagnostic sérologique est la méthode le plus fréquemment positive, mais ne permet qu’un diagnostic rétrospectif. Il existe des méthodes d’agglutination ou d'immunoabsorption. Ces réactions ont une spécificité médiocre, en particulier à la phase initiale. La sérologie ne se positive qu’au dixième jour d’évolution et il existe des réactions croisées avec les gènes Brucella, Proteus et Yersina. La sérologie peut rester positive pendant 10 ans et une ascension significative du taux d’anticorps doit être observée pour poser le diagnostic d’infection aiguë.
Amplification par polymérisation en chaîne
L’amplification génique par polymerase chain reaction (PCR) de l’acide désoxyribonucléique de F.Tularensis est possible mais encore peu utilisée. Elle peut être pratiquée pour un diagnostic précoce lors d’une très forte présomption clinique. Cette méthode permet un diagnostic rapide et évite les risques de contamination liés aux cultures bactériennes. Récemment, une technique de PCR applicable sur des tissus fixés a été développée. Cette technique pourrait permettre le diagnostic de formes atypiques de tularémie sur des biopsies d’organes infectés.
Intradermoréaction à la tularine
L’intradermoréaction à la tularine permettait de réaliser un diagnostic relativement précoce (positive dès le cinquième jour après le début des signes). La commercialisation par l'Institut Pasteur Production d’une préparation pour intradermo-réaction, la tularine, ne se fait plus en France depuis 1976.
Traitement
Le traitement par antibiotiques est empirique, la difficulté de culture du germe ne rendant guère possible un antibiogramme.
Le traitement consiste en une antibiothérapie par cyclines (antibiotiques) ou par fluoroquinolones[12] associés à un aminoside (comme la gentamicine[13]) pendant 14 jours.
L’hospitalisation des patients dépend de la sévérité clinique et du sous-type de F. tularensis présumé responsable de la symptomatologie. Le ministère de la santé français recommande cependant l’hospitalisation de tout malade symptomatique. Aucun cas de transmission interhumaine de tularémie n’a été décrit et l’isolement des malades n’est pas nécessaire.
La streptomycine et la gentamicine sont bactéricides contre F. tularensis et sont actuellement les molécules antibiotiques de choix pour le traitement de la tularémie. Des traitements alternatifs ont été proposés, même si les données cliniques manquent pour valider formellement ces thérapeutiques. Ainsi, les fluoroquinolones ont montré avoir une bonne bactéricidie contre F. tularensis. La ciprofloxacine et la doxycycline ont été administrées avec succès dans de nombreux cas.
Le ministère de la santé français recommande un traitement oral pour les malades présentant une forme clinique modérée et un traitement intraveineux pour les malades devant être hospitalisés. Le traitement recommandé repose sur une fluoroquinolone (par exemple, ciprofloxacine 500 mg deux fois par jour, ou ofloxacine 400 mg deux fois par jour) ou la doxycycline (100 mg deux fois par jour) en monothérapie pendant 14 jours.
Dans les formes sévères de la tularémie, on associe deux antibiotiques, par exemple un aminoside et une fluoroquinolone.
Aux Etats-Unis, il existe un vaccin.
Prophylaxie
- Surveillance dans l'importation de gibier pour repeupler les chasses.
- Précaution dans les manipulations d'animaux malades. Ceci vaut également au laboratoire où ce germe donne facilement des infections accidentelles.
Surveillance sanitaire
En France, la déclaration obligatoire de la tularémie humaine avait été supprimée en 1986. Elle a été réinstaurée en 2002 (Circulaire DGS/SD 5 n °2002-492 du relative à la transmission obligatoire de données individuelles à l’autorité sanitaire en cas de tularémie[14]). La surveillance épidémiologique de la tularémie en France repose donc sur la notification obligatoire des cas et sur l’envoi de la souche isolée au Centre national de référence de la tularémie au laboratoire de l’Unité zoonoses bactériennes de l’Agence française de sécurité sanitaire des aliments (AFSSA) à Maisons-Alfort. Tout médecin ou biologiste ayant connaissance d’un ou de plusieurs cas humains de tularémie doit impérativement alerter le médecin inspecteur de santé publique de l'Agence Régional de Santé (ARS), au service veille sanitaire en passant par le Point Focal Régional (PFR). Celui-ci doit immédiatement en informer l’Institut national de veille sanitaire (INVS) qui diligente une enquête épidémiologique. En cas de doute sur l’utilisation à une fin terroriste de F. tularensis, le procureur de la république doit être saisi.
La tularémie est classée comme danger sanitaire de seconde catégorie pour les espèces animales dans la législation française[15]. La surveillance dans la faune sauvage, principalement le Lièvre d'Europe est faite par le Réseau SAGIR et le laboratoire de santé animale de Maisons-Alfort de l'Anses. Entre 2002 et 2013, le nombre de cas confirmés variait entre 41 et 121 par an[16]. La majorité des cas sont des Lièvres d'Europe, mais des cas sont également décrits chez le Lapin de Garenne, le Chevreuil et le Sanglier[16].
Divers
Vu sa propriété de traverser la peau intacte, Francisella tularensis a été (ou est encore) une arme bactériologique possible. La faible dose infectante (de 10 à 50 bactéries), la possibilité d’une contamination par voie inhalée et la sévérité des infections par F. tularensis font de cette bactérie un agent potentiellement utilisable dans le cadre d’un acte de bioterrorisme. Ainsi, la bactérie a été classée par le Center for Disease Control (CDC) dans la catégorie A des agents potentiels de bioterrorisme, avec les agents de la maladie du charbon (Bacillus anthracis), de la variole, des fièvres hémorragiques virales, de la peste (Yersinia pestis), et de la toxine botulique.
En France, la tularémie fait partie des Maladies infectieuses à déclaration obligatoire depuis 2002[17] et depuis 2011 des dangers sanitaires de 2e catégorie[18]. La tularémie, sous toutes ses formes cliniques, est inscrite au tableau des maladies professionnelles sous le numéro 68 pour le régime général, et sous le numéro 7 pour le régime agricole[19].
Au Québec, elle est une maladie à déclaration obligatoire.
Notes et références
- Gwenaël Vourc'h et al., Les zoonoses : Ces maladies qui nous lient aux animaux, Éditions Quæ, coll. « EnjeuxScience », (ISBN 978-2-7592-3270-3, lire en ligne), Qui nous transmet quoi et comment ?, « Comment les zoonoses se transmettent-elles ? », p. 47, accès libre.
- (en) Siro Igino Trevisanato, « The ‘Hittite plague’, an epidemic of tularemia and the first record of biological warfare », Medical Hypotheses, vol. 69, no 6, , p. 1371-1374 (lire en ligne)
- Francis E, Tularemia, JAMA, 1925;84:1243-1250
- Evelyne Moulin, La chasse est mauvaise pour la santé : les chasseurs nous empoisonnent-ils ?, Ardenais, Asclépiades, , 104 p. (ISBN 978-2-915238-35-8)
- Feldman KA, Enscore RE, Lathrop SL et al. An outbreak of primary pneumonic tularemia on Martha’s Vineyard, N Engl J Med, 2001;345:1601-1606
- Ellis J, Oyston PC, Green M, Titball RW, Tularemia, Clin Microbiol Rev, 2002;15:631-646
- Jones CL, Napier BA, Sampson TR, Llewellyn AC, Schroeder MR, Weiss DS, Subversion of host recognition and defense systems by Francisella spp, Microbiol Mol Biol Rev, 2012;76:383-404
- Kugeler KJ, Mead PS, Janusz AM et al. Molecular epidemiology of Francisella tularensis in the United States, Clin Infect Dis, 2009;48:863-870
- Weber IB, Turabelidze G, Patrick S, Griffith KS, Kugeler KJ, Mead PS, Clinical recognition and management of tularemia in Missouri: a retrospective records review of 121 cases, Clin Infect Dis, 2012;55:1283-1290
- James J, Kaul DR, Goldberger ZD, Saint S, Skerrett SJ, Back to nature, N Engl J Med, 2015;373:2271-2276
- Petersen JM, Schriefer ME, Gage KL et al. Methods for enhanced culture recovery of Francisella tularensis, Appl Environ Microbiol, 2004;70:3733-3735
- Pérez-Castrillón JL, Bachiller-Luque P, Martín-Luquero M, Mena-Martín FJ, Herreros V, Tularemia epidemic in northwestern Spain: clinical description and therapeutic response, Clin Infect Dis, 2001;33:573-576
- Enderlin G, Morales L, Jacobs RF, Cross JT, Streptomycin and alternative agents for the treatment of tularemia: review of the literature, Clin Infect Dis, 1994;19:42-47
- « Bulletin Officiel n�2002-41 », sur solidarites-sante.gouv.fr (consulté le )
- Arrêté du 29 juillet 2013 relatif à la définition des dangers sanitaires de première et deuxième catégorie pour les espèces animales (lire en ligne)
- (en) Marie Moinet, Anouk Decors, Christiane Mendy et Eva Faure, « Spatio-temporal dynamics of tularemia in French wildlife: 2002–2013 », Preventive Veterinary Medicine, vol. 130, , p. 33–40 (DOI 10.1016/j.prevetmed.2016.05.015, lire en ligne, consulté le )
- http://www.invs.sante.fr/surveillance/tularemie/index.htm Surveillance de la tulérémie en France par l'InVS.
- Décret no 2012-845 du 30 juin 2012 relatif aux dispositions générales organisant la prévention, la surveillance et la lutte contre les dangers sanitaires de première et deuxième catégorie
- « La tularémie », sur caducee.net (consulté le ).
Articles connexes
Bibliographie
- Moinet M, Decors A, Mendy C, Faure E, Durand B, Madani N. (2016) Spatio‐temporal dynamics of tularemia in French wildlife : 2002 ‐ 2013. Prev Vet Med,130: 33 ‐ 40
- Faber, M., Heuner, K., Jacob, D., & Grunow, R. (2018). Tularemia in Germany–a re-emerging zoonosis. Frontiers in Cellular and Infection Microbiology, 8, 40
Liens externes
- Ressources relatives à la santé :
- Orphanet
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) ICD-10 Version:2016
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :