Arbovirose
Les arboviroses sont des maladies virales dues à des arbovirus transmis obligatoirement par un vecteur arthropode (moustique, moucheron piqueur, tique) à des hôtes vertébrés (mammifères, oiseaux), d'où leur nom de l'anglais : ARthropod-BOrne virus (litt. virus transmis par les arthropodes).
.jpg.webp)
On connait plus de 600 arbovirus, dont près de 150 déterminent des manifestations cliniques chez l'humain. Les arboviroses représentent, du point de vue virologique et clinique, un groupe hétérogène de maladies. Trois types de manifestations cliniques sont schématiquement distingués : affections à dominante douloureuse et fébrile (comme le chikungunya), à dominante hémorragique (comme la fièvre jaune) et à dominante neurologiques (comme l'encéphalite à tique).
Ces arboviroses sont le plus souvent en expansion mondiale, liée à une évolution des arbovirus et à des facteurs climatiques et anthropiques. Celles qui concernent le plus les voyageurs internationaux sont la dengue, le Zika et le Chikungunya, en Asie, Amérique tropicale et Caraïbes.
Il n'existe pas de traitement spécifique d'une arbovirose, le traitement est symptomatique. Les vaccins sont le plus souvent indisponibles, à l'exception de ceux pour la fièvre jaune, l'encéphalite à tiques et l'encéphalite japonaise, d'où l'importance d'une prévention collective et individuelle.
Historique
La notion d'arthropode-vecteur et de maladie à transmission vectorielle apparait vers la fin du XIXe siècle, avec la découverte du rôle du moustique dans la filariose (Patrick Manson en 1877) et le paludisme (Ronald Ross en 1897), et celui de la tique dans la babésiose (Theobald Smith en 1893)[1].

La première maladie humaine à être reconnue ultérieurement comme une arbovirose est la fièvre jaune : le rôle vecteur du moustique est démontré par Walter Reed en 1900, et le virus isolé par Adrian Stockes en 1927[1]. Selon Georges Canguilhem « Il est bien vrai qu'en élucidant le mode de diffusion de la fièvre jaune, on a modifié la figure de la Mort. Sur la carte de la Terre on sait délimiter les lieux où la Mort a des ailes »[2].
La première partie du XXe siècle a été appelée « l'âge d'or de l'entomologie médicale », où les chercheurs complètent rapidement « un véritable tableau de Mendeleiev tropical ». Une communauté internationale de naturalistes (zoologues et microbiologistes, médecins et vétérinaires... en collaboration ou en rivalité), parvient ainsi à élaborer une théorie de la transmission vectorielle. Celle-ci est perçue désormais comme évidente, mais la construction et la démonstration de cette théorie ne furent pas aussi simples[3].
En 1930, six virus sont connus comme circulant entre un hôte et un arthropode-vecteur (moustique, moucheron, ou tique). Celui de la fièvre jaune est alors le seul connu pour affecter les humains. Les cinq autres sont responsables d'épizooties chez les animaux domestiques : la fièvre catarrhale ovine, la maladie du mouton de Nairobi, le Louping ill (en) (encéphalite virale du mouton), la stomatite vésiculaire, et la peste porcine africaine[4].
En 1960, plus d'une centaine d'arboviroses sont identifiées, surtout à partir des animaux d'élevage. Outre la fièvre jaune, trois arboviroses humaines ont été reconnues aux États-Unis : le complexe des encéphalites équines, la fièvre à tiques du Colorado, et la dengue[4].
En 1985, l'International Catalogue of Arboviruses répertorie près de 520 arbovirus dans le monde, dont près de 125 associés à une maladie, une centaine pouvant toucher aussi l'humain[5]. Le taux de découvertes des arbovirus dans les années 1950-1980 reflète l'activité de la recherche mondiale : Fondation Rockefeller, agences gouvernementales et centres universitaires[4].
Cycle biologique
Les arboviroses sont des zoonoses : des infections d'animaux sauvages ou domestiques, susceptibles de se transmettre à l'humain (anthropozoonose). Pour exister dans une région et s'y maintenir de façon permanente, le virus doit être constamment en circulation dans un cycle biologique entre vecteurs (arthropodes) et hôtes (vertébrés).
Dans les conditions de la vie sauvage, le cycle biologique hôtes-vecteurs est le plus souvent inapparent (sans symptômes) par adaptation réciproque au cours d'une coévolution. Lorsque l'humain et ses animaux domestiques entrent dans ce cycle, ils constituent des hôtes accidentels plus sensibles, avec un risque plus élevé d'arbovirose-maladie[6].
La plupart du temps les cas infestés sont peu ou non-symptomatiques, et passent inaperçus. L'immunisation suit l'infestation, même en cas de maladie asymptomatique.
Virus
Presque tous les virus d'arboviroses sont des virus à ARN (les Iridoviridae faisant exception en étant à ADN). Pour les autres caractéristiques ils sont très variés. Leurs dimensions varient de 43 nm (flavivirus, exemple fièvre jaune) à 215 nm (Iridoviridae, exemple peste porcine africaine) ; ils peuvent avoir une forme sphérique comme les bunyaviridae, en obus comme les rhabodviridae, en icosahèdre comme les iridoviridae. Ils peuvent être enveloppés ou non enveloppés[1].
En 2009, on dénombre plus de 600 arbovirus, appartenant à plus d'une dizaine de familles. La plupart sont dits « orphelins », par manque de démonstration d'un cycle biologique ou d'un lien causal avec une maladie[7].
Près de 150 arbovirus sont pathogènes pour l'humain[8], et les principales familles pouvant comporter ces arbovirus sont[9] :
- les Togaviridae, comme le virus du chikungunya ;
- les Bunyaviridae, comme le virus de la fièvre de la vallée du Rift ;
- les Reoviridae, comme le virus de la fièvre à tiques du Colorado ;
- les Rhabdoviridae, comme le virus de la stomatite vésiculaire ;
- les Flaviviridae, comme le virus de la fièvre jaune.
Par définition, les arbovirus infectent les vertébrés. Les virus de plantes, dont certains sont à transmission vectorielle (par exemple pucerons ou autres insectes suceurs de sève), n'en font pas partie[10].
On ne sait pas comment, au cours de l'évolution, les arbovirus ont acquis cette capacité à infecter deux phylums aussi différents (arthropodes et vertébrés)[1]. Le fait que les arbovirus soient presque tous des virus à ARN, dotés d'un taux de mutation plus élevé que ceux à ADN, a donné à penser que les arbovirus à ARN ont pu évoluer vers une réplication alternée entre deux hôtes invertébré et vertébré[11]. Néanmoins ce taux de mutation reste en dessous de celui des virus à ARN infectant un seul hôte, aussi d'autres auteurs suggèrent que l'évolution des arbovirus serait sous une contrainte : seules les mutations permettant cette alternance entre deux hôtes seraient conservées[6].
Vecteurs
Les principaux vecteurs d'arboviroses sont en très grande majorité des moustiques (anophèle, aedes et culex), puis des moucherons piqueurs (culicoïdes, phlébotomes...), et des tiques (ixodidae et argasidae)[12] - [13].
Les arbovirus sont le plus souvent spécifiques et adaptés à certains arthropodes vecteurs hématophages. Par exemple, le virus de la dengue infecte principalement l'humain, essentiellement par le moustique Aedes aegypti, alors que le virus du Nil occidental infecte plus de 60 espèces de moustiques et 360 espèces d'oiseaux différents.
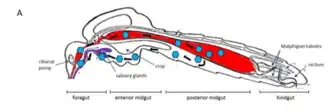
Le virus ingéré doit se multiplier dans les cellules du vecteur (ce qui peut prendre plusieurs jours) pour atteindre une concentration suffisante, notamment dans la salive du vecteur. Le vecteur devient alors infectant pour le prochain hôte au repas suivant. Ceci caractérise la période extrinsèque (par rapport à l'hôte) d'un cycle biologique de transmission[1].
En principe la transmission mécanique de virus (par exemple moustique vu comme une simple seringue volante) ne s'observe pas dans la nature, mais peut être réalisée dans des conditions de laboratoire (transmission expérimentale)[1]. Il existe de rares exceptions, comme le virus de la myxomatose (transmission mécanique entre lapins et moustiques, puces ou tiques) qui n'est pas considéré dès lors comme un arbovirus[10] ; de même dans la transmission à l'humain ou au bétail, le rôle de mouches du genre stomoxe comme vecteur mécanique de virus est en discussion[14].
Les conditions climatiques (notamment la température de l'air et les pluies) ont une grande influence sur la rapidité du cycle, en intervenant sur l'activité et la survie des arthropodes vecteurs[15].
Lors de conditions défavorables (par exemple, pour les moustiques, saison froide en zone tempérée ou saison sèche en zone tropicale), le virus peut survivre dans des vecteurs femelles hibernantes ou chez des hôtes en hibernation. Une autre façon de survivre est la transmission transovarienne ou transmission verticale d'une femelle à ses œufs, lesquels peuvent être mis en diapause[15].
Au XXIe siècle, la notion de « vecteur » tend à être remplacée par des concepts plus précis tels que « hôte-vecteur » (puisque le vecteur héberge une multiplication virale) ou « vecteur-réservoir » (lorsque le vecteur est infesté pour toute sa vie en transmettant le virus à sa descendance)[16].
Hôtes
Le cycle biologique de transmission nécessite des hôtes vertébrés (période intrinsèque) qui réagissent différemment selon leur espèce. Par exemple, l'arbovirus de la fièvre jaune déclenche une maladie grave chez les humains, singes sud-américains, souris de laboratoire... et des formes asymptomatiques chez les singes africains, chiens, chats, vaches et chevaux. Celui de l'encéphalite équine de l'Est produit une maladie grave chez le cheval et l'humain, mais pas chez les ruminants et les carnivores infectés[1]. Celui de la fièvre catarrhale infecte surtout les moutons, parfois les bovins, mais pas les humains.
Le virus doit se multiplier à nouveau chez l'hôte pour atteindre une virémie suffisante, susceptible d'infecter un arthropode vecteur venant se nourrir sur l'hôte. Dans ce cas, l'hôte est dit amplificateur, participant activement au cycle de transmission.
Un cycle biologique de transmission comporte donc une période d'incubation intrinsèque (multiplication virale chez l'hôte) et une période d'incubation extrinsèque (multiplication virale chez le vecteur). L'intervalle minimum de temps représentant le passage de l'infection d'un hôte vertébré à l'hôte vertébré suivant est la somme de ces deux périodes. Cet intervalle minimum est le plus souvent d'une semaine ou plus, et l'intervalle maximum peut aller jusqu'à plusieurs mois[1].
Il existe trois mécanismes de transmission des arboviroses humaines, qui peuvent se superposer[6] - [17] :
- Contamination accidentelle directe : animal sauvage → vecteur → humain, l'humain est ici une impasse épidémiologique.
- Contamination indirecte : animal domestique → vecteur → humain, l'humain est aussi en impasse épidémiologique.
- Contamination avec humain amplificateur : humain → vecteur → humain. Ici l'humain participe activement au cycle épidémique, d'autant plus que le vecteur est anthropophile ou adapté au biotope urbain.
Un cas humain en impasse épidémiologique peut se manifester individuellement par une forme sévère, mais du point de vue de santé publique, ce sont les cycles épidémiques avec humain amplificateur qui posent les problèmes les plus graves. Cinq grandes arboviroses humaines sont susceptibles de présenter de tels cycles, le plus souvent appelés cycles urbains : fièvre jaune, dengue, nil occidental, chikungunya et zika[6].
Épidémiologie des arboviroses
.jpg.webp)
Les arboviroses évoluent selon deux modes. Le mode endémique, éventuellement avec poussée saisonnière, représente un état relatif d'équilibre, alors que le mode épidémique, de survenue imprévisible, représente une aggravation rapide et brutale avec extension géographique. Ces changements seraient liés aux conditions climatiques (température de l'air, pluies…) et à des facteurs anthropiques (mouvements et densité de population, biotope urbain, élevage et commerce de bétail…)[15] - [6].
Les arboviroses se répartissent selon des zones géographiques correspondant à l'écosystème de l'arthropode-vecteur et d'éventuels réservoirs animaux. Elles sont cosmopolites : plus fréquentes et plus graves dans les pays tropicaux, elles peuvent exister en zone tempérée, voire en zone froide. Par exemple, le virus de l'encéphalite à tiques a été retrouvé à 300 km au sud du cercle arctique[7].
Les arboviroses humaines sont en pleine expansion mondiale. Les années 2000 ont été marquées par l'installation du virus du Nil occidental en Amérique du nord, et l'extension de la dengue, du chikungunya et du virus Zika dans de nouvelles régions du monde[18].
En France métropolitaine, dans les années 1970, on ne connaissait que deux sites d'implantation d'arboviroses autochtones : l'Alsace avec l'encéphalite à tique, la Camargue avec le virus du Nil occidental et le virus Tahyna (non ou peu pathogène pour l'humain)[19]. Depuis, un phlébovirus responsable de la fièvre à phlébotome est aussi présent dans le midi de la France, tandis que le virus Avalon, du nom d'Avalon, est un bunyavirus transmis par tique et découvert en Bretagne[9].
En 2006, une épidémie de 300 cas de Chikungunya a touché l'Italie. En France, depuis 2010, plusieurs cas groupés autochtones de dengue et de chikungunya, ont été rapportés dans le sud de la France. Ces micro-épidémies sont liées à l'invasion du moustique vecteur Aedes albopictus (communément appelé « moustique tigre ») capable de s'adapter au biotope urbain en zone tempérée[9] - [18].
| Alphavirus | Flavivirus | autres | |
|---|---|---|---|
| Europe non méditerranéenne, ex-URSS, Inde | Sindbis | Fièvre du Nil occidental Encéphalite à tiques Maladie de la forêt de Kyasanur Fièvre hémorragique d'Omsk | Fièvre catarrhale Fièvre hémorragique de Crimée-Congo |
| Bassin méditerranéen, Moyen-Orient | Sindbis Chikungunya | Fièvre du Nil occidental Dengue | Fièvre à phlébotomes Fièvre catarrhale |
| Afrique tropicale | Chikungunya O'Nyong-Nyong | Fièvre jaune Fièvre du Nil occidental Dengue Infection à virus Zika | Fièvre hémorragique de Crimée-Congo Fièvre de la vallée du Rift Peste porcine africaine Fièvre catarrhale |
| Extrême-Orient, Pacifique | Chikungunya Ross River | Encéphalite japonaise Dengue Encéphalite de la Murray Valley Infection à virus Zika | |
| Amériques | Chikungunya Mayaro | Fièvre jaune Fièvre du Nil occidental Encéphalite de Saint Louis Dengue Rocio | Encéphalite de Californie Oropouche Fièvre à tiques du Colorado Stomatite vésiculaire |
Les arboviroses qui concernent le plus les voyageurs internationaux sont la dengue, le Zika et le Chikungungunya, en Asie, Amérique tropicale et Caraïbes[9].
Physiopathologie
Dans une première phase, les arbovirus sont captés par le système réticulo-endothélial. Ils se multiplient ainsi dans les monocytes-macrophages. C'est la phase de virémie. En règle générale, l'infection est contrôlée et reste le plus souvent asymptomatique.
Dans les formes graves, lors d'une seconde phase, le virus gagne les organes cibles où il provoque une inflammation de la paroi des petits vaisseaux (microvascularite diffuse), avec des manifestations cliniques telles qu'une encéphalite ou une hépatonéphrite (association d'une atteinte hépatique et rénale). Il peut entrainer une fuite plasmatique (comme dans la dengue) ou des troubles de la coagulation (thrombopénie, CIVD) dans le cas d'une fièvre hémorragique[9] - [20].
Manifestations cliniques
L'incubation est courte, de 1 à 15 jours. En dehors des formes asymptomatiques, il existe un début commun à toutes les arboviroses : le plus souvent un syndrome grippal avec fièvre élevée, céphalées frontales, douleurs musculaires et articulaires, et malaise général pendant quelques jours. Dans la majorité des cas, ces manifestations disparaissent.
Parfois, la maladie se prolonge ou réapparait après une courte rémission. Trois formes classiques sont alors distinguées : les formes éruptives, hémorragiques et encéphaliques. Cette présentation est commode, mais artificielle, car en pratique elles s'associent ou se superposent dans la plupart des arboviroses[9] (celles qui sont citées ci-après ne sont que des exemples caractéristiques).
Formes algo-éruptives, syndrome dengue-like

Elles se caractérisent par l'intensité des douleurs et de l'éruption. Les plus importantes sont :
- La dengue, Flaviridae, transmise par Aedes aegypti ou Aedes albopictus, sévit en zone intertropicale (Amérique centrale, du Sud, Asie, Océanie, et avec une moindre incidence en Afrique).
- Le chikungunya, Alphaviridae, transmis par Aedes Aegypti ou Aedes Albopictus, sévit en Afrique et en Asie et depuis 2005, et apparaît avec une forte incidence sur l'île de la Réunion en 2005 et sur des îles voisines, ainsi qu'en Inde.
- Le zika.
Formes hémorragiques
Parmi les plus importantes :
- la fièvre jaune, Flaviridae,à réservoir selvatique (singe), transmise par Aedes aegypti, est présente en Afrique, en particulier l'Afrique de l'Ouest forestière, mais épargne l'Asie et l'Océanie.
- la fièvre hémorragique de Crimée-Congo, transmise par la piqûre de tiques, est épidémique en Afrique, endémique en Europe Centrale. Elle est transmissible.
Formes encéphalitiques
Parmi les plus importantes :
- L'encéphalite à tiques, par Flavivirus (pouvant sévir en France, en Alsace et en Lorraine), est transmise par piqûre de tique dans les zones forestières ou broussailleuses. Après un syndrome grippal, apparaît dans un cas sur trois une méningite ou une méningo-encéphalite ;
- l'encéphalite japonaise, limitée à l'Asie (du Japon à l'Inde), transmise par un diptère de genre Culex, sévit en zone rurale, à proximité des rizières ou dans les zones d'élevage de porcs. La présentation est rarement symptomatique mais souvent grave dans ce cas-là.
- le virus du Nil occidental, Flaviridae, transmis par un Culex. Il est présent en Amérique du Nord. La présentation est rarement symptomatique, mais dans ce cas souvent grave. Une épidémie de 7 cas humains a été repérée en France en 2003 en bordure méditerranéenne, dans la région de Fréjus-Saint-Raphaël[21].
Manifestations chroniques
Elles sont variables selon l'arbovirose. Par exemple la dengue donne, dans 10 % des cas symptomatiques, une fatigue chronique, mais pas d'autres manifestations chroniques. Alors que le chikungunya peut laisser des douleurs articulaires persistantes, et le Zika des atteintes neurologiques fœtales (microcéphalie) chez la femme enceinte. Un risque accru de syndrome de Guillain-Barré est aussi signalé[17] - [22].
Diagnostic des arboviroses
On observe souvent une leucopénie et une lympho-monocytose. Selon le contexte, un bilan de la coagulation, des fonctions hépatiques et rénales peut être nécessaire.
En pratique, l'isolement du virus est possible, mais réservé à des laboratoires spécialisés, à partir du sang, du liquide cérébrospinal pendant les 2 à 3 premiers jours de la maladie, car la virémie est précoce et très brève[9], se terminant entre le 4e et 8e jour de la maladie.
Dans la majorité des cas, le diagnostic est essentiellement sérologique, à partir de prélèvement de sang ou de liquide cérébrospinal. Les titres d'anticorps IgG et IgM sont mesurés sur des paires de prélèvements sanguins effectués au début de la maladie et 10 à 20 jours plus tard, le plus souvent par la méthode immuno-enzymatique ELISA.
Des réactions sérologiques croisées entre différentes arboviroses, par exemple entre dengue et chikungunya, sont possibles. Cependant, des co-infections le sont également[9].
La PCR sur des prélèvements de sang ou autres liquides biologiques tend à remplacer les autres méthodes d'isolement et de culture tels que l'inoculation au souriceau, à des cultures de cellules de moustiques ou de singe, etc. où le virus est identifié par des réactions immunologiques spécifiques.
Traitement

Il n'existe pas de traitement spécifique, le traitement est uniquement symptomatique, d'où l'importance de la prévention.
La lutte antivectorielle est collective (salubrité urbaine, démoustication) et individuelle (protection contre les moustiques, répulsifs, élimination des gîtes larvaires à proximité du domicile).
En France, la dengue, le zika et le chikungunya confirmés sont des maladies à déclarations obligatoire.
Des vaccins efficaces existent pour trois arboviroses : fièvre jaune, encéphalite à tique et encéphalite japonaise[9].
Bibliographie
- Gérard Duvallet, Entomologie médicale et vétérinaire, Marseille, Versailles, IRD - QUAE, (ISBN 978-2-7099-2376-7).
Notes et références
- (en) Kenneth F. Kiple (dir.) et Wilbur G. Downs, The Cambridge World History of Human Disease, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), chap. VIII.10 (« Arboviruses »), p. 587-595.
- François Delaporte (préf. Georges Canguilhem), Histoire de la fièvre jaune : naissance de la médecine tropicale, Paris, Payot, coll. « Médecine et sociétés », , 182 p. (ISBN 2-228-88223-2), p. 13.
- Gérard Duvallet 2017, p. 128.
- (en) Joshua Lederberg, Emerging Infections, National Academy Press, (ISBN 0-309-04741-2), p. 45.
- (en) Stephen S. Morse (dir.) et Thomas P. Monath, Emerging Viruses, New York/Oxford, Oxford University Press, , 317 p. (ISBN 0-19-507444-0), chap. 13 (« Arthropod-Borne Viruses »), p. 138.
- Gérard Duvallet 2017, p. 270-272.
- Gérard Duvallet 2017, p. 134-136.
- Prescott (trad. de l'anglais), Microbiologie, Bruxelles/Paris, de boeck, , 1088 p. (ISBN 978-2-8041-6012-8), p. 922.
- E. Pilly, Maladies Infectieuses et Tropicales, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-66-9), chap. 100 (« Arboviroses »), p. 492-494.
- Gérard Duvallet 2017, p. 47.
- Scott C. Weaver et William K. Reisen, « Present and Future Arboviral Threats », Antiviral research, vol. 85, no 2, , p. 328 (ISSN 0166-3542, PMID 19857523, PMCID 2815176, DOI 10.1016/j.antiviral.2009.10.008, lire en ligne, consulté le )
- Didier Fontenille, « Les vecteurs d’arboviroses dans l’Ouest de l’Océan Indien », Institut de Recherche pour le Développement, (lire en ligne [PDF])
- Gérard Duvallet 2017, p. 48-49.
- Gérard Duvallet 2017, p. 398-400.
- « AGROPOLIS-MUSEUM - Savoirs partagés - Le virus West Nile, un arbovirus ré-émergent par Bernard Mondet », sur www.museum.agropolis.fr (consulté le )
- Gérard Duvallet 2017, p. 53.
- Scott C. Weaver, Caroline Charlier, Nikos Vasilakis et Marc Lecuit, « Zika, Chikungunya, and Other Emerging Vector-Borne Viral Diseases », Annual Review of Medicine, vol. 69, 01 29, 2018, p. 395–408 (ISSN 1545-326X, PMID 28846489, PMCID 6343128, DOI 10.1146/annurev-med-050715-105122, lire en ligne, consulté le )
- M.-C. Paty, « L'expansion des arboviroses dans le monde, un défi aussi pour le Nord », Bulletin de la Société de Pathologie Exotique, , p. 333. (lire en ligne)
- P. Pène, « Les arboviroses observées en France », La Revue du Praticien, vol. 29, no 27, , p. 2229-2232.
- « Virus de la rage, arbovirus, autres virus dits émergents », Cours de la faculté de médecine Pierre et Marie Curie, ? (lire en ligne)
- Armengaud A., « Surveillance du virus West Nile en France dans les départements du pourtour méditerranéen, 2003-06. », sur www.santepubliquefrance.fr, Bulletin Epidémiologique Hebdomadaire, (consulté le ), p. 266.
- F. Simon, « Manifestations chroniques des arboviroses », Bulletin de la Société de Pathologie Exotique, , p. 332. (lire en ligne)