Phytovirus
Un phytovirus, ou virus de plantes, est un virus s'attaquant aux organismes végétaux. Ces virus ont la particularité de pénétrer la cellule végétale de leur hôte afin de détourner à leur profit les mécanismes de la cellule et leur permettre de se reproduire.


Cette multiplication virale finit par provoquer une modification métabolique ou la destruction de la cellule. La prolifération des virus à l’intérieur des tissus végétaux peut dans certains cas n’entraîner aucun symptôme visible dans un premier temps (phénomène de masquage), mais très souvent les attaques virales se manifestent par des symptômes tels que des mosaïques, des marbrures ou des fasciations.
Les lignées de virus végétaux ont évolué indépendamment les unes des autres : comme la plupart des endoparasites, les virus se multiplient en vase clos dans leurs hôtes. L’évolution en parallèle des souches virales et des hôtes résistants (coévolution) est à l’origine d’une grande spécialisation des virus vis-à-vis de leur hôte. Des virus sont ainsi capables de n’attaquer qu’une seule espèce ou une seule famille de végétaux. Le virus de la mosaïque du tabac par exemple, est capable d’attaquer la plupart des plantes appartenant uniquement à la famille des Solanacées (tomate, tabac, aubergine, etc.)
Histoire
Bien avant que l'existence des virus soit connue, la première évocation d'une maladie virale chez les plantes est due à l'impératrice japonaise Kōken, qui, dans un poème écrit en 752, décrit le jaunissement des feuilles d’une eupatoire, Eupatorium lindleyanum. Ce jaunissement est maintenant identifié comme un symptôme d’Eupatorium vein yellow virus[1]. Plus près de nous, en 1576, Charles de L'Écluse décrivit des fleurs de tulipe anormales, aux couleurs panachées ou bigarrées, très appréciées des amateurs, et qui ont vite entraîné la « tulipomanie » au XVIIe siècle. Ces fleurs étaient en fait virosées, infectées par le virus de la panachure de la tulipe[1]. On s'est rendu compte que le rendement de ces tulipes était diminué et la taille des fleurs réduites, et que ces particularités se transmettaient par greffe du bulbe[2].
Dans les années 1770, une maladie s'est développée dans les cultures de pommes de terre en Europe, marquée par un symptôme d'« enroulement » des feuilles, et entraînant une forte réduction des rendements. Cette maladie s'aggravait d'année en année et déclencha un longue controverse, certains attribuant les causes de la maladie au climat ou au sol, d'autres à une forme de dégénérescence des plantes due à une trop longue séquence de multiplication végétative. On sait maintenant que cette maladie est due à un complexe de virus, dont le PLRV et le PVX[3].
La découverte de virus végétaux provoquant des maladies chez les plantes est souvent attribuée au chimiste allemand, Adolf Mayer (en 1892) qui faisait ses recherches aux Pays-Bas. Il a démontré que la sève obtenue à partir de feuilles de tabac présentant des symptômes de mosaïque provoquait les mêmes symptômes lorsqu'elle était injectée dans des plantes saines[4]. Cependant, l'agent infectieux était détruit lorsqu'on faisait bouillir la sève. Il pensait que l'agent causal était une bactérie. Cependant, après une inoculation plus importante avec un grand nombre de bactéries, il n'a pas pu provoquer l'apparition de symptôme de mosaïque.
En 1898, Martinus Willem Beijerinck, professeur de microbiologie à l'Université technique des Pays-Bas, a avancé ses conceptions selon lesquelles les virus étaient petits et a déterminé que la « maladie de la mosaïque » restait infectieuse lorsqu'elle passait à travers une bougie filtrante Chamberland en porcelaine[4]. Cela excluait que l'agent causal de la maladie soit assimilable à des micro-organismes du type bactéries, qui eux étaient retenus par le filtre. Martinus Beijerinck a qualifié le filtrat infectieux de contagium vivum fluidum, d'où il a forgé le terme moderne de « virus »[5].
Après la découverte initiale du « concept viral », on ressentit le besoin d'une classification de toute nouvelle maladie virale basée sur le mode de transmission, même si les observations au microscope se sont révélées vaines. En 1939, Francis Oliver Holmes publia une première classification comprenant une liste de 129 virus végétaux. Cette classification s'est étendue par la suite et en 1999, il y avait 977 espèces de phytovirus reconnues officiellement, auxquelles s'ajoutaient un certain nombre d'espèces « provisoires ».
La purification (cristallisation) du virus de la mosaïque du tabac (TMV) fut réalisée pour la première fois par Wendell Meredith Stanley, qui publia sa découverte en 1935, bien qu'il ne put déterminer que c'est l'ARN qui constituait le matériel infectieux. Il reçut toutefois le prix Nobel de chimie en 1946. Dans les années 1950, une découverte, faite simultanément par deux laboratoires, démontra que l'ARN purifié du TMV était infectieux, ce qui renforça l'argument. C'est l'ARN qui porte l'information génétique permettant de coder la production de nouvelles particules infectieuses.
Plus récemment, la recherche sur les virus s'est focalisée sur la compréhension de la génétique et de la biologie moléculaire du génome des phytovirus, avec un intérêt particulier pour comprendre comment le virus peut se répliquer, se déplacer et infecter les plantes. La compréhension de la génétique des virus et des fonctions des protéines a servi aux sociétés de biotechnologie pour explorer les applications commerciales possibles. En particulier, les séquences dérivées des virus ont permis de découvrir des formes originales de résistance. Les développements technologiques récents permettant à l'homme de manipuler les phytovirus peuvent déboucher sur de nouvelles stratégies pour la production de protéines à valeur ajoutée par les plantes.
Structure
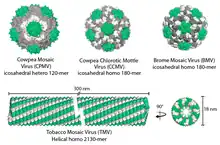
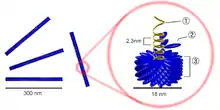
1=acide nucléique - 2=capsomère - 3=capside.
Les particules virales, ou virions, sont composées d'un acide nucléique, ARN ou ADN (le génome) enveloppé d'une coque protéique, la capside. Certains virus comportent aussi une membrane externe lipoprotéique dérivée des membranes de l'hôte. C'est la capside, composée en général, d'une seule protéine, qui détermine la forme générale du virion. Les protéines de capside sont disposées selon deux types d'arrangements :
- symétrie hélicoïdale, qui donne des virions en bâtonnets (bacilliformes) rigides ou flexueux,
- symétrie icosaédrique qui donne en général des virions de forme parasphérique[6].
L'assemblage de particules virales se fait spontanément.
Plus de 50 % des virus végétaux connus sont en forme de bâtonnet (flexueux ou rigides). La longueur de la particule dépend normalement du génome, mais elle est généralement comprise entre 300 et 500 nm avec un diamètre de 15 à 20 nm. Des sous-unités protéiques peuvent être placées à la circonférence d'un cercle pour former un disque. En présence du génome viral, les disques sont empilés, puis un tube est créé autour de l'acide nucléique génomique[7]
La deuxième structure la plus courante parmi les particules de virus végétaux sont les particules isométriques. Elles ont un diamètre de 25 à 50 nm. Dans les cas où il n'y a qu'une seule protéine d'enveloppe, la structure de base se compose de 60 sous-unités T, où T est un entier. Certains virus peuvent avoir 2 protéines d'enveloppe qui s'associent pour former une particule icosaédrique.
Chez trois genres de Geminiviridae, les particules se composent de deux particules isométriques jumelles (comme collées ensemble).
Un très petit nombre de virus végétaux ont, en plus de leurs protéines d'enveloppe, une enveloppe lipoprotéique.
Classification des phytovirus
En 2017, un millier de phytovirus étaient décrits[4] - [8].
L’organisation des phytovirus en catégories, genre et famille est essentiellement basée sur trois critères :
- la nature du matériel génétique: ADN ou ARN, mono- ou bicaténaire (un brin ou deux) ;
- le niveau d’homologie (ressemblance issue d’un ancêtre commun) des gènes. Pour ce faire, le matériel génétique de chaque virus est séquencé. Les successions des bases azotées des différents virus sont comparées, et les virus dont les séquences sont les plus proches sont regroupés dans un même taxon. Les genres (par exemple les Caulimovirus), puis les familles (par exemple les Caulimoviridae), sont définis par leur degré d'homologie.
La plupart des genres de phytovirus ont été affectés à des familles, il subsiste cependant quatre genres isolés (incertae sedis) : Albetovirus, Aumaivirus, Papanivirus et Virtovirus. Ces genres ont été créés en 2016 pour accueillir des virus-satellites lorsque l'ICTV a décidé d'abandonner la distinction entre les virus-satellites et les autres virus[9].
- Dans une moindre mesure, la forme des particules virales est utilisée comme critère, notamment pour le groupe des virus à ARN monocaténaire messager. Cette famille est subdivisée en virus isométriques, particules hélicoïdales, en bâtonnet ou flexueuses.
Viroïdes
Les viroïdes se distinguent des virus par leur structure bien plus simple et le principe de leur multiplication qui n’est pas tout à fait identique.
Les viroïdes sont constitués exclusivement d’un ARN monocaténaire circulaire qui possède une structure spatiale très compacte et rigide. Il n'y a pas de capside et encore moins d'enveloppe. Les viroïdes ont été classés en deux familles : Pospiviroidae et Avsunviroidae.
L’ARN polymérase de la plante assure la synthèse de nouveaux viroïdes qui s’accumulent alors dans les nucléoles, le reste du noyau ou de la membrane des thylakoïdes des chloroplastes.
Cette accumulation de viroïdes à l'intérieur de la cellule entraîne un dysfonctionnement métabolique empêchant par exemple la multiplication cellulaire. La multiplication des viroïdes est favorisée par une augmentation de la durée de jour et une augmentation de la température, c’est pour cette raison qu’ils sont impliqués dans des maladies tropicales, méditerranéennes ou de plantes d’ornement élevées sous serre. Une de ces attaques provoque le « cadang-cadang » qui aboutit à un dépérissement lent mais létal des cocotiers et qui a déjà décimé des milliers d’arbres.
ARN-satellites
Les ARN satellites (ARNsat) sont de courtes molécules d'ARN, comptant généralement moins de 1500 nucléotides, qui dépendent de virus auxiliaires apparentés pour la réplication, l'encapsidation, le mouvement et la transmission. Au contraire des virus satellites, les ARNsat n'expriment pas de protéines de capside. La plupart partagent peu ou pas d'homologie de séquence avec les virus auxiliaires[10].
On distingue trois sous-groupes d'ARNsat à simple brin :
- les ARN satellites à fonction messagère (génome de 0,8 à 1,5 kb), qui codent au moins une protéine non structurelle ; on en connaît une dizaine,
- les ARN satellites linéaires sans fonction messagère (moins de 700 nucléotides), qui ne présentent aucune activité de messager biologiquement significative ; sept espèces ont été décrites,
- les ARN satellites circulaires sans fonction messagère (220 à 350 nucléotides) ; sans activité de messager biologiquement significative, ces ARNsat circulaires, auparavant appelés « virusoïdes », se répliquent par un mécanisme de réplication en cercle roulant ; huit espèces sont acceptées par l'ICTV[10] - [11].
Mouvement des virus dans la plante
À courte distance, d’une cellule à l’autre, les virus s’associent à des protéines de mouvement avec lesquelles ils forment un complexe. Ce complexe aboutit parfois à la formation de tubules, assure le passage des virus par les plasmodesmes.
À longue distance, les virus utilisent les tubes de transport de la sève élaborée que sont les cellules du phloème.
Dissémination des virus
Les phytovirus peuvent se transmettre horizontalement (d'une plante à une autre, éventuellement par l'intermédiaire d'un vecteur) ou verticalement (d'une génération à une autre)[4].
Transmission verticale
La transmission verticale désigne la transmission d’une génération de plantes à la suivante.
Les virus sont peu fréquemment transmis par les graines et encore plus rarement par le pollen[4]. Néanmoins on considère que 18 % des phytovirus décrits sont transmis par les graines chez un ou plusieurs hôtes. En 2013, 231 virus et viroïdes transmis par les graines ont été recensés parmi les quelque 1500 phytovirus répertoriés sur différentes plantes cultivées[12] - [13]. On a recensé (en 2007) 39 virus, appartenant majoritairement aux genres Alphacryptovirus, Ilarvirus, Nepovirus et Potyvirus, susceptibles d'être transmis par le pollen, ainsi que cinq viroïdes. Cette transmission peut être horizontale (infection de la plante porteuse de la fleur fécondée par le pollen) ou verticale (infection de l'embryon et de la graine)[14].
Par contre la multiplication végétative des plantes entraîne l'infection de toute la descendance. L'élimination des tissus virosés se fait essentiellement par micro-bouturage et la culture de méristèmes.
Transmission horizontale
La transmission horizontale désigne la transmission des virus de plante à plante. Celle-ci peut se produire par inoculation mécanique lors d’une greffe ou sous l’effet du vent qui fait se frotter deux branches. Les pratiques culturales, taille, labours, peuvent assurer également la transmission horizontale.
Le mode de transmission le plus spécifique aux virus reste la transmission par des organismes vivants, appelés vecteurs : ravageurs, champignons ou cuscute (végétal parasite). Parmi les ravageurs, on trouve tous les ravageurs piqueurs-suceurs : acariens, nématodes, et surtout les insectes comme pucerons, cochenilles, cicadelles, aleurodes et thrips, ainsi que certains coléoptères.
Les phytovirus transmis par des vecteurs peuvent être classés en deux catégories, les virus non-circulants et les virus circulants.
Afin de mieux comprendre ces modes de transmissions il faut savoir sur quelles bases ils se définissent :
- le temps nécessaire à l’acquisition du virus par l’insecte à partir d’une plante infectée,
- le temps d’inoculation qui correspond au temps nécessaire au vecteur pour transmettre le virus à une plante saine,
- la période de latence définissant la période s’écoulant entre le moment où le vecteur a acquis un virus et le moment où il peut transmettre le virus à une plante,
- la période de rétention qui correspond au temps pendant lequel un vecteur ayant acquis un virus reste capable de le transmettre à une plante.
Virus non-circulants
Ils sont transportés par les pièces buccales des insectes phytophages, par exemple un puceron. Le vecteur perd son infectivité lors d'une mue. On distingue parmi ces types de virus :
- Les virus non-persistants : ils constituent une majorité de virus de végétaux causant beaucoup de pertes économiques. Ces virus ont une durée très brève de rétention dans le vecteur. Le repas d’acquisition est de très courte durée (quelques secondes) et le virus doit être inoculé très rapidement pour pouvoir se propager.
Les pucerons sont les vecteurs les plus importants pour cette voie de transmission. Lors de piqûres d’essais, afin de constater l’état favorable ou non de la plante (sondage), les virions se fixent, grâce à des interactions protéines–protéines, sur la couche cuticulaire des pièces buccales (stylet : d’où le nom de la transmission en mode stylet) ou du tractus digestif antérieur par aspiration. Le temps de latence étant nul, on s’organise vers un temps d’acquisition (optimum 15/30 secondes) et d’inoculation (quelques minutes) très court, pour transmettre le virus à une plante saine sensible, car sinon les virus seront perdus par égestion ou salivation. Ce modèle de transmission doit s’avérer efficace. Pour cela (d’après des études sur le virus de la mosaïque du concombre -CMV) le virus induit chez la plante une augmentation de la concentration en composés volatils, afin d’attirer les pucerons, mais une baisse de la qualité, surtout gustative, pour que la piqûre de sondage récupère des virions et repousse le puceron porteur. La transmission peut s’effectuer alors le plus rapidement possible vers une plante saine et sensible.
- Les virus semi-persistants : ces virus ont une durée de rétention plus longue (quelques heures). Pour que le virus se propage, le repas d’acquisition et le repas d’inoculation doivent être plus longs (quelques heures également).
Chez un groupe de nématodes, du genre Xiphinema, la transmission d’un Nepovirus se fait selon le mode non-circulant, mais avec une persistance qui peut aller de quelques semaines à quelques mois. Si le nématode vit suffisamment longtemps, il peut assurer la transmission du virus entre deux cultures annuelles.
Virus circulants
Les virions circulent dans le système digestif, l’hémolymphe, puis dans les glandes salivaires du vecteur, où ils résident mais ne se répliquent pas, pour finir dans le canal salivaire par lequel ils sont introduits dans une nouvelle plante. Ces virus sont aussi qualifiés de persistants. Les repas d’acquisition et d’inoculation durent plusieurs heures et sont séparés par une longue période de latence durant laquelle l’insecte ne peut pas transmettre le virus. Le vecteur garde son infectivité lors d'une mue (passage transstadial). Leur transmission semblerait favorisée par les changements induits par le virus chez les plantes attirant les vecteurs en encourageant leur reproduction et leur alimentation soutenues sur les plantes infectées. Les paramètres qui régissent l’expansion d’une maladie virale transmise par des vecteurs dépend des divers facteurs relatifs à la biologie du vecteur lui-même. La connaissance des paramètres permet de mettre en place des systèmes prévisionnels permettant de conduire une lutte efficace : élimination des sources de virus durant l’inter-culture ou l’interférence avec le comportement des vecteurs.
Lutte contre les phytovirus
Il n'existe pas de substance chimique, connue à ce jour, capable d’assurer une lutte curative : seule la lutte préventive peut être envisagée[4].
Sélection génétique
Les moyens de défense naturels des végétaux (synthèse de protéines de défenses, hypersensibilité) pour lutter contre les virus sont souvent de nature génétique. Cette aptitude définit la notion de résistance variétale. L’expérience prouve que plus une plante est sélectionnée dans un objectif de rendement, et plus on la fragilise. Les généticiens ont donc été amenés à créer de nouvelles variétés en introduisant des gènes de résistance par le biais de croisements et de sélection, ou par le biais de la méthode de transgénèse[4].
Par exemple on croise des plants de tomates (Solanum lycopersicum) avec des espèces sauvages comme Solanum hirsutum ou Solanum peruvianum afin d’améliorer la résistance aux virus de la mosaïque du tabac, de la marbrure du tabac et du virus Y de la pomme de terre.
De même des croisements sont effectués entre l'orge et le triticale afin d’obtenir des variétés résistantes au virus de la mosaïque jaunissante de l'orge.
Élimination des sources de vecteurs
Pour les virus non-persistants, la propagation de l’épidémie se fait dans un rayon d’une centaine de mètres autour du plant virosé.
La lutte consiste à éliminer les sources de virus comme les plantes pérennes ou bisannuelles adventices pendant l’interculture. On peut notamment protéger la culture par une haie dans les régions ventées. En effet le vent est un facteur de propagation des insectes-vecteurs, notamment pour les cultures maraîchères basses. On peut aussi utiliser un insecticide qui intercepte le vecteur en vol. On peut pulvériser de l’huile de synthèse sur les plants afin de limiter l’accrochage de virus à l’appareil buccal de l’insecte.
La propagation des virus persistants peut se faire sur des centaines de kilomètres. La maîtrise de la population de phytophage vecteur peut parfois s'imposer. Dans ces cas là, l'utilisation d’un insecticide sur le feuillage ou dans le sol peut être préconisé. Ce type de traitement intervient notamment pour le virus de l'enroulement de la pomme de terre ou bien le virus de la jaunisse nanisante de l'orge.
Cultures de méristèmes
Les méristèmes sont indemnes de virus. Sur le milieu de culture contenant des hormones et des inhibiteurs de réplication, la culture de méristèmes permet la multiplication de clones sains à grande échelle.
Thermothérapie
La thermothérapie consiste à exposer le végétal à une forte température. Elle est capable de détruire les virus à l’image d’une fièvre chez les humains. Pour cela on procède à des bains chauds ou on place dans une ambiance chauffée les végétaux à « traiter »[15]. Cette solution n’est envisagée que pour des petites cultures.
Les fraisiers au chaud
Des plantules de fraisiers infectées par le virus de la marbrure peuvent être assainies par un séjour de trois à quatre semaines à 37/38 °C. En général cette technique de thermothérapie est réservée à la lutte préventive pour produire des greffons ou plants indemnes de virus.
Prémunition
La prémunition consiste à inoculer une souche virale produisant des symptômes atténués afin de protéger les plantes contre l'infection ultérieure de souches sévères du même virus ou viroïde. Cependant, il peut se produire un phénomène de réversion qui fait régresser la souche prémunisante en souche virulente. De plus certaines souches prémunisantes peuvent être virulentes pour d’autres espèces.
Le côté aléatoire de cette technique en fait une méthode transitoire dans l’attente d’autres solutions moins onéreuses et plus pratiques à mettre en œuvre. À l’heure actuelle les virus faisant l’objet d’une prémunition à une échelle commerciale sont le virus de la tristeza des agrumes, le virus de la tache annulaire de la papaye, le virus de la mosaïque jaune de la courgette, le virus de la mosaïque du tabac.
Applications des phytovirus
Les virus végétaux peuvent être utilisés pour concevoir des vecteurs viraux, outils couramment utilisés en biologie moléculaire pour fournir du matériel génétique à la cellule végétale. Ils sont également des sources de biomatériaux et de dispositifs nanotechnologiques[16] - [17]. La connaissance des virus végétaux et de leurs composants a contribué au développement de la biotechnologie végétale moderne. L'utilisation de virus végétaux pour améliorer la beauté des plantes ornementales peut être considérée comme la première application enregistrée de virus végétaux. Le virus de la panachure de la tulipe est célèbre pour ses effets spectaculaires sur les couleurs du périanthe de la tulipe, un effet très recherché pendant la « tulipomanie » néerlandaise du XVIIe siècle. Le virus de la mosaïque du tabac (TMV) et le virus de la mosaïque du chou-fleur (CaMV) sont fréquemment utilisés en biologie moléculaire des plantes. Le promoteur CaMV 35S, promoteur très puissant le plus fréquemment utilisé pour la transformation des plantes, présente un intérêt particulier.
Des applications représentatives des virus végétaux sont énumérées ci-dessous.

| Utilisation | Description |
| Amélioration de l'esthétique des plantes | Augmentation de la beauté et de la valeur commerciale des plantes ornementales[18] |
| Protection croisée | Obtention de souches virales bénignes pour prévenir les infections par des souches parentes plus virulentes[19] |
| Lutte biologique contre les mauvaises herbes | Utilisation de virus provoquant une nécrose systémique mortelle comme bioherbicides[20] |
| Lutte biologique contre les ravageurs | Amélioration de la délivrance de toxines pour lutter contre les insectes et nématodes ravageurs[21] |
| Assemblage de nanoparticules | La surface des virions est rendue fonctionnelle et utilisée pour assembler des nanoparticules[22] |
| Nanotransporteurs | Utilisation des virions pour transporter des charges de composés[23] |
| Nanoréacteurs | Encapsulation d'enzymes dans des virions pour créer des réactions en cascade[24] |
| Expression de protéines/ peptides recombinants | Surproduction rapide et transitoire de peptides recombinants, de bibliothèques de polypeptides et de complexes protéiques[25] |
| Études génomiques fonctionnelles | Extinction de gène ciblée à l'aide de vecteurs viraux VIGS et miARN[26] |
| Édition génomique | Édition ciblée du génome par la délivrance transitoire de nucléases spécifiques à une séquence[27] - [28] |
| Ingénierie des voies métaboliques | Recâblage de la voie biosynthétique pour améliorer la production de métabolites natifs et étrangers[29] - [30] |
| Induction de la floraison | Expression virale du gène FT (flowering locus T) pour accélérer l'induction de la floraison et la sélection des plantes cultivées[31] |
| Thérapie génique des plantes cultivées | Utilisation en plein champ de vecteurs viraux pour la reprogrammation transitoire de traits des plantes cultivées au cours d'une seule saison de croissance[16] |
Les dix principaux virus phytopathogènes
Une enquête internationale menée en 2011 auprès de virologues par la revue Molecular Plant Pathology a permis de désigner les dix espèces de virus phytopathogènes les plus importantes, en tenant compte à la fois des aspects scientifiques et économiques. Ces organismes pathogènes, dont la moitié affectent des plantes de la famille des Solanaceae (pomme de terre, tabac, tomate), seraient les suivants[32] :
- Virus de la mosaïque du tabac (TMV, Tobacco mosaic virus) ; premier virus découvert et premier virus des plantes dont le génome a été séquencé, le TMV est un organisme modèle qui a joué un rôle primordial dans le développement des connaissances en virologie[4];
- Virus de la maladie bronzée de la tomate (TSWV, Tomato spotted wilt virus) ; ce virus à répartition mondiale est important par sa vaste gamme de plantes-hôtes (plus de 800), les pertes économiques qu'il provoque et les difficultés rencontrées pour maîtriser les thrips vecteurs ;
- Virus des feuilles jaunes en cuillère de la tomate (TYLCV, Tomato yellow leaf curl virus) ; transmis par l'aleurode du tabac, ce virus provoque une maladie dévastatrice dans les cultures de tomates ;
- Virus de la mosaïque du concombre (CMV, Cucumber mosaic virus) ; infectant plus de 1200 espèces de plantes et transmis par plus de 80 espèces de pucerons, ce virus a fait l'objet de nombreuses études au niveau moléculaire ;
- Virus Y de la pomme de terre (PVY, Potato virus Y) ;
- Virus de la mosaïque du chou-fleur (CaMV, Cauliflower mosaic virus) ;
- Virus de la mosaïque africaine du manioc (ACMV, African cassava mosaic virus)
- Virus de la sharka (PPV, Plum pox virus) ;
- Virus de la mosaïque du brome (BMV, Brome mosaic virus) ;
- Virus X de la pomme de terre (PVX, Potato virus X).
Les auteurs ont également mentionnés comme particulièrement importants, bien qu'ils ne figurent pas dans la liste des dix premiers, les virus suivants : le virus de la tristeza des agrumes (CTV, Citrus tristeza virus), le virus de la jaunisse nanisante de l'orge (BYDV, Barley yellow dwarf virus), le virus de l'enroulement de la pomme de terre, (PLRV, Potato leafroll virus) et le virus du rabougrissement buissonneux de la tomate (TBSV, Tomato bushy stunt virus).
Notes et références
- (en) Calum Rae Wilson, Applied Plant Virology : Modular Texts, Wallingford, CABI, , 192 p. (ISBN 978-1-78064-425-7, lire en ligne), p. 1-4.
- (en) M.V. Nayudu, Plant Viruses, Tata McGraw-Hill Education, , 1249 p. (ISBN 978-0-07-065660-4, lire en ligne), p. 1-2.
- (en) Hielke De Jong, « Unravelling the Mystery of Potato Curl - Spud Smart », sur Spud Smart, SpudSmart, (consulté le ).
- Stéphane Biacchesi, Christophe Chevalier, Marie Galloux, Christelle Langevin, Ronan Le Goffic et Michel Brémont, Les virus : Ennemis ou alliés ?, Versailles, Quæ, coll. « Enjeux Sciences », , 112 p. (ISBN 978-2-7592-2627-6, lire en ligne), I. Les virus dominent-ils le monde ?, p. 7-14, accès libre.
- Hervé Lecoq, « Découverte du premier virus, le virus de la mosaïque du tabac: 1892 ou 1898 ? = Discovery of the first virus, Tobacco mosaic virus: 1892 or 1898 ? », Comptes rendus de l'Académie des sciences. Série 3, Sciences de la vie ISSN 0764-4469, vol. 324, no 10, , p. 929–933 (résumé).
- Albouy et al. 2001, p. 9-10.
- (en) « Virus Structure », sur web.archive.org, Tulane University, (consulté le )
- Jacques Barnouin, Ivan Sache et al. (préf. Marion Guillou), Les maladies émergentes : Épidémiologie chez le végétal, l'animal et l'homme, Versailles, Quæ, coll. « Synthèses », , 444 p. (ISBN 978-2-7592-0510-3, ISSN 1777-4624, lire en ligne), V. Barrière d'espèces et émergences virales, chap. 27 (« L'émergence de maladies virales chez les plantes : des situations variées et des causes multiples »), p. 281, accès libre.
- Mart Krupovic, Plant Satellite Viruses (Albetovirus, Aumaivirus, Papanivirus, Virtovirus), Elsevier, coll. « Reference Module in Life Sciences » (ISBN 978-0-12-809633-8, DOI 10.1016/B978-0-12-809633-8.21289-2, lire en ligne).
- (en) Chung-Chi Hu, Yau-Heiu Hsu, Na-Sheng Lin, « Satellite RNAs and Satellite Viruses of Plants », Viruses, vol. 1, no 3, , p. 1325-50 (DOI 10.3390/v1031325, lire en ligne).
- Albouy et al. 2001, p. 154-156.
- (en) K. Subramanya Sastry, Seed-borne plant virus diseases, New Delhi/New York, Springer Science & Business Media, , 327 p. (ISBN 978-81-322-0813-6, lire en ligne), p. 5
- Philippe Lepoivre, Phytopathologie : Bases moléculaires et biologiques des pathosystèmes et fondements des stratégies de lutte, De Boeck Supérieur, , 432 p. (lire en ligne), p. 67
- (en) S. D. Card, M. N. Pearson, G. R. G. Clover, « Plant pathogens transmitted by pollen », Australasian Plant Pathology, vol. 36, no 5, , p. 455-461 (résumé).
- « Assainissement de cultivars fruitiers virosés - Le traitement par thermothérapie », CTIFL, (consulté le ).
- (en) Fabio Pasin, Wulf Menzel et José-Antonio Daròs, « Harnessed viruses in the age of metagenomics and synthetic biology: an update on infectious clone assembly and biotechnologies of plant viruses », Plant Biotechnology Journal, vol. 17, no 6, , p. 1010–1026 (ISSN 1467-7652, DOI 10.1111/pbi.13084).
- (en) Peter Abrahamian, Rosemarie W. Hammond et John Hammond, « Plant Virus-Derived Vectors: Applications in Agricultural and Medical Biotechnology », Annual Review of Virology, vol. 7, no 1, , p. 513–535 (ISSN 2327-0578, DOI 10.1146/annurev-virology-010720-054958).
- (en) Rodrigo A. Valverde, Sead Sabanadzovic et John Hammond, « Viruses that Enhance the Aesthetics of Some Ornamental Plants: Beauty or Beast? », Plant Disease, vol. 96, no 5, , p. 600–611 (ISSN 0191-2917, DOI 10.1094/PDIS-11-11-0928-FE).
- (en) Heiko Ziebell et John Peter Carr, « Cross-protection: a century of mystery », Advances in Virus Research, vol. 76, , p. 211–264 (ISSN 1557-8399, DOI 10.1016/S0065-3527(10)76006-1).
- (en) Dylan P. Harding et Manish N. Raizada, « Controlling weeds with fungi, bacteria and viruses: a review », Frontiers in Plant Science, vol. 6, , p. 659 (ISSN 1664-462X, DOI 10.3389/fpls.2015.00659).
- (en) Bryony C. Bonning, Narinder Pal, Sijun Liu, Zhaohui Wang, S. Sivakumar, Philip M. Dixon et Glenn F. King, « Toxin delivery by the coat protein of an aphid-vectored plant virus provides plant resistance to aphids », Nature Biotechnology, vol. 32, no 1, , p. 102–105 (ISSN 1546-1696, DOI 10.1038/nbt.2753).
- (en) John F. C. Steele, Hadrien Peyret, Keith Saunders, Roger Castells-Graells, Johanna Marsian, Yulia Meshcheriakova et George P. Lomonossoff, « Synthetic plant virology for nanobiotechnology and nanomedicine », Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology, vol. 9, no 4, , e1447 (ISSN 1939-0041, DOI 10.1002/wnan.1447).
- (en) William M. Aumiller, Masaki Uchida et Trevor Douglas, « Protein cage assembly across multiple length scales », Chemical Society Reviews, vol. 47, no 10, , p. 3433–3469 (ISSN 1460-4744, DOI 10.1039/c7cs00818j).
- (en) Marta Comellas-Aragonès, Hans Engelkamp, Victor I. Claessen, Nico A. J. M. Sommerdijk, Alan E. Rowan, Peter C. M. Christianen et Jan C. Maan, « A virus-based single-enzyme nanoreactor », Nature Nanotechnology, vol. 2, no 10, , p. 635–639 (ISSN 1748-3395, DOI 10.1038/nnano.2007.299, Bibcode 2007NatNa...2..635C).
- (en) Yuri Y. Gleba, Daniel Tusé et Anatoli Giritch, « Plant viral vectors for delivery by Agrobacterium », Current Topics in Microbiology and Immunology, vol. 375, , p. 155–192 (ISBN 978-3-642-40828-1, ISSN 0070-217X, DOI 10.1007/82_2013_352).
- (en) Tessa M. Burch-Smith, Jeffrey C. Anderson, Gregory B. Martin et S. P. Dinesh-Kumar, « Applications and advantages of virus-induced gene silencing for gene function studies in plants », The Plant Journal: For Cell and Molecular Biology, vol. 39, no 5, , p. 734–746 (ISSN 0960-7412, DOI 10.1111/j.1365-313X.2004.02158.x).
- (en) Syed Shan-E.-Ali Zaidi et Shahid Mansoor, « Viral Vectors for Plant Genome Engineering », Frontiers in Plant Science, vol. 8, , p. 539 (ISSN 1664-462X, DOI 10.3389/fpls.2017.00539).
- (en) Savithramma P. Dinesh-Kumar et Daniel F. Voytas, « Editing through infection », Nature Plants, vol. 6, no 7, , p. 738–739 (ISSN 2055-0278, DOI 10.1038/s41477-020-0716-1, lire en ligne).
- (en) M. H. Kumagai, J. Donson, G. della-Cioppa, D. Harvey, K. Hanley et L. K. Grill, « Cytoplasmic inhibition of carotenoid biosynthesis with virus-derived RNA », Proceedings of the National Academy of Sciences of the United States of America, vol. 92, no 5, , p. 1679–1683 (ISSN 0027-8424, DOI 10.1073/pnas.92.5.1679, Bibcode 1995PNAS...92.1679K).
- (en) Eszter Majer, Briardo Llorente, Manuel Rodríguez-Concepción et José-Antonio Daròs, « Rewiring carotenoid biosynthesis in plants using a viral vector », Scientific Reports, vol. 7, , p. 41645 (ISSN 2045-2322, DOI 10.1038/srep41645, Bibcode 2017NatSR...741645M).
- (en) Roisin C. McGarry, Amy L. Klocko, Mingxiong Pang, Steven H. Strauss et Brian G. Ayre, « Virus-Induced Flowering: An Application of Reproductive Biology to Benefit Plant Research and Breeding », Plant Physiology, vol. 173, no 1, , p. 47–55 (ISSN 1532-2548, DOI 10.1104/pp.16.01336).
- (en) Scholthof KB et al;, « Top 10 plant viruses in molecular plant pathology », Molecular Plant Pathology, vol. 12, no 9, , p. 938-954 (DOI 10.1111/j.1364-3703.2011.00752.x., lire en ligne).
Voir aussi
Articles connexes
Bibliographie
- Josette Albouy, Suzanne Astier, Hervé Lecoq et Yves Maury, Principes de virologie végétale : génome, pouvoir pathogène, écologie des virus, Paris, Éditions Quae, coll. « Mieux comprendre », , 488 p. (ISBN 2-7380-0937-9).
- Georges Marchoux prénom2=Patrick, Gognalons et Kahsay Gébré Sélassié, Virus des Solanacées : Du génome viral à la protection des cultures, Versailles, Éditions Quae, coll. « Synthèses », , 843 p. (ISBN 978-2-7592-0076-4, lire en ligne).
- Josette Albouy et Jean-Claude Devergne, Maladies à virus des plantes ornementales : Du labo au terrain, Éditions Quae, , 473 p. (ISBN 978-2-7380-0763-6, lire en ligne).
- (en) M. V. Nayudu, Plant Viruses, Tata McGraw-Hill Education, , 1249 p. (ISBN 9780070656604).
- (en) Rajarshi Kumar Gaur, SMP Khurana, Yuri Dorokhov, Plant Viruses: Diversity, Interaction and Management, CRC Press, , 387 p. (ISBN 9781351667746).
Liens externes
- (en) Descriptions of plant viruses (DPV), base de données sur les virus des végétaux.
- (en) Plant Viruses Online, index des virus de la base VIDE (Virus Identification Data Exchange).
- (en) Plant virus families and genera, familles, genres et espèces-types des virus des végétaux.
- (fr) Vecteurs de virus, INRA.
- (fr) Alain Hehn Les phytovirus, ENSAIA Nancy.
- (en) « Plant Viruses », sur archive.today, MicrobiologyBytes, (consulté le ).