Virus du Nil occidental
Le virus du Nil occidental (en anglais : West Nile virus) est l'agent infectieux qui, chez l'humain, provoque la fièvre du Nil occidental. C'est un virus à ARN monocaténaire de polarité positive (groupe IV de la classification Baltimore) appartenant à la famille des Flaviviridae et au genre Flavivirus, qui comprend également le virus de la fièvre jaune, le virus de la dengue, le virus Zika et le virus de l'encéphalite japonaise. Il est présent à la fois dans les régions tropicales et les zones tempérées. Il est transmis par la piqûre de moustiques, notamment ceux du genre Culex. Les oiseaux forment son réservoir naturel, de sorte que ce virus circule normalement entre les oiseaux et les moustiques[3].
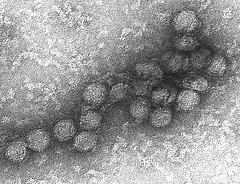
Structure
Comme les autres flavivirus, le virus du Nil occidental est un virus enveloppé à symétrie icosaédrique[4]. La cryomicroscopie électronique a révélé des virions de 45 à 50 nm recouverts d'une capside protéique relativement lisse, structure semblable à celle du virus de la dengue[4]. La coque protéique est constituée de deux protéines structurales : la glycoprotéine E et la petite protéine membranaire M[5]. La protéine E a plusieurs fonctions, notamment celle de liaison au récepteur de l'hôte, d'attachement du virus et d'entrée dans la cellule par fusion de l'enveloppe virale avec la membrane plasmique de l'hôte[5].
L'enveloppe virale est une bicouche lipidique dérivée de la membrane cellulaire de l'hôte[6]. La membrane lipidique des flavivirus contient du cholestérol et de la phosphatidylsérine, mais d'autres constituants restent encore à identifier[7] - [8]. La membrane lipidique joue plusieurs rôles dans l'infection virale, notamment celui de signalisation lipidique favorisant l'entrée dans la cellule hôte[9], ce qui est notamment le cas du cholestérol[10]. Les deux protéines d'enveloppe E et M sont insérées dans la membrane du virus[5].
Génome et protéines virales
L'ARN du génome est lié aux protéines de capside C, longues de 105 résidus d'acides aminés, pour former la nucléocapside. Les protéines de capside sont parmi les premières produites dans une cellule infectée[6]. Ce sont des protéines structurales dont le rôle principal consiste à conditionner l'ARN des virus en développement[11]. La capside empêche l'apoptose en affectant la voie de signalisation Akt/PKB (en)[6].
Le génome du virus du Nil occidental a une longueur de 11 000 nucléotides et est encadré par deux structures en épingle à cheveux non codantes aux extrémités 3’ et 5’[12]. Il code trois protéines structurales et sept protéines non structurales, ces dernières n'étant pas intégrées dans la structure des nouveaux virus. Il est exprimé en une polyprotéine qui est ensuite clivée par des peptidases en protéines distinctes[13].
Les protéines structurales sont situées près de l'extrémité 5’ du génome viral et sont clivées en protéines fonctionnelles par des peptidases, tandis que les protéines non structurales sont situées près de l'extrémité 3’ est ont principalement pour rôle d'assister la réplication du virus ou d'agir comme peptidases[14].
| Protéines structurales | C | Protéine de capside conditionnant l'ARN des virus en formation[11] - [14]. |
|---|---|---|
| prM/M | La protéine prM (precursor membrane) est présente sur les virions immatures, et est clivée en protéine M par la furine ; la protéine M permet au virion d'infecter les cellules en activant les protéines qui favorisent l'entrée du virus dans l'hôte[15]. | |
| E | Glycoprotéine formant l'enveloppe virale se liant aux récepteurs de la surface cellulaire, ce qui permet l'entrée du virus dans la cellule[16]. | |
| Protéines non structurales | NS1 | Cofacteur pour la réplication virale, intervenant notamment dans la régulation du complexe de réplication[17]. |
| NS2A | Protéine impliquée dans plusieurs processus : réplication virale, assemblage des virions, mort de la cellule hôte[18]. | |
| NS2B | Cofacteur de la protéine NS3 formant le complexe protéase NS2B-NS3[14]. | |
| NS3 | Peptidase dont le rôle est essentiellement de cliver la polyprotéine virale en protéines fonctionnelles ; elle présente également une activité d'hélicase[12]. | |
| NS4A | Cofacteur de la réplication virale, régulant notamment l'activité ATPase de la protéine NS3[19]. | |
| NS4B | Inhibe la signalisation cellulaire conduisant à la production d'interférons[20]. | |
| NS5 | Plus grosse protéine produite par ce virus, hautement conservée, il s'agt d'une enzyme douée d'activités méthyltransférase et surtout ARN polymérase ARN-dépendante, dépourvue cependant de mécanisme de correction des erreurs de réplication[14] - [21]. |
Cycle de réplication
Une fois le virus du Nil occidental dans la circulation sanguine d'un animal hôte, la protéine d'enveloppe E se lie à des facteurs d'adhérence des cellules hôtes appelés glycosaminoglycanes[16]. Ces facteurs d'adhérence facilitent l'entrée du virus dans les cellules mais ne sont pas suffisants car la liaison à des récepteurs primaires est également nécessaires[22]. Parmi ces récepteurs primaires, on compte notamment les protéines DC-SIGN (en) et DC-SIGN-R ainsi que l'intégrine αVβ3 (en)[23]. La liaison à ces récepteurs primaires permet au virus du Nil occidental de pénétrer dans la cellule par endocytose à vésicules de clathrine[24]. Le virus pénètre donc dans la cellule à travers un endosome à la suite d'une endocytose.
L'acidité de l'endosome catalyse la fusion de l'enveloppe virale avec la membrane de l'endosome, ce qui libère le génome viral dans le cytoplasme de la cellule hôte[25]. La traduction de l'ARN viral, qui est monocaténaire de sens positif, se déroule au niveau du réticulum endoplasmique. L'ARN viral est traduit en une polyprotéine qui est par la suite clivée par la peptidase virale NS2B-NS3 pour libérer les protéines biologiquement fonctionnelles[26].
Afin de répliquer son génome, le virus utilise sa protéine non structurale NS5, une enzyme à l'activité ARN polymérase ARN-dépendante, qui forme un complexe de réplication avec d'autres protéines virales non structurales afin de produire un brin d'ARN de sens négatif, complémentaires de l'ARN viral. Cet ARN antisens sert ensuite de modèle pour la production de l'ARN viral sens[22]. La protéine de capside C conditionne alors l'ARN viral sens nouvellement produit pour former la nucléocapside des virions immatures[23]. Le reste du virus est assemblé le long du réticulum endoplasmique puis à travers l'appareil de Golgi, ce qui donne des virions immatures dépourvus de virulence[26]. La protéine d'enveloppe E est alors glycosylée tandis que la protéine prM (« prémembranaire ») est clivée en protéine M par la furine, ce qui donne des virions infectieux[12] - [26]. Ces virions parvenus à maturation sont alors excrétés hors de la cellule.
Phylogénie

Avec le virus de l'encéphalite japonaise, le virus de l'encéphalite de la Murray Valley et le virus de l'encéphalite de Saint-Louis, le virus du Nil occidental fait partie du sérocomplexe antigénique de l'encéphalite japonaise[28]. La phylogénie du virus montre qu'il aurait émergé comme virus distinct il y a environ un millier d'années[29]. Ce virus originel se serait développé en deux lignées distinctes. La première lignée et ses divers profils sont à l'origine des épidémies en Afrique et dans le reste du monde. La seconde lignée, initialement identifiée en Afrique sub-saharienne et à Madagascar, était considérée comme à l'origine d'une zoonose africaine, jusqu'à ce qu'on l'observe également chez des chevaux en Europe, la première épidémie ayant touché 18 chevaux en hongrie. La première lignée a été identifiée en 2010 en Afrique du Sud chez une jument et son fœtus avorté, alors que seule la seconde lignée avait été observée dans ce pays chez les chevaux et les humains[30]. Le spectre des hôtes du virus du Nil occidental s'est élargi aux cétacés en 2007 avec l'observation d'un cas mortel chez une orque au Texas[31].
Hôtes naturels et circulation du virus
Les hôtes naturels du virus du Nil occidental sont les oiseaux et les moustiques[32]. On a identifié plus de 300 espèces d'oiseaux pouvant être infectées par ce virus rien qu'aux États-Unis[33]. L'infection est létale pour certaines espèces, comme la corneille d'Amérique, le geai bleu et le tétras des armoises, mais pas pour d'autres[34] - [35]. On pense que le merle d'Amérique et le moineau domestique comptent parmi les principaux réservoirs du virus dans les villes d'Amérique du Nord et d'Europe[36] - [37]. Les autres espèces contribuant significativement au stock de virus en Amérique du Nord sont notamment le moqueur roux, le moqueur chat, le moqueur polyglotte, le cardinal rouge, la grive des bois et les colombidés en général, chez lesquels des taux élevés d'anticorps dirigés contre le virus du Nil occidental ont été relevés[34].
Le virus du Nil occidental a été identifié chez une grande variété de moustiques, mais les plus significatifs du point de vue de la circulation du virus sont les espèces du genre Culex, qui s'alimentent sur les oiseaux, notamment Culex pipiens, Culex restuans (en), Culex salinarius (en), Culex quinquefasciatus, Culex nigripalpus (en), Culex erraticus (en) et Culex tarsalis (en)[34]. On a également pu produire expérimentalement des infection à virus du Nil occidental par morsures de tiques molles, mais il est peu probable que ce mode de transmission soit significatif dans la nature[34] - [38].
Le virus du Nil occidental dispose d'un spectre d'hôtes étendu et on sait qu'il est capable d'infecter au moins 30 espèces de mammifères, dont l'humain, certains primates non humains[39], les chevaux, les chiens et les chats[32] - [36] - [40]. Certains des humains et des chevaux infectés par ce virus développent la fièvre du Nil occidental mais les chiens et les chats présentent rarement des symptômes de maladie. Les reptiles et les amphibiens peuvent également être infectés, notamment les crocodiles, les alligators, les serpents, les lézards et les grenouilles[40] - [41] - [42] - [43]. On considère généralement que les mammifères ne participent pas à la circulation du virus car leur charge virale n'atteint pas les niveaux nécessaires pour qu'ils puissent infecter des moustiques sains se nourrissant de leur sang ; certains oiseaux sont également dans ce cas[34].
Dans le cycle normal de transmission rurale ou enzootique, le virus alterne entre le réservoir aviaire et le vecteur moustique. Il peut également être transmis entre oiseaux par contact direct, en mangeant une carcasse d'oiseau infecté ou en buvant de l'eau infectée[37]. La transmission verticale (en) de la femelle à ses larves est possible chez les moustiques et pourrait être significative en hiver[44] - [45]. Dans le cycle urbain, les moustiques infectés après s'être nourris du sang d'oiseaux infectés transmettent à leur tour le virus à l'humain. Cela nécessite des espèces de moustiques qui piquent à la fois les oiseaux et les humains, appelés vecteurs ponts[37] - [46]. Exceptionnellement, le virus du Nil occidental peut être transmis par transfusion sanguine, greffe d'organe, ou de la mère au fœtus pendant la grossesse, l'accouchement ou l'allaitement. On n'a pas observé de transmission interhumaine du virus du Nil occidental, contrairement à ce qu'il se passe pour les oiseaux.
Notes et références
- (en) Cynthia Goldsmith, « West Nile virus (WNV) virions », CDC, (consulté le ).
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- (en) John S. Mackenzie, Duane J. Gubler et Lyle R. Petersen, « Emerging flaviviruses: the spread and resurgence of Japanese encephalitis, West Nile and dengue viruses », Nature Medicine, vol. 10, no 12, , S98-109 (PMID 15577938, DOI 10.1038/nm1144, lire en ligne)
- (en) Suchetana Mukhopadhyay, Bong-Suk Kim, Paul R. Chipman, Michael G. Rossmann et Richard J. Kuhn, « Structure of West Nile Virus », Science, vol. 302, no 5643, , p. 248 (PMID 14551429, DOI 10.1126/science.1089316, lire en ligne)
- (en) Ryuta Kanai, Kalipada Kar, Karen Anthony, L. Hannah Gould, Michel Ledizet, Erol Fikrig, Wayne A. Marasco, Raymond A. Koski et Yorgo Modis, « Crystal Structure of West Nile Virus Envelope Glycoprotein Reveals Viral Surface Epitopes », Journal of Virology, vol. 80, no 22, , p. 11000-11008 (PMID 16943291, PMCID 1642136, DOI 10.1128/JVI.01735-06, lire en ligne)
- (en) Matt D. Urbanowski et Tom C. Hobman, « The West Nile Virus Capsid Protein Blocks Apoptosis through a Phosphatidylinositol 3-Kinase-Dependent Mechanism », Journal of Virology, vol. 87, no 2, , p. 872-881 (PMID 23115297, PMCID 3554064, DOI 10.1128/JVI.02030-12, lire en ligne)
- (en) Laurent Meertens, Xavier Carnec, Manuel Perera Lecoin, Rasika Ramdasi, Florence Guivel-Benhassine, Erin Lew, Greg Lemke, Olivier Schwartz et Ali Amara, « The TIM and TAM Families of Phosphatidylserine Receptors Mediate Dengue Virus Entry », Cell Host Microbe, vol. 12, no 4, , p. 544-557 (PMID 23084921, PMCID 3572209, DOI 10.1016/j.chom.2012.08.009, lire en ligne)
- (en) Ana C. Carro et Elsa B. Damonte, « Requirement of cholesterol in the viral envelope for dengue virus infection », Virus Research, vol. 174, nos 1-2, , p. 78-87 (PMID 23517753, DOI 10.1016/j.virusres.2013.03.005, lire en ligne)
- (en) Miguel A. Martín-Acebes, Teresa Merino-Ramos, Ana-Belén Blázquez, Josefina Casas, Estela Escribano-Romero, Francisco Sobrino et Juan-Carlos Saiz, « The Composition of West Nile Virus Lipid Envelope Unveils a Role of Sphingolipid Metabolism in Flavivirus Biogenesis », Journal of Virology, vol. 88, no 20, , p. 12041-12054 (PMID 25122799, PMCID 4178726, DOI 10.1128/JVI.02061-14, lire en ligne)
- (en) Guruprasad R. Medigeshi, Alec J. Hirsch, Daniel N. Streblow, Janko Nikolich-Zugich et Jay A. Nelson, « West Nile Virus Entry Requires Cholesterol-Rich Membrane Microdomains and Is Independent of αvβ3 Integrin », Journal of Virology, vol. 82, no 11, , p. 5212-5219 (PMID 18385233, PMCID 2395215, DOI 10.1128/JVI.00008-08, lire en ligne)
- (en) Tracey A. Hunt, Matthew D. Urbanowski, Kishore Kakani, Lok‐Man J. Law, Margo A. Brinton et Tom C. Hobman, « Interactions between the West Nile virus capsid protein and the host cell‐encoded phosphatase inhibitor, I2PP2A », Cellular Microbiology, vol. 9, no 11, , p. 2756-2766 (PMID 17868381, DOI 10.1111/j.1462-5822.2007.01046.x, lire en ligne)
- (en) Tonya M. Colpitts, Michael J. Conway, Ruth R. Montgomery, Erol Fikrig, « West Nile Virus: Biology, Transmission, and Human Infection », Clinical Microbiology Reviews, vol. 25, no 4, , p. 635-648 (PMID 23034323, PMCID 3485754, DOI 10.1128/CMR.00045-12, lire en ligne)
- (en) Kyung Min Chung, M. Kathryn Liszewski, Grant Nybakken, Alan E. Davis, R. Reid Townsend, Daved H. Fremont, John P. Atkinson et Michael S. Diamond, « West Nile virus nonstructural protein NS1 inhibits complement activation by binding the regulatory protein factor H », Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no 50, , p. 19111-19116 (PMID 17132743, PMCID 1664712, DOI 10.1073/pnas.0605668103, JSTOR 30051255, Bibcode 2006PNAS..10319111C, lire en ligne)
- (en) Berlin Londono-Renteria et Tonya M. Colpitts, « A Brief Review of West Nile Virus Biology », Methods in Molecular Biology, vol. 1435, , p. 1-13 (PMID 27188545, DOI 10.1007/978-1-4939-3670-0_1, lire en ligne)
- (en) Bastiaan Moesker, Izabela A. Rodenhuis-Zybert, Tjarko Meijerhof, Jan Wilschut et Jolanda M. Smit, « Characterization of the functional requirements of West Nile virus membrane fusion », Journal of General Virology, vol. 91, , p. 389-393 (PMID 19828760, DOI 10.1099/vir.0.015255-0, lire en ligne)
- (en) Manuel Perera-Lecoin, Laurent Meertens, Xavier Carnec et Ali Amara, « Flavivirus Entry Receptors: An Update », Viruses, vol. 6, no 1, , p. 69-88 (PMID 24381034, PMCID 3917432, DOI 10.3390/v6010069, lire en ligne)
- (en) Soonjeon Youn, Rebecca L. Ambrose, Jason M. Mackenzie et Michael S. Diamond, « Non-structural protein-1 is required for West Nile virus replication complex formation and viral RNA synthesis », Virology Journal, , p. 339 (PMID 24245822, PMCID 3842638, DOI 10.1186/1743-422X-10-339, lire en ligne)
- (en) Ezequiel Balmori Melian, Judith H. Edmonds, Tomoko Kim Nagasaki, Edward Hinzman, Nadia Floden et Alexander A. Khromykh, « West Nile virus NS2A protein facilitates virus-induced apoptosis independently of interferon response », Journal of General Virology, vol. 94, no Pt 2, , p. 308-313 (PMID 23114626, PMCID 3709616, DOI 10.1099/vir.0.047076-0, lire en ligne)
- (en) Sergey A. Shiryaev, Andrei V. Chernov, Alexander E. Aleshin, Tatiana N. Shiryaeva et Alex Y. Strongin, « NS4A regulates the ATPase activity of the NS3 helicase: a novel cofactor role of the non-structural protein NS4A from West Nile virus », Journal of General Virology, vol. 90, no Pt 9, , p. 2081-2085 (PMID 19474250, PMCID 2887571, DOI 10.1099/vir.0.012864-0, lire en ligne)
- (en) Jason A. Wicker, Melissa C. Whiteman, David W. C. Beasley, C. Todd Davis, Charles E. McGee, J. Ching Lee, Stephen Higgs, Richard M. Kinney, Claire Y.-H. Huang et Alan D. T. Barretta, « Mutational analysis of the West Nile virus NS4B protein », Virology, vol. 426, no 1, , p. 22-33 (PMID 22314017, PMCID 4583194, DOI 10.1016/j.virol.2011.11.022, lire en ligne)
- (en) Andrew D. Davidson, « Chapter 2 New Insights into Flavivirus Nonstructural Protein 5 », Advances in Virus Research, vol. 74, , p. 41-101 (PMID 19698895, DOI 10.1016/S0065-3527(09)74002-3, lire en ligne)
- (en) Margo A. Brinton, « The Molecular Biology of West Nile Virus: A New Invader of the Western Hemisphere », Annual Reviews of Microbiology, vol. 56, , p. 371-402 (PMID 12142476, DOI 10.1146/annurev.micro.56.012302.160654, lire en ligne)
- (en) Melanie A. Samuel, Michael S. Diamond, « Pathogenesis of West Nile Virus Infection: a Balance between Virulence, Innate and Adaptive Immunity, and Viral Evasion », Journal of Virology, vol. 80, no 19, , p. 9349-9360 (PMID 16973541, PMCID 1617273, DOI 10.1128/JVI.01122-06, lire en ligne)
- (en) Ricardo Vancinia, Laura D. Kramer, Mariana Ribeiro, Raquel Hernandez et Dennis Brown, « Flavivirus infection from mosquitoes in vitro reveals cell entry at the plasma membrane », Virology, vol. 435, no 2, , p. 406-414 (PMID 23099205, DOI 10.1016/j.virol.2012.10.013, lire en ligne)
- (en) Suchetana Mukhopadhyay, Richard J. Kuhn et Michael G. Rossmann, « A structural perspective of the flavivirus life cycle », Nature Reviews Microbiology, vol. 3, no 1, , p. 13-22 (PMID 15608696, DOI 10.1038/nrmicro1067, lire en ligne)
- (en) Mehul S. Suthar, Michael S. Diamond et Michael Gale Jr, « West Nile virus infection and immunity », Nature Reviews Microbiology, vol. 11, no 2, , p. 115-128 (PMID 23321534, DOI 10.1038/nrmicro2950, lire en ligne)
- (en) Robert S. Lanciottia, Gregory D. Ebel, Vincent Deubel, Amy J. Kerst, Severine Murri, Richard Meyer, Michael Bowen, Nancy McKinney, William E. Morrill, Mary B. Crabtree, Laura D. Kramer et John T. Roehrig, « Complete Genome Sequences and Phylogenetic Analysis of West Nile Virus Strains Isolated from the United States, Europe, and the Middle East », Virology, vol. 298, no 1, , p. 96-105 (PMID 12093177, DOI 10.1006/viro.2002.1449, lire en ligne)
- (en) Mario Lobigs et Michael S. Diamond, « Feasibility of cross-protective vaccination against flaviviruses of the Japanese encephalitis serocomplex », Expert Review of Vaccines, vol. 11, no 2, , p. 177-187 (PMID 22309667, PMCID 3337329, DOI 10.1586/erv.11.180, lire en ligne)
- (en) John S. Marr et Charles H. Calisher, « Alexander the Great and West Nile Virus Encephalitis », Emerging Infectious Diseases, vol. 9, no 12, , p. 1599-1603 (PMID 14725285, PMCID 3034319, DOI 10.3201/eid0912.030288, lire en ligne)
- (en) Marietjie Venter, Stacey Human, Stephanie van Niekerk, June Williams, Charmaine van Eeden et Frank Freeman, « Fatal Neurologic Disease and Abortion in Mare Infected with Lineage 1 West Nile Virus, South Africa », Emerging Infectious Diseases, vol. 17, no 8, , p. 1534-1536 (PMID 21801644, PMCID 3381566, DOI 10.3201/eid1708.101794, lire en ligne)
- (en) Judy A. St. Leger, Guang Wu, Mark Anderson, Les Dalton, Erika Nilson et David Wang, « West Nile Virus Infection in Killer Whale, Texas, USA, 2007 », Emerging Infectious Diseases, vol. 17, no 8, , p. 1531-1533 (PMID 21801643, PMCID 3381582, DOI 10.3201/eid1708.101979, lire en ligne)
- « Virus du Nil occidental », OMS, (consulté le ).
- (en) « Species of dead birds in which West Nile virus has been detected, United States, 1999-2016 » [PDF], CDC (consulté le ).
- (en) A. Marm Kilpatrick, Shannon L. LaDeau et Peter P. Marra, « Ecology of West Nile Virus Transmission and its Impact on Birds in the Western Hemisphere », The Auk, vol. 124, no 4, , p. 1121-1136 (DOI 10.1642/0004-8038(2007)124[1121:EOWNVT]2.0.CO;2, JSTOR 25150376, lire en ligne)
- (en) Kaci K. VanDalen, Jeffrey S. Hall, Larry Clark, Robert G. McLean et Cynthia Smeraski, « West Nile Virus Infection in American Robins: New Insights on Dose Response », PLoS ONE, vol. 8, no 7, , article no e68537 (PMID 23844218, PMCID 3699668, DOI 10.1371/journal.pone.0068537, Bibcode 2013PLoSO...868537V, lire en ligne)
- (en) A. Marm Kilpatrick, Peter Daszak, Matthew J. Jones, Peter P. Marra et Laura D. Kramer, « Host heterogeneity dominates West Nile virus transmission », Proceedings of the Royal Society B, vol. 273, no 1599, , p. 2327-2333 (PMID 16928635, PMCID 1636093, DOI 10.1098/rspb.2006.3575, lire en ligne)
- (en) Virginia Gamino et Ursula Höfle, « Pathology and tissue tropism of natural West Nile virus infection in birds: a review », Veterinary Research, vol. 44, no 1, , p. 39 (PMID 23731695, PMCID 3686667, DOI 10.1186/1297-9716-44-39, lire en ligne)
- (en) Charles Henderson Lawrie, Nathalie Yumari Uzcátegui, Ernest Andrew Gould et Patricia Anne Nuttall, « Ixodid and argasid tick species and west nile virus », Emerging Infectious Diseases, vol. 10, no 4, , p. 653-657 (PMID 15200855, PMCID 3323096, DOI 10.3201/eid1004.030517, lire en ligne)
- (en) Marion S. Ratterree, Amelia P. A. Travassos da Rosa, Rudolf P. Bohm, Jr., Frank B. Cogswell, Kathrine M. Phillippi, Kevin Caillouet, Shelle Schwanberger, Robert E. Shope et Robert B. Tesh, « West Nile Virus Infection in Nonhuman Primate Breeding Colony, Concurrent with Human Epidemic, Southern Louisiana », Emerging Infectious Diseases, vol. 9, no 11, , p. 1388-1394 (PMID 14718080, DOI 10.3201/eid0911.030226, lire en ligne)
- (en) Peter P. Marra, Sean Griffing, Carolee Caffrey, Marm A. Kilpatrick, Robert McLean, Christopher Brand, Emi Saito, Alan P. Dupuis, Laura Kramer et Robert Novak, « West Nile Virus and Wildlife », BioScience, vol. 54, no 5, , p. 393-402 (DOI 10.1641/0006-3568(2004)054[0393:WNVAW]2.0.CO;2, lire en ligne)
- (en) Amir Steinman, Caroline Banet-Noach, Shlomit Tal, Ohad Levi, Lubov Simanov, Shimon Perk, Mertyn Malkinson et Nahum Shpigel, « West Nile Virus Infection in Crocodiles », Emerging Infectious Diseases, vol. 9, no 7, , p. 887-889 (PMID 12899140, PMCID 3023443, DOI 10.3201/eid0907.020816, lire en ligne)
- (en) C. R. Dahlin, D. F. Hughes, W. E. Meshaka Jr., C. Coleman et J. D. Henning, « Wild snakes harbor West Nile virus », One Health, vol. 2, , p. 136-138 (PMID 28616487, PMCID 5441359, DOI 10.1016/j.onehlt.2016.09.003, lire en ligne)
- (en) Ellen Ariel, « Viruses in reptiles », Veterinary Research, vol. 42, no 1, , p. 100 (PMID 21933449, PMCID 3188478, DOI 10.1186/1297-9716-42-100, lire en ligne)
- (en) Laura B. Goddard, Amy E. Roth, William K. Reisen et Thomas W. Scott, « Vertical Transmission of West Nile Virus by Three California Culex (Diptera: Culicidae) Species », Journal of Medical Entomology, vol. 40, no 6, , p. 743-746 (PMID 14765647, DOI 10.1603/0022-2585-40.6.743, lire en ligne)
- (en) Louise M. Bugbee et Leonard R. Forte, « The discovery of West Nile virus in overwintering Culex pipiens (Diptera: Culicidae) mosquitoes in Lehigh County, Pennsylvania », Journal of the American Mosquito Control Association, vol. 20, no 3, , p. 326-327 (PMID 15532939)
- (en) Scott C. Weaver, Caroline Charlier, Nikos Vasilakis et Marc Lecuit, « Zika, Chikungunya, and Other Emerging Vector-Borne Viral Diseases », Annual Review of Medicine, vol. 69, , p. 395-408 (PMID 28846489, PMCID 6343128, DOI 10.1146/annurev-med-050715-105122, lire en ligne)
Annexes
Bibliographie
- Dominique J. Bicout et al., Le virus du Nil occidental, Versailles, Quæ, coll. « Synthèses », , 239 p. (ISBN 978-2-7592-1968-1, lire en ligne), disponible en accès libre.
Liens externes
- Ressources relatives au vivant :
- Ressources relatives à la santé :
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :