Virus Zika
Le virus Zika est l'agent infectieux à l'origine, chez l'homme, de l'infection à virus Zika. Il s'agit d'un virus à ARN monocaténaire de polarité positive, relevant donc du groupe IV de la classification Baltimore, et appartenant au genre Flavivirus. Il est notamment apparenté aux virus de la dengue, de la fièvre jaune, de l'encéphalite japonaise et du Nil occidental[3]. Il appartient au même sérogroupe que le virus Spondweni[4] - [5].
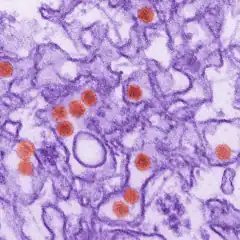
Le nom du virus fait référence à la forêt de Zika, près d'Entebbe (Ouganda), où il a été isolé en 1947 sur un macaque rhésus avant d'être caractérisé en 1952 comme une nouvelle espèce virale[6]. Il existe en fait deux lignées de virus Zika, l'une originaire d'Afrique et l'autre d'Asie.
En , faisant suite à l'apparition de l'épidémie d'infections à virus Zika au Brésil, l'Organisation mondiale de la santé « a rendu l’avis que le groupe récent de cas de microcéphalie et d’autres troubles neurologiques signalés au Brésil, faisant suite à un regroupement similaire de cas en Polynésie française en 2014, constitue une urgence de santé publique de portée internationale (USPPI) »[7].
Phylogénie
Il existe deux lignées de virus Zika, l'une originaire d'Afrique et l'autre d'Asie[8]. Des études phylogénétiques indiquent que le virus qui se propage sur le continent américain est identique à 89 % aux génotype africains mais est apparenté plus étroitement aux souches asiatiques qui ont circulé en Polynésie française au cours de l'épidémie de 2013-2014[9] - [10]. La souche asiatique semble s'être différenciée aux alentours de 1928[11].
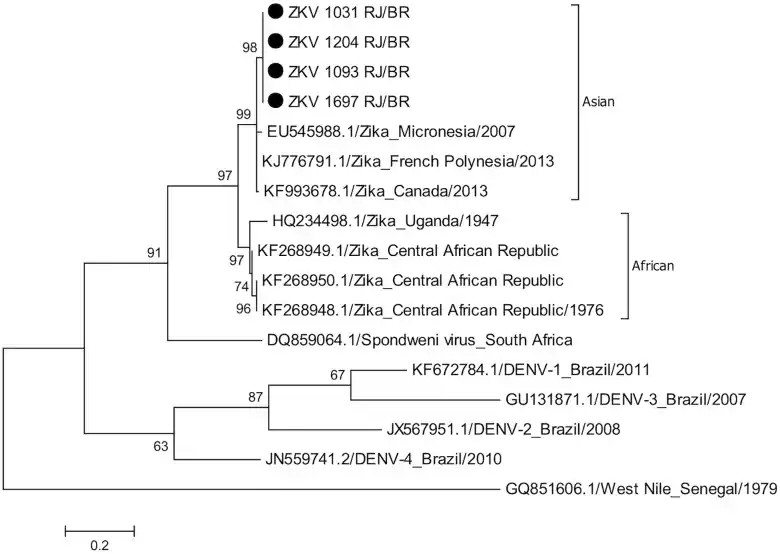 Les souches de virus Zika séquencées à Rio de Janeiro en 2016 (marquées d'un point noir ⬤ en haut de l'arbre) sont proches de celles identifiées en Polynésie française en 2013[12].
Les souches de virus Zika séquencées à Rio de Janeiro en 2016 (marquées d'un point noir ⬤ en haut de l'arbre) sont proches de celles identifiées en Polynésie française en 2013[12].
Génome et structure
Ce virus enveloppé d'environ 50 nm de diamètre présente une capside icosaédrique recouverte d'une membrane et contenant l'ARN viral[13]. Il a un génome non segmenté long de 10 kilobases[14] qui code trois protéines structurelles et sept protéines non structurelles[15]. La séquence de l'ARN d'une souche de virus Zika issue de l'épidémie de 2013 en Polynésie française a ainsi montré un génome de 10 617 nucléotides avec un cadre de lecture ouvert de 10 272 nucléotides codant une polyprotéine clivée en les protéines suivantes[16] : protéine de capside C de 105 résidus d'acides aminés ; protéine de prémembrane prM de 187 résidus ; protéine d'enveloppe E de 505 résidus comprenant le motif de glycosylation de 154 résidus précédemment associé à la virulence ; et sept protéines non structurelles : NS1 de 352 résidus ; NS2A de 217 résidus ; NS2B de 139 résidus ; NS3 de 619 résidus, une hélicase[17] ayant une activité de protéase à sérine en complexe NS2B-NS3[18] ; NS4A de 127 résidus ; NS4B de 255 résidus ; NS5 de 904 résidus, une ARN polymérase ARN-dépendante[19].
L'une de ces protéines structurelles, la glycoprotéine d'enveloppe E, encapsule le virus et se lie à la membrane de l'endosome de la cellule hôte pour déclencher l'endocytose[20]. L'ARN viral forme une nucléocapside avec la protéine de capside C de 12 kDa. Cette nucléocapside est enveloppée dans une membrane dérivée de la membrane plasmique de la cellule hôte, modifiée avec deux glycoprotéines virales[21]. La réplication nécessite une ARN polymérase ARN-dépendante.
L'extrémité 5’ de l'ARN viral porte une coiffe tandis que l'extrémité 3’ est dépourvue de queue poly(A) mais forme une épingle à cheveux reconnue par l'exoribonucléase cellulaire XRN1 (en) qui la clive[13].
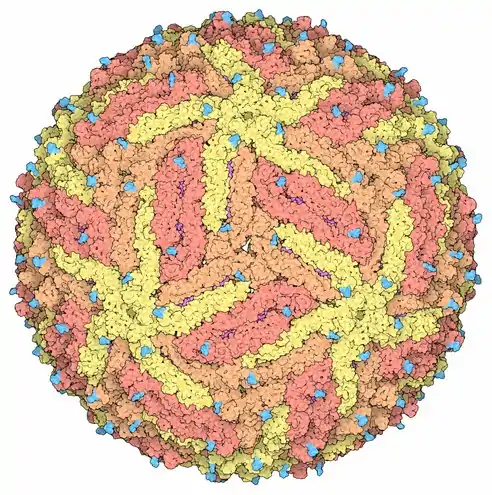 Représentation d'une capside de virus Zika[22] montrant les protéines de capside en jaune, orange et rouge-orangé pour mettre en évidence la symétrie icosaédrique. Les pointes couleur cyan sont des chaînes polyosidiques.
Représentation d'une capside de virus Zika[22] montrant les protéines de capside en jaune, orange et rouge-orangé pour mettre en évidence la symétrie icosaédrique. Les pointes couleur cyan sont des chaînes polyosidiques.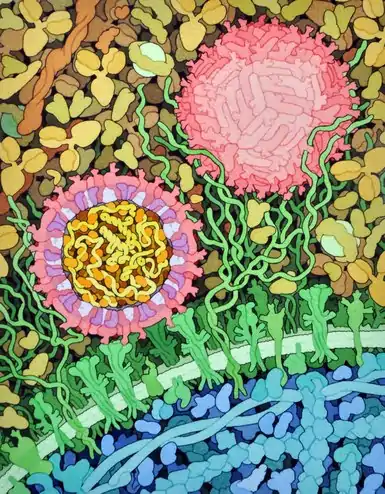 Coupe[22] d'un virion de virus Zika (à gauche) montrant les protéines d'enveloppe E représentées en rouge et les protéines de membrane M en magenta incluses dans la membrane lipidique en violet et interagissant avec les récepteurs membranaires à la surface des cellules en vert. Dans la capside, le génome d'ARN en jaune est lié aux protéines de capside C en orange.
Coupe[22] d'un virion de virus Zika (à gauche) montrant les protéines d'enveloppe E représentées en rouge et les protéines de membrane M en magenta incluses dans la membrane lipidique en violet et interagissant avec les récepteurs membranaires à la surface des cellules en vert. Dans la capside, le génome d'ARN en jaune est lié aux protéines de capside C en orange.
Le virion a un diamètre ne dépassant pas 50 nm avec une capside à géométrie icosaédrique dont chaque face contient trois homodimères de la protéine d'enveloppe E[13], tandis que la protéine transmembranaire M se loge dans l'enveloppe virale et la protéine de capside C contient l'ARN viral.
Infection des cellules hôtes
Une étude a montré que six heures après l'infection de cellules par le virus Zika, les vacuoles et les mitochondries de ces cellules commencent à enfler. Ce gonflement devient suffisamment sévère pour déclencher la paraptose (en) des cellules. Cette forme de mort cellulaire programmée requiert l'expression de certains gènes.
Le virus Zika cible particulièrement les cellules de la peau[23] et les cellules souches neuronales[24], entraînant des malformations sévères chez le nouveau-né[25] et des atteintes neurologiques graves, comme le syndrome de Guillain-Barré[26].
La protéine IFITM3 (en) est une protéine transmembranaire des cellules capable de protéger ces dernières de l'infection virale en bloquant l'attachement du virus. Les cellules les plus sensibles à l'infection au virus Zika sont celles qui ont un faible taux de protéine IFITM3. Une fois les cellules infectées, le virus réorganise le réticulum endoplasmique en formant de grandes vacuoles, ce qui tue la cellule[27].
Maladie
L'infection à virus Zika est une virose généralement asymptomatique avec quelques cas présentant des symptômes peu marqués évoquant la dengue[28] - [29]. Parmi les symptômes de la maladie, on relève fièvre, yeux rouges, douleurs articulaires, maux de tête, éruptions cutanées[28] - [30] - [31]. Ils se prolongent généralement moins d'une semaine et ne sont pas mortels[32], en revanche la transmission du virus de la femme enceinte à son fœtus est susceptible d'entraîner une microcéphalie et diverses autres malformations du cerveau chez le nouveau-né[33] - [34], tandis qu'on peut observer un syndrome de Guillain-Barré chez l'adulte[32].
On peut contracter la maladie essentiellement par piqûre de moustiques du genre Aedes[30], mais elle peut également se transmettre sexuellement ainsi qu'éventuellement lors de transfusions sanguines[30] - [35]. Les femmes enceintes peuvent transmettre le virus à leur bébé[33] - [34]. Le virus peut encore être excrétée dans l'urine à taux élevés plus de 10 jours après le début de la maladie, après qu'on ne le trouve plus dans le sérum[36].
Le diagnostic est réalisé par prélèvement de sang, d'urine ou de salive pour y rechercher la présence d'ARN viral, ou pour rechercher des anticorps dans le sang chez les patients présentant les symptômes depuis plus d'une semaine[28] - [30].
Manipulation de l'hôte, de son odeur et des moustiques par le virus
Comme dans le cas de la dengue et probablement dans le cas d'autres maladies vectorielles dont le vecteur est le moustique, le virus peut modifier l'odeur corporelle de son hôte à son profit, en le rendant plus attractif pour les moustiques, ce qui permet au virus de mieux être géographiquement dispersé et de trouver d'autres hôtes chez lesquels il aura une chance de se faire dupliquer. Ceci a été montré en Chine en 2022, à l'Université Tsinghua (Pékin), chez la souris de laboratoire[37].
La modification de l'odeur de l'hôte lors d'une maladie est connue depuis longtemps. On avait déjà montré que le parasite causant le paludisme change l'odeur corporelle de son hôte, qui attire alors plus les moustiques femelles[38], et ce type de manipulation est également connu chez les végétaux (ex : le virus de la mosaïque du concombre fait libérer par sa plante hôte une molécule attirant les pucerons, qui seront le vecteur de dispersion pour le virus[39]). Les virus Zika et celui de la dengue font que certaines bactéries du microbiote cutané de la souris ou de l'humain produisent environ dix fois plus d'acétophénone que la normale. Et des souris saines ou des humains expérimentalement badigeonnés avec l'acétophénone attirent effectivement plus les moustiques. Il semble que le virus inhibe la production d'une protéine antimicrobienne normalement sécrétée par la peau. Le gène codant pour cette protéine est inhibé chez les souris infectées par le virus Zika (ou de la dengue)[37]. On a constaté que les humains infectés par ces virus produisent plus d'acétophénone au niveau de leurs aisselles que ceux qui ne sont pas infectés. La vitamine A (connue pour traiter certaines affections cutanées) diminue la quantité d'acétophénone exsudée par les animaux ; ce qui en fait un candidat pour les antiviraux, qui sera testé en Malaisie, où la Dengue est endémique[37].
Notes et références
- (en) Cynthia Goldsmith, « Public Health Image Library (PHIL) #20538 », CDC, (consulté le ).
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- (en) Veronica Sikka, Vijay Kumar Chattu, Raaj K. Popli, Sagar C. Galwankar, Dhanashree Kelkar, Stanley G. Sawicki, Stanislaw P. Stawicki et Thomas J. Papadimos, « The emergence of zika virus as a global health security threat: A review and a consensus statement of the INDUSEM Joint working Group (JWG) », Journal of Global Infectious Diseases, vol. 8, no 1, , p. 3-15 (PMID 27013839, PMCID 4785754, DOI 10.4103/0974-777X.176140)
- (en) Oumar Faye, Caio C. M. Freire, Atila Iamarino, Ousmane Faye, Juliana Velasco C. de Oliveira, Mawlouth Diallo, Paolo M. A. Zanotto et Amadou Alpha Sall, « Molecular Evolution of Zika Virus during Its Emergence in the 20th Century », PLoS Neglected Tropical Diseases, vol. 8, no 1, , article no e2636 (PMID 24421913, DOI 10.1371/journal.pntd.0002636, Bibcode 3888466, lire en ligne)
- (en) Edward B. Hayes, « Zika Virus Outside Africa », Emerging Infectious Diseases, vol. 15, no 9, , p. 1347-1350 (PMID 19788800, PMCID 2819875, DOI 10.3201/eid1509.090442, lire en ligne)
- (en) G. W. A. Dick, S. F. Kitchen et A. J. Haddow, « Zika Virus (I). Isolations and serological specificity », Transactions of the Royal Society of Tropical Medicine & Hygiene, vol. 46, no 5, , p. 509-520 (PMID 12995440, DOI 10.1016/0035-9203(52)90042-4, lire en ligne)
- « Déclaration sur la 1ère réunion du Comité d’urgence du Règlement sanitaire international concernant le virus Zika », OMS, (consulté le ).
- (en) Antoine Enfissi, John Codrington, Jimmy Roosblad, Mirdad Kazanji et Dominique Rousset, « Zika virus genome from the Americas », The Lancet, vol. 387, no 10015, , p. 227-228 (PMID 26775124, DOI 10.1016/S0140-6736(16)00003-9, lire en ligne).
- (en) Camila Zanluca, Vanessa Campos Andrade de Melo, Ana Luiza Pamplona Mosimann, Glauco Igor Viana dos Santos, Claudia Nunes Duarte dos Santos et Kleber Luz, « First report of autochthonous transmission of Zika virus in Brazil », Memórias do Instituto Oswaldo Cruz, vol. 110, no 4, , p. 569-572 (PMID 26061233, PMCID 4501423, DOI 10.1590/0074-02760150192, lire en ligne)
- (en) Robert S. Lanciotti, Amy J. Lambert, Mark Holodniy, Sonia Saavedra et Leticia del Carmen Castillo Signor, « Phylogeny of Zika Virus in Western Hemisphere, 2015 », Emerging Infectious Diseases, vol. 22, no 5, , p. 933-935 (PMID 27088323, PMCID 4861537, DOI 10.3201/eid2205.160065, lire en ligne)
- (en) Arunachalam Ramaiaha, Lei Dai, Deisy Contreras, Sanjeev Sinha, Ren Sun, Vaithilingaraja Arumugaswami, « Comparative analysis of protein evolution in the genome of pre-epidemic and epidemic Zika virus », Infection, Genetics and Evolution, vol. 51, , p. 74-85 (PMID 28315476, DOI 10.1016/j.meegid.2017.03.012, lire en ligne)
- (en) Patrícia Brasil, Guilherme Amaral Calvet, André Machado Siqueira, Mayumi Wakimoto, Patrícia Carvalho de Sequeira, Aline Nobre, Marcel de Souza Borges Quintana, Marco Cesar Lima de Mendonça, Otilia Lupi, Rogerio Valls de Souza, Carolina Romero, Heruza Zogbi, Clarisse da Silveira Bressan, Simone Sampaio Alves, Ricardo Lourenço-de-Oliveira, Rita Maria Ribeiro Nogueira, Marilia Sá Carvalho, Ana Maria Bispo de Filippis et Thomas Jaenisch, « Zika Virus Outbreak in Rio de Janeiro, Brazil: Clinical Characterization, Epidemiological and Virological Aspects », PLoS Neglected Tropical Diseases, vol. 10, no 4, , article no e0004636 (PMID 27070912, PMCID 4829157, DOI 10.1371/journal.pntd.0004636, lire en ligne)
- (en) « Zika virus », ExPASy (consulté le ).
- (en) G. Kuno et G.-J. J. Chang, « Full-length sequencing and genomic characterization of Bagaza, Kedougou, and Zika viruses », Archives of Virology, vol. 152, no 4, , p. 687-696 (PMID 17195954, DOI 10.1007/s00705-006-0903-z, lire en ligne)
- (en) Bryan D. Cox, Richard A. Stanton et Raymond F. Schinazi, « Predicting Zika virus structural biology: Challenges and opportunities for intervention », Antiviral Chemistry and Chemotherapy, vol. 24, nos 3-4, , p. 118-126 (PMID 27296393, PMCID 5890524, DOI 10.1177/2040206616653873, lire en ligne)
- (en) Cécile Baronti, Géraldine Piorkowski, Rémi N. Charrel, Laetitia Boubis, Isabelle Leparc-Goffart et Xavier de Lamballerie, « Complete Coding Sequence of Zika Virus from a French Polynesia Outbreak in 2013 », Genome Announcements, vol. 2, no 3, , e00500-e00514 (PMID 24903869, PMCID 4047448, DOI 10.1128/genomeA.00500-14, lire en ligne)
- (en) Rinku Jain, Javier Coloma, Adolfo García-Sastre et Aneel K Aggarwal, « Structure of the NS3 helicase from Zika virus », Nature Structural & Molecular Biology, vol. 23, no 8, , p. 752-754 (PMID 27399257, PMCID 5085289, DOI 10.1038/nsmb.3258, lire en ligne)
- (en) Andre S. Godoy, Gustavo M. A. Lima, Ketllyn I. Z. Oliveira, Naiara U. Torres, Fernando V. Maluf, Rafael V. C. Guido et Glaucius Oliva, « Crystal structure of Zika virus NS5 RNA-dependent RNA polymerase », Nature Communications, vol. 8, , article no 14764 (PMID 28345596, PMCID 5378953, DOI 10.1038/ncomms14764, Bibcode 2017NatCo...814764G, lire en ligne)
- (en) Lianpan Dai, Jian Song, Xishan Lu, Yong-Qiang Deng, Abednego Moki Musyoki, Huijun Cheng, Yanfang Zhang, Yuan Yuan, Hao Song, Joel Haywood, Haixia Xiao, Jinghua Yan, Yi Shi, Cheng-Feng Qin, Jianxun Qi et George F. Gao, « Structures of the Zika Virus Envelope Protein and Its Complex with a Flavivirus Broadly Protective Antibody », Cell Host Microbe, vol. 19, no 5, , p. 696-704 (PMID 27158114, DOI 10.1016/j.chom.2016.04.013, lire en ligne)
- (en) Theodore C. Pierson et Michael S. Diamond, « Degrees of maturity: the complex structure and biology of flaviviruses », Current Opinion in Virology, vol. 2, no 2, , p. 168-175 (PMID 22445964, PMCID 3715965, DOI 10.1016/j.coviro.2012.02.011, lire en ligne)
- (en) « Zika Virus », PDB, (consulté le ).
- (en) Rodolphe Hamel, Ophélie Dejarnac, Sineewanlaya Wichit, Peeraya Ekchariyawat, Aymeric Neyret, Natthanej Luplertlop, Manuel Perera-Lecoin, Pornapat Surasombatpattana, Loïc Talignani, Frédéric Thomas, Van-Mai Cao-Lormeau, Valérie Choumet, Laurence Briant, Philippe Desprès, Ali Amara, Hans Yssel et Dorothée Missé, « Biology of Zika Virus Infection in Human Skin Cells », Journal of Virology, vol. 89, no 17, , p. 8880-8896 (PMID 26085147, PMCID 4524089, DOI 10.1128/JVI.00354-15, lire en ligne)
- (en) Hengli Tang, Christy Hammack, Sarah C. Ogden, Zhexing Wen, Xuyu Qian, Yujing Li, Bing Yao, Jaehoon Shin, Feiran Zhang, Emily M. Lee, Kimberly M. Christian, Ruth A. Didier, Peng Jin, Hongjun Song et Guo-li Ming, « Zika Virus Infects Human Cortical Neural Precursors and Attenuates Their Growth », Cell Stem Cell, vol. 18, no 5, , p. 587-590 (PMID 26952870, PMCID 5299540, DOI 10.1016/j.stem.2016.02.016, lire en ligne)
- (en) Jonathan J. Miner, Bin Cao, Jennifer Govero, Amber M. Smith, Estefania Fernandez, Omar H. Cabrera, Charise Garber, Michelle Noll, Robyn S. Klein, Kevin K. Noguchi, Indira U. Mysorekar et Michael S. Diamond, « Zika virus infection during pregnancy in mice causes placental damage and fetal demise », Cell, vol. 165, no 5, , p. 1081-1091 (PMID 27180225, PMCID 4874881, DOI 10.1016/j.cell.2016.05.008, lire en ligne)
- (en) Fernanda R. Cugola, Isabella R. Fernandes, Fabiele B. Russo, Beatriz C. Freitas, j oão L. M. Dias, Katia P. Guimarães, Cecília Benazzato, nathalia Almeida, Graciela C. Pignatari, Sarah Romero, Carolina M. Polonio, Isabela Cunha, Carla L. Freitas, Wesley n. Brandão, Cristiano Rossato, David G. Andrade, Daniele de P. Faria, Alexandre T. Garcez, Carlos A. Buchpigel, Carla T. Braconi, erica Mendes, Amadou A. Sall, Paolo M. de A. Zanotto, j ean Pierre S. Peron, Alysson R. Muotri et Patricia C. B. Beltrão-Braga, « The Brazilian Zika virus strain causes birth defects in experimental models », Nature, vol. 534, no 7606, , p. 267-271 (PMID 27279226, PMCID 4902174, DOI 10.1038/nature18296, Bibcode 2016Natur.534..267C, lire en ligne)
- (en) Blandine Monel, Alex A Compton, Timothée Bruel, Sonia Amraoui, Julien Burlaud‐Gaillard, Nicolas Roy, Florence Guivel‐Benhassine, Françoise Porrot, Pierre Génin, Laurent Meertens, Laura Sinigaglia, Nolwenn Jouvenet, Robert Weil, Nicoletta Casartelli, Caroline Demangel, Etienne Simon‐Lorière, Arnaud Moris, Philippe Roingeard, Ali Amara et Olivier Schwartz, « Zika virus induces massive cytoplasmic vacuolization and paraptosis‐like death in infected cells », The EMBO Journal, vol. 36, no 12, , p. 1653-1668 (PMID 28473450, DOI 10.15252/embj.201695597, Bibcode 5470047, lire en ligne)
- « Maladie à virus Zika », OMS, (consulté le ).
- (en) « Zika virus disease », Centre européen de prévention et de contrôle des maladies (ECDC) (consulté le ).
- (en) Lin H. Chen et Davidson H. Hamer, « Zika Virus: Rapid Spread in the Western Hemisphere », Annals of Internal Medicine, vol. 164, no 9, , p. 613-615 (PMID 26832396, DOI 10.7326/M16-0150, lire en ligne)
- (en) D. Musso, E. J. Nilles et V.-M. Cao-Lormeau, « Rapid spread of emerging Zika virus in the Pacific area », Clinical Mircobiology and Infection, vol. 20, no 10, , O595-O596 (PMID 24909208, DOI 10.1111/1469-0691.12707, lire en ligne)
- (en) « Factsheet about Zika virus disease », Centre européen de prévention et de contrôle des maladies (ECDC), (consulté le ).
- (en) Sonja A. Rasmussen, Denise J. Jamieson, Margaret A. Honein et Lyle R. Petersen, « Zika Virus and Birth Defects — Reviewing the Evidence for Causality », The New England Journal of Medicine, vol. 374, no 20, , p. 1981-1987 (PMID 27074377, DOI 10.1056/NEJMsr1604338, lire en ligne)
- (en) « CDC Concludes Zika Causes Microcephaly and Other Birth Defects », Centres pour le contrôle et la prévention des maladies (CDC), (consulté le ).
- (en) Alexandra M. Oster, Kate Russell, Jo Ellen Stryker, Allison Friedman, Rachel E. Kachur, Emily E. Petersen, Denise J. Jamieson, Amanda C. Cohn et John T. Brooks, « Update: Interim Guidance for Prevention of Sexual Transmission of Zika Virus — United States, 2016 », Morbidity and Mortality Weekly Report (MMWR), vol. 65, no 12, , p. 323-325 (PMID 27032078, DOI 10.15585/mmwr.mm6512e3, lire en ligne)
- Gourinat A.C, O’Connor O, Calvez E, Goarant C & Dupont-Rouzeyrol M (2015) Detection of Zika virus in urine. Emerging infectious diseases, 21(1), 84
- (en) Freda Kreier, « How some viruses make people smell extra-tasty to mosquitoes », Nature, (DOI 10.1038/d41586-022-01764-2, lire en ligne, consulté le )
- « Correction for Sharp et al., Psychological targeting », Proceedings of the National Academy of Sciences, vol. 115, no 39, (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.1814739115, lire en ligne, consulté le )
- Maliheh Safari, Matthew J. Ferrari et Marilyn J. Roossinck, « Manipulation of Aphid Behavior by a Persistent Plant Virus », Journal of Virology, vol. 93, no 9, (ISSN 0022-538X et 1098-5514, DOI 10.1128/jvi.01781-18, lire en ligne, consulté le )