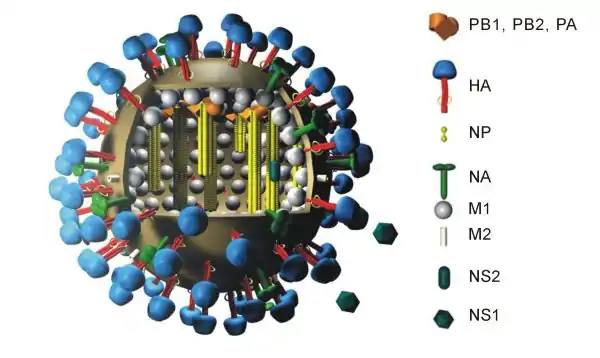
Virus à ARN
Un virus à ARN, parfois appelé ribovirus, est un virus dont le matériel génétique est constitué d'ARN. Cet acide nucléique est généralement monocaténaire (ssRNA), mais peut également être bicaténaire (dsRNA)[2]. Les virus à ARN peuvent provoquer diverses maladies humaines telles que la maladie à virus Ebola, le SRAS, la grippe, l'hépatite C, la fièvre du Nil occidental, la poliomyélite, la rougeole ou encore la Covid-19.
Le Comité international de taxonomie des virus (International Committee on Taxonomy of Viruses - ICTV) les range dans les groupes III, IV et V de la classification de Baltimore.
Toutefois l'ICTV range dans le groupe VI des rétrovirus — et les considère comme distincts des virus à ARN, les virus dont le matériel génétique est constitué d'ARN mais dont le cycle de vie passe par une rétrotranscription en ADN : le VIH en est un exemple.
Le premier séquençage d'un gène puis du génome d'un virus à ARN a été réalisé en 1976 par une équipe gantoise sur le bactériophage MS2[3]. Les virus à ARN présentent des taux de mutation très élevés[4], contrairement aux virus à ADN : la réplication est sensible aux erreurs, et ces virus ne possèdent pas les ADN polymérases permettant de détecter et corriger ces erreurs, d'où des formes plus ou moins virulentes.
Caractéristiques
Virus à ARN monocaténaire
Les virus à ARN peuvent également être classés, selon la polarité de leur ARN, en virus à polarité négative (antisens), à polarité positive (sens), ou à double polarité (ambisens). Un ARN à polarité positive est identique à celle des ARN messagers viraux de sorte que l'ARN viral peut être immédiatement traduit par la cellule hôte. Un ARN viral antisens est complémentaire de l'ARN messager et doit donc être converti en ARN sens par une ARN polymérase ARN-dépendante pour pouvoir être traduit en protéines. En tant que tel, l’ARN purifié d'un virus à ARN à polarité positive peut provoquer directement une infection bien qu’il puisse être moins infectieux que le virus entier. L’ARN purifié « antisens » d'un virus n'est pas infectieux par lui-même car il doit d’abord être transcrit en ARN à polarité positive, mais chaque virion peut être transcrit en ARN de polarité positive ou négative. Les virus à ARN ambisens ressemblent aux virus à ARN antisens, au détail près qu’ils transcrivent également des gènes à partir du brin sens[5].
Virus à ARN bicaténaire
Les virus à ARN bicaténaire constituent un groupe hétérogène de virus largement répandus chez toute une gamme d'hôtes (humains, animaux, plantes, mycètes et bactéries), dont le génome présente un nombre variable de segments (de un à douze) dont la géométrie de la capside est également très variable. Parmi les membres de ce groupe on compte les rotavirus, connus dans le monde entier comme étant la cause la plus fréquente de gastro-entérite chez les jeunes enfants, et le virus de la fièvre catarrhale du mouton[6] - [7], un agent pathogène atteignant les bovins et les moutons avec d’importantes conséquences économiques. Ces dernières années, des progrès remarquables ont été accomplis dans la détermination, au niveau atomique et subnanométrique, de la structure d'un certain nombre de protéines virales déterminantes constitutives de la capside du virion de plusieurs virus à ARN bicaténaire, en soulignant des parallèles importants dans la structure et les processus de réplication d'un grand nombre de ces virus[2].
Taux de mutation
Les virus à ARN ont en général un taux de mutation élevé, à défaut d’ADN polymérase susceptible de repérer et corriger les erreurs, et sont donc incapables de procéder à la réparation de l'ARN du matériel génétique endommagé. Les virus à ADN ont un taux de mutation considérablement plus faible en raison de la capacité de correction des ADN polymérases sans l’intervention de la cellule hôte[8]. Les rétrovirus ont un fort taux de mutation, même si leur ADN intermédiaire s’intègre dans le génome de l'hôte (et est donc soumis à relecture, une fois intégré à l'ADN de l'hôte), parce que les erreurs lors de la transcription inverse sont intégrées dans les deux brins de l'ADN préalablement à leur formation.
Bien que l'ARN mute en général rapidement, une étude de 2004 a révélé que le virus du SRAS-COV1 contient un génome qui mute très lentement par rapport à ce qui serait attendu si les mutations n'étaient pas contrôlées du tout[9]. Le génome en question possède une structure tridimensionnelle complexe qui est supposée fournir une fonction chimique nécessaire à la propagation virale, peut-être comme un ribozyme. Ainsi, la plupart des mutations le rendraient impropre à cette fin et l’empêcheraient de les propager.
Réplication
Les virus à ARN chez les animaux sont classés[10] en trois groupes distincts en fonction de leur génome et de leur mode de réplication (de leur groupe dans l'ancienne classification de Baltimore).
- Les virus à ARN double brin (groupe III) contiennent une douzaine de molécules d'ARN différentes, chacune codant une ou plusieurs protéines virales.
- Les virus à ARN à simple brin à polarité positive (groupe IV) utilisent directement leur génome comme s'il s'agissait d'un ARN messager, produisant une protéine unique, qui est modifiée par l'hôte et des protéines virales qui forment les diverses protéines nécessaires à la réplication. L’une d’elles est l'ARN polymérase ARN-dépendante, qui copie l'ARN viral pour former une matrice réplicative bicaténaire qui, à son tour, permet d’entraîner la formation de nouveaux virions.
- Les virus à ARN à simple brin à polarité négative (Groupe V) dont le génome doit être copié par une ARN polymérase pour former un ARN à polarité positive. Cela signifie que le virus doit emporter avec lui l’ARN polymérase ARN-dépendante. La molécule d'ARN à polarité positive agit alors comme un ARN messager viral qui est traduit en protéines par les ribosomes de l'hôte. La protéine qui en résulte continue à commander la synthèse de nouveaux virions, ainsi que les protéines de la capside et l'ARN réplicase, qui est utilisée pour produire de nouvelles molécules d’ARN à polarité négative.
- Les rétrovirus (groupe VI) ont un génome d’ARN à simple brin, mais ne sont généralement pas considérés comme des virus à ARN, car ils utilisent des ADN intermédiaires pour se répliquer. La transcriptase inverse, une enzyme qui provient du virus lui-même après qu’il a perdu sa membrane, convertit l'ARN viral en un brin d'ADN complémentaire, qui est copié pour produire une molécule d'ADN viral bicaténaire. Ensuite cet ADN est intégré et l'expression des gènes codés peut entraîner la formation de nouveaux virions.
Groupe III : virus à ARN bicaténaire (dsRNA)
- Famille des Birnaviridae
- Famille des Chrysoviridae
- Famille des Cystoviridae
- Famille des Hypoviridae
- Famille des Partitiviridae
- Famille des Reoviridae, dont les Rotavirus
- Famille des Totiviridae
- Genres incertae sedis
- Endornavirus
Source[8].
Groupe IV : virus à ARN monocaténaire à polarité positive ((+)ssRNA)
- Ordre des Nidovirales
- Famille des Arteriviridae
- Famille des Coronaviridae, dont les Coronavirus et notamment le SARS-CoV (responsable du SRAS) et le SARS-CoV-2 (responsable de la maladie à coronavirus 2019)
- Famille des Roniviridae
- incertae sedis
- Famille des Astroviridae
- Famille des Barnaviridae
- Famille des Bromoviridae
- Famille des Caliciviridae , dont le virus de Norwalk
- Famille des Closteroviridae
- Famille des Comoviridae
- Famille des Dicistroviridae
- Famille des Flaviviridae , dont le virus de la fièvre jaune, le virus du Nil occidental, virus de l'hépatite C et le virus de la dengue
- Famille des Flexiviridae
- Famille des Leviviridae
- Famille des Luteoviridae
- Famille des Marnaviridae
- Famille des Narnaviridae
- Famille des Nodaviridae
- Famille des Picornaviridae, dont les poliovirus, les rhinovirus, le virus de l'hépatite A
- Famille des Potyviridae
- Famille des Sequiviridae
- Famille des Tetraviridae
- Famille des Togaviridae , dont le virus de la rubéole, le virus de la Ross River, le virus de Sindbis et le virus du Chikungunya
- Famille des Tombusviridae
- Famille des Tymoviridae
- Famille des Virgaviridae, comprenant les six genres suivants[11] :
- Genre Furovirus
- Genre Hordeivirus
- Genre Pecluvirus
- Genre Pomovirus
- Genre Tobamovirus, dont le virus de la mosaïque du tabac
- Genre Tobravirus
- Genres incertae sedis
- Genre Benyvirus
- Genre Cheravirus
- Genre Hepevirus, dont le virus de l’hépatite E
- Genre Idaeovirus
- Genre Ourmiavirus
- Genre Sadwavirus
- Genre Sobemovirus
- Genre Umbravirus
Source[8].
Groupe V : virus à ARN monocaténaire à polarité négative ((-)ssRNA)
- Ordre des Mononegavirales
- Famille des Bornaviridae, dont les Bornaviridae
- Famille des Filoviridae , dont le virus Ebola et le virus de Marburg
- Famille des Paramyxoviridae , dont le virus de la rougeole, le virus ourlien des oreillons et les Henipavirus
- Famille des Rhabdoviridae , dont le virus de la rage
- incertae sedis
- Famille des Arenaviridae , dont le virus de la fièvre de Lassa
- Famille des Bunyaviridae , dont les Hantavirus et le virus de la fièvre Congo-Crimée
- Famille des Orthomyxoviridae , dont les virus de la grippe
- Genres incertae sedis :
- Genre Deltavirus
- Genre Nyavirus[12], dont les virus Nyamanini et Midway
- Genre Ophiovirus
- Genre Tenuivirus
- Genre Varicosavirus
Source[8].
Références
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- (en) Patton JT (editor). (trad. du danois), Segmented Double-stranded RNA Viruses : Structure and Molecular Biology, Norfolk, Caister Academic Press, , 373 p. (ISBN 978-1-904455-21-9, LCCN 2008371444, lire en ligne)
- (en) W. Fiers, R. Contreras, F. Duerinck, G. Haegeman, D. Iserentant, J. Merregaert, W. Min Jou, F. Molemans, A. Raeymaekers, A. Van den Berghe, G. Volckaert et M. Ysebaert, « Complete nucleotide sequence of bacteriophage MS2 RNA: primary and secondary structure of the replicase gene », Nature, vol. 260, no 5551, , p. 500-507 (PMID 1264203, DOI 10.1038/260500a0, Bibcode 1976Natur.260..500F, lire en ligne, consulté le )
- À ce propos, lire aussi Rétrovirus.
- (en) Marie Nguyen et Anne-Lise Haenni, « Expression strategies of ambisense viruses », Virus Research, vol. 93, no 2, , p. 141-150 (PMID 12782362, DOI 10.1016/S0168-1702(03)00094-7, lire en ligne, consulté le )
- (en) Roy P (trad. du danois), Animal Viruses : Molecular Biology, Norfolk, Caister Academic Press, , 531 p. (ISBN 978-1-904455-22-6, LCCN 2008353533, lire en ligne), « Molecular Dissection of Bluetongue Virus ».
- (en) Roy P (trad. du danois), Segmented Double-stranded RNA Viruses : Structure and Molecular Biology, Norfolk, Caister Academic Press, , 373 p. (ISBN 978-1-904455-21-9, LCCN 2008371444, lire en ligne), « Structure and Function of Bluetongue Virus and its Proteins ».
- (en) Klein, Donald W. ; Prescott, Lansing M. ; Harley, John (trad. du danois), Microbiology, Dubuque, Iowa, Wm. C. Brown, , 2e éd. (ISBN 978-0-697-01372-9).
- (en) Michael P Robertson, Haller Igel, Robert Baertsch, David Haussler, Manuel Ares Jr et William G Scott, « The Structure of a Rigorously Conserved RNA Element within the SARS Virus Genome », PLoS Biology, vol. 3, no 1, , e5 (PMID 15630477, PMCID 539059, DOI 10.1371/journal.pbio.0030005, lire en ligne, consulté le )
- ICTV
- (en) Michael J. Adams, John F. Antoniw et Jan Kreuze, « Virgaviridae: a new family of rod-shaped plant viruses », Archives of Virology, vol. 154, no 12, , p. 1967-1972 (PMID 19862474, DOI 10.1007/s00705-009-0506-6, lire en ligne, consulté le )
- (en) Kathie A. Mihindukulasuriya, Nang L. Nguyen, Guang Wu, Henry V. Huang, Amelia P. A. Travassos da Rosa, Vsevolod L. Popov, Robert B. Tesh et David Wang, « Nyamanini and Midway Viruses Define a Novel Taxon of RNA Viruses in the Order Mononegavirales », Journal of Virology, vol. 83, no 10, , p. 5109-5116 (PMID 19279111, PMCID 2682064, DOI 10.1128/JVI.02667-08, lire en ligne, consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « RNA virus » (voir la liste des auteurs).