Hépatite D
L’Hépatite D est une maladie provoquée par un petit virus à ARN circulaire (virus de l'hépatite delta ou virus de l'hépatite D, VHD, Hepatitis delta virus, HDV). Le VHD est considéré comme un sous virus satellite, car il ne peut se propager qu’en présence d'un autre virus, notamment le virus de l'hépatite B (HBV)[alpha 1]. La transmission du VHD peut se produire soit par le biais d’une infection simultanée par le HBV (co-infection) soit par infection d'une personne déjà porteuse du virus de l'hépatite B (surinfection).
| Royaume | Ribozyviria |
|---|---|
| Famille | Kolmioviridae |
| Genre | Deltavirus |

| Traitement | Interféron et transplantation hépatique |
|---|---|
| Spécialité | Infectiologie |
| CISP-2 | D72 |
|---|---|
| CIM-10 | B17.0, B18.0 |
| CIM-9 | 070.31 |
| DiseasesDB | 5792 |
| MedlinePlus | 000216 |
| eMedicine | 178038 |
| MeSH | D003699 |
![]() Mise en garde médicale
Mise en garde médicale
Qu’il s’agisse d’une co-infection ou d’une surinfection, le VHD est responsable de complications plus graves qu’en cas d'infection par le VHB seul. Parmi ces complications, on cite une probabilité plus élevée de développer une insuffisance hépatique dans les infections aiguës et un risque accru de développer un cancer du foie dans les infections chroniques. En combinaison avec le virus de l'hépatite B, l'hépatite D est responsable du plus haut taux de mortalité de toutes les hépatites virales soit 20 %[4].
Virologie
Structure du génome et similitudes avec les viroïdes
Le génome du VHD se présente sous la forme d’un simple brin d’ARN circulaire et fermé, enroulé dans le sens négatif. En raison d'une séquence de nucléotides qui est à 70 % auto-complémentaire, son génome forme une structure d’ARN partiellement à double brin qui est décrite comme une structure en bâtonnet. Avec un génome d'environ 1 700 nucléotides, le VHD est le plus petit « virus » connu capable d’infecter des animaux.
Toutefois, il a été suggéré que le VHD pouvait trouver son origine dans une classe de virus infectant les plantes et appelés viroïdes. Les preuves avancées à l'appui de cette hypothèse découlent du fait que le VHD et les viroïdes ont une structure de simple brin d’ARN circulaire et fermé en forme de bâtonnet. De même, le VHD et les viroïdes contiennent des séquences d'ARN capables d’exercer l’activité catalytique des structures qu’on appelle les ribozymes.
Au cours de la réplication virale, ces ARN catalytiques sont nécessaires pour produire des copies unitaires de fragments d’ARN du génome avant de les assembler. Enfin, ni le VHD ni les viroïdes ne sont capables d’encoder leurs propres polymérases. À défaut, pour leur réplication, les viroïdes et le VHD ont besoin d'un hôte dont ils peuvent utiliser la polymérase d'ARN comme matrice.
Antigènes Delta
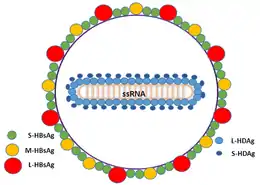
Une différence significative entre les viroïdes et le VHD est le fait que, alors que les viroïdes ne produisent pas de protéines, le VHD produit deux protéines appelées le petit et le grand antigène delta (HDAg-S et HDAg-L, respectivement). Ces deux protéines sont produites à partir de l’ouverture et de la lecture d'une seule matrice.
Ils sont identiques pour 195 acides aminés et ne diffèrent que par la présence de 19 acides aminés supplémentaires, à l’extrémité C du HDAg-L. Bien qu'elles aient 90 % de leurs séquences identiques, ces deux protéines jouent des rôles différents au cours d'une infection. Le HDAg-S est produit dans les premiers stades de l’infection et il est indispensable à la réplication virale. HDAg-L, en revanche, est produit pendant les dernières étapes de l’infection, il agit comme un inhibiteur de la réplication virale, et il est indispensable pour l'assemblage des particules virales.
Cycle de vie
Comme l'hépatite B, le VHD pénètre dans les cellules hépatiques via le transporteur biliaire NTCP[5], et reconnaît son récepteur via l'extrémité N-terminale du grand antigène de surface de l'hépatite B : HBsAg[6]. La cartographie par mutagenèse de ce domaine a montré que les résidus d'acides aminés 9 à 15 constituent le site de liaison au récepteur[7]. Après avoir pénétré dans l'hépatocyte, le virus est nu et sa nucléocapside est transloquée vers le noyau. Étant donné que le génome du VHD ne code pas pour une ARN polymérase pour répliquer le génome du virus, le virus utilise l'ARN polymérases de sa cellule hôte.
En plus de l'ARN polymérase II[8] - [9], il a été récemment démontré que les ARN polymérases I et III sont également impliquées dans sa réplication[10]. L'ARN polymérase II utilise l'ADN comme matrice pour produire de l'ARNm. Par conséquent, si le VHD utilise effectivement l'ARN polymérase II pendant la réplication, ce serait le seul pathogène animal connu capable d'utiliser une polymérase ADN-dépendante comme polymérase ARN-dépendante.
Trois formes d'ARN sont fabriquées : un ARN génomique circulaire, un ARN antigénomique complémentaire circulaire et un ARN antigénomique polyadénylé linéaire, qui est l'ARNm contenant le cadre de lecture ouvert pour le HDAg. La synthèse de l'ARN antigénomique se produit dans le nucléole, médiée par l'ARN polymérase I, tandis que la synthèse de l'ARN génomique a lieu dans le nucléoplasme, médiée par l'ARN polymérase II[11]. L'ARN du VHD est d'abord synthétisé sous forme d'ARN linéaire qui contient de nombreuses copies de son génome. Les ARN génomique et antigénomique contiennent une séquence de 85 nucléotides pour le ribozyme, qui auto-clive l'ARN linéaire en monomères. Ces monomères sont ensuite ligaturés pour former un ARN circulaire[12] - [13].
Épidémiologie
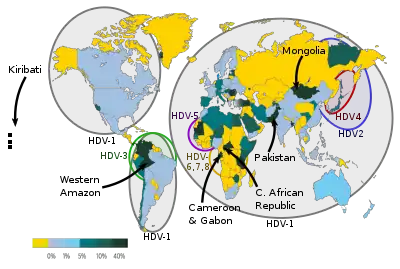
Les personnes touchées sont des personnes qui ont été infectées par le virus de l'hépatite B, car le virus de l'hépatite D a besoin de l'HBsAg (antigène de surface de l'hépatite B) pour sa réplication.
L'infection par le VHD est un fléau majeur dans les régions à faible revenu du globe où le VHB reste endémique. Il est donc le plus répandu dans les pays où l'infection par le VHB est également courante : actuellement le bassin amazonien et les régions à faible revenu d'Asie et d'Afrique.
L'amélioration des mesures de lutte contre le VHB dans les pays industrialisés (principalement la vaccination) a également réduit la prévalence du VHD, les principales populations à risque restantes dans ces pays étant les utilisateurs de drogues injectables et les immigrants provenant de zones d'endémie du VHD[15].
Transmission
Les voies de transmission de l'hépatite D sont similaires à celles de l'hépatite B. L'infection est largement limitée aux personnes à haut risque d'infection par l'hépatite B, en particulier les consommateurs de drogues injectables et les personnes recevant des facteurs de coagulation. Dans le monde, plus de 15 millions de personnes sont co-infectées. Le VHD est rare dans la plupart des pays développés et est principalement associé à l'usage de drogues par voie intraveineuse. Au total, environ 20 millions de personnes pourraient être infectées par le VHD[16].
Personnes à risque
Comme indiqué précédemment, les patients diagnostiqués avec l'hépatite B sont à risque d'infection par l'hépatite D. Le risque d'infection par l'hépatite D augmente si une personne utilise des drogues injectables, est hémophile, si elle est sous hémodialyse ou par contact sexuel avec d'autres personnes infectées.
Prévention
Le vaccin contre l'hépatite B protège contre le virus de l'hépatite D puisque ce dernier dépend de la présence du virus de l'hépatite B pour sa réplication[17] - [18], il fait partie des 11 vaccins obligatoires pour les nouveau-nés à partir du . Les préservatifs peuvent aider à réduire le taux de transmission. Les patients atteints d'hépatite B doivent éviter les tatouages ou les piercings car les aiguilles sont une voie de transmission.
Notes et références
Notes
- Le virus de l'hépatite D est capable, in vitro comme in vivo, d'utiliser l'enveloppe d'autres virus que le VHB, comme le virus de l'hépatite C, et même des virus d'autres genres, comme le virus de la dengue[2] - [3].
Références
- ICTV. International Committee on Taxonomy of Viruses. Taxonomy history. Published on the Internet https://talk.ictvonline.org/., consulté le 28 février 2021
- « L'hépatite D, un virus qui en utilise d'autres », sur CNRS, (consulté le ).
- (en) Jimena Perez-Vargas, Fouzia Amirache, Bertrand Boson, Chloé Mialon, Natalia Freitas et al., « Enveloped viruses distinct from HBV induce dissemination of hepatitis D virus in vivo », Nature Communications, vol. 10, , article no 2098 (DOI 10.1038/s41467-019-10117-z).
- Stéphane Biacchesi, Christophe Chevalier, Marie Galloux, Christelle Langevin, Ronan Le Goffic et Michel Brémont, Les virus : Ennemis ou alliés ?, Versailles, Quæ, coll. « Enjeux Sciences », , 112 p. (ISBN 978-2-7592-2627-6, lire en ligne), IV. Pourquoi certains virus sont-ils dangereux ?, chap. 11 (« Y a-t-il beaucoup d'hépatites virales dans le monde ? »), p. 100, accès libre.
- (en) Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, Huang Y, Qi Y, Peng B, Wang H, Fu L, Song M, Chen P, Gao W, Ren B, Sun Y, Cai T, Feng X, Sui J, Li W, « Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus », eLife, vol. 1, , p. 49 (PMID 23150796, PMCID 3485615, DOI 10.7554/eLife.00049)
- (en) Engelke M, Mills K, Seitz S, Simon P, Gripon P, Schnölzer M, Urban S, « Characterization of a hepatitis B and hepatitis delta virus receptor binding site », Hepatology, vol. 43, no 4, , p. 750–60 (PMID 16557545, DOI 10.1002/hep.21112, S2CID 23549907)
- Schulze A, Schieck A, Ni Y, Mier W, Urban S, « Fine mapping of pre-S sequence requirements for hepatitis B virus large envelope protein-mediated receptor interaction », Journal of Virology, vol. 84, no 4, , p. 1989–2000 (PMID 20007265, PMCID 2812397, DOI 10.1128/JVI.01902-09)
- (en) Lehmann E, Brueckner F, Cramer P, « Molecular basis of RNA-dependent RNA polymerase II activity », Nature, vol. 450, no 7168, , p. 445–449 (PMID 18004386, DOI 10.1038/nature06290, Bibcode 2007Natur.450..445L, hdl 11858/00-001M-0000-0015-7EE1-9, S2CID 4393153)
- (en) Filipovska J, Konarska MM, « Specific HDV RNA-templated transcription by pol II in vitro », RNA, vol. 6, no 1, , p. 41–54 (PMID 10668797, PMCID 1369892, DOI 10.1017/S1355838200991167)
- (en) Greco-Stewart VS, Schissel E, Pelchat M, « The hepatitis delta virus RNA genome interacts with the human RNA polymerases I and III », Virology, vol. 386, no 1, , p. 12–15 (PMID 19246067, DOI 10.1016/j.virol.2009.02.007)
- (en) Li YJ, Macnaughton T, Gao L, Lai MM, « RNA-templated replication of hepatitis delta virus: genomic and antigenomic RNAs associate with different nuclear bodies », Journal of Virology, vol. 80, no 13, , p. 6478–86 (PMID 16775335, PMCID 1488965, DOI 10.1128/JVI.02650-05)
- (en) Branch AD, Benenfeld BJ, Baroudy BM, Wells FV, Gerin JL, Robertson HD, « An ultraviolet-sensitive RNA structural element in a viroid-like domain of the hepatitis delta virus », Science, vol. 243, no 4891, , p. 649–52 (PMID 2492676, DOI 10.1126/science.2492676, Bibcode 1989Sci...243..649B)
- Wu HN, Lin YJ, Lin FP, Makino S, Chang MF, Lai MM, « Human hepatitis delta virus RNA subfragments contain an autocleavage activity », Proceedings of the National Academy of Sciences of the United States of America, vol. 86, no 6, , p. 1831–5 (PMID 2648383, PMCID 286798, DOI 10.1073/pnas.86.6.1831, Bibcode 1989PNAS...86.1831W)
- (en) Mario Rizzetto, « Epidemiology of the Hepatitis D virus », WikiJournal of Medicine, vol. 7, , p. 7 (DOI 10.15347/wjm/2020.001, lire en ligne)
- (en) Rizzetto M, « Hepatitis D Virus: Introduction and Epidemiology », Cold Spring Harbor Perspectives in Medicine, vol. 5, no 7, , a021576 (PMID 26134842, PMCID 4484953, DOI 10.1101/cshperspect.a021576).
- (en) Taylor JM, « Hepatitis delta virus », Virology, vol. 344, no 1, , p. 71–76 (PMID 16364738, DOI 10.1016/j.virol.2005.09.033)
- (en) « U.S. National Library of Medicine "Delta Agent (hepatitis D)" »
- (en) Tayor JM, Desk Encyclopedia of Human and Medical Virology, Academic Press, (ISBN 978-0-12-375147-8, lire en ligne)
Référence biologique
- (en) Référence ICTV : Hepatitis delta virus (consulté le )