Entomologie médicale
L'entomologie médicale ou vétérinaire est la science qui étudie tous les insectes et d'autres arthropodes qui ont une importance pour la santé humaine ou animale. Soit directement (ex. : myases), soit indirectement en étant le vecteur d'agents pathogènes viraux (dengue, zika, fièvre jaune), parasitaires (paludisme et moustiques anophèles, trypanosomiase africaine et Mouche tsétsé, maladie de Chagas et Triatominae, onchocercoses et Simulies…) ou bactériens. Historiquement, ces problèmes sont connus depuis l'Antiquité, mais ce n'est qu'en 1877 que le professeur Patrick Manson, un médecin britannique, a démontré qu'un pathogène était transmis par les moustiques.

L'entomologie médicale aborde plusieurs domaines de recherche : taxonomie, biologie, physiologie, écologie, comportement et dynamique des populations d'insectes vecteurs, les interactions entre les parasites et leurs vecteurs, cartographie des risques, gestion du risque en cherchant à développer des stratégies de contrôle et de lutte contre les populations de vecteurs, ainsi que l'étude des mécanismes de résistance des vecteurs aux insecticides.
Actions directes des arthropodes sur la santé humaine
Arthropodes pathogènes
Des arthropodes peuvent parasiter l'homme ou les vertébrés : larves de diptères (myase), acariens (gale), puce-chique, etc.
D'autres sont pathogènes par leur venin (piqûre ou morsure) : hyménoptères, scorpions, araignées, de tiques, etc.
D'autres sont pathogènes par leur contact urticant, vésicant ou allergisant : certains papillons (Hylesia urticans, etc.), chenilles (chenille processionnaire…), coléoptères…
Vecteur d'agents pathogènes
Un vecteur est un arthropode hématophage qui assure la transmission d'un pathogène d'un hôte vertébré à un autre. La transmission est dite biologique lorsque le pathogène se développe dans le corps du vecteur, ou mécanique si le vecteur est juste une seringue volante qui ne fait que transporter le pathogène d'un hôte à l'autre. Les arthropodes importants pour l'entomologie médicale et vétérinaire font partie de la classe Arachnida, et de la classe Insecta avec différents ordres comme Hemiptera, Diptera, Siphonaptera ou Phthiraptera.
La maladie est la réaction de l'hôte au pathogène et non de l'hôte au vecteur. Donc les arthropodes ne sont pas pathogènes mais c'est l'agent infectieux qui l'est. Pour classer le pouvoir d'un vecteur à transmettre un agent pathogène , l'entomologie a développé deux importants concepts que sont la compétence vectorielle et la capacité vectorielle
La compétence vectorielle est la susceptibilité d'un arthropode à l'infection par un pathogène et sa capacité à le transmettre. Cette compétence peut être étudiée en laboratoire. La capacité vectorielle représente tous les facteurs écologiques de base d'un vecteur en liaison avec sa capacité à transmettre un pathogène. Cela signifie qu'il s'agit de la compétence, ainsi que de tous les facteurs environnementaux. Cela ne peut être étudié que sur le terrain.
Recherche de nourriture chez les insectes hématophages
Les deux principaux groupes d'arthropodes pratiquant l'hématophagie sont les insectes et les tiques. On retrouve donc dans ce groupe les tiques, les triatomes, les puces, les moustiques et différentes mouches piqueuses : les mouches tsé-tsé, les phlébotomes, les moucherons piqueurs.
La recherche de nourriture se déroule en plusieurs étapes y compris l'hématophagie[1] :
- L'insecte veut se nourrir
- L'insecte vole et détecte la présence d'un hôte. Cette détection se fait par une analyse du taux d'oxyde carbone dégager par la cible hôte. L'intervention de substances olfactifs e
- Il se tourne ensuite en direction de l'hôte, pour se retrouver à proximité de ce dernier
- Il tente de localiser exactement la position de l'hôte, en vol.
- Il s'approche de l'hôte, puis identifie le meilleur endroit où se poser sur sa peau.
- Ensuite, l'insecte perce la peau, s'il est solénophage, ou la coupe, s'il est telmophage.
- Il trouve un vaisseau sanguin.
- Il essaie d'empêcher la coagulation du sang, ce qui interromprait le processus d'hématophagie.
- Il peut maintenant se nourrir.
- Peu après avoir terminé de se nourrir, l'insecte doit s'en aller, malgré l'excès de poids.
Si l'insecte est un ectoparasite permanent, le processus débute au stade 6 et se termine au stade 9.
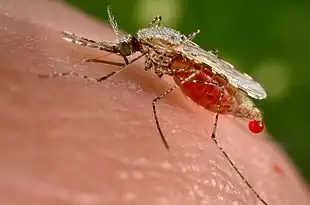
- l'insecte sonde la peau L'extrémité du rostre pénètre la peau sans l'abîmer, à la recherche d'un vaisseau L'insecte produit de la salive permettant une pénétration du rostre puis atteint le vaisseau sanguin[1].
- Des pompes pharyngiennes se mettent en marche : des récepteurs présents dans le pharynx analysent le sang, et l'insecte commence à pomper le sang. Le sang circule dans le canal alimentaire, alors que la salive circule, elle, dans le sens inverse, par un autre canal : le canal salivaire. Cette étape est terminée lorsque l'intestin de l'insecte est plein[1].
L'insecte quitte alors la cible.
Hématophagie
L'hématophagie désigne le repas de sang. Elle peut être peut être obligatoire : le repas de sang est la seule source énergétique (cas des sangsues qui appartiennent à la famille — non arthropode — des Hirudinidae), ou elle peut être facultative : le repas de sang peut être ou non un régime de base (cas des moustiques pour lesquels seules les femelles adultes sont hématophages)[1].
Les 3 mécanismes de l'hématophagie sont :
- la solénophagie désigne la cathétérisation des vaisseaux sanguins. La solénophagie favorise l'ingestion des pathogènes qui restent dans le sang. Les moustiques sont solénophages, en l'occurrence ;
- la telmophagie désigne la perforation ou la coupure de la peau. Ce mécanisme favorise l'ingestion de pathogènes qui restent dans le sang, dans la lymphe ou sur la peau, dans la zone cutanée (Phlébotomes, mouches noires ou tiques) ;
- le léchage (cas des chauves-souris vampires qui peuvent être vectrices de la rage)[1].
Facteurs impliqués dans la transmission entre le vecteur et l'homme
Le cycle infectieux au sein du vecteur débute lorsque celui-ci ingère un repas de sang infectieux, en piquant un humain ou un animal porteur d'un agent pathogène (virus, bactérie, parasite). Le pathogène commence par infecter le tube digestif, avant d'être disséminé dans le reste du corps, puis d'atteindre les glandes salivaires, d'où il peut être injecté à l'hôte suivant, lors d'un repas de sang du vecteur. Le temps qui s'écoule entre l'ingestion du repas de sang et la transmission à l'hôte suivant s'appelle la période d'incubation extrinsèque, ou PIE, qui dure de quelques jours à quelques semaines, en fonction du pathogène.
La compétence vectorielle des populations de moustiques varie pour une même souche de référence c'est-à-dire les mêmes moustiques vivant dans des endroits différents ne seront pas infectés de la même façon par le même agent pathogène[2].La capacité de transmission du virus varie donc également pour une même population de moustiques en fonction de l'agent pathogène[2]. La compétence vectorielle dépend de l'association d'un type de moustique et d'une souche virale[2].
Les arthropodes sont ectothermes : leur température corporelle dépend de la température ambiante[3]. La durée de la période d'incubation extrinsèque du virus de la dengue en jours en fonction de la température[3]. La durée de la PIE est inversement liée à la température Plus la température augmente, plus la PIE diminue[3]. Pour une température de 25 degrés, la dengue aura une PIE d'environ deux semaines[3]. Ce facteur comme la température est un facteur abiotique.
Le microbiote intestinal des moustiques et d'autres vecteurs. Les bactéries symbiotiques intracellulaires peuvent aussi influencer la compétence vectorielle. Et aussi la présence de virus spécifiques à chaque insecte jouent un rôle de protection contre l'invasion de pathogènes. Ces deux facteurs sont des facteurs biotiques. Il existe aussi des facteurs biotiques propre à l’hôte comme la quantité de pathogènes présents dans le sang de l'hôte, la dose infectante, ou d'autres facteurs sanguins, comme les facteurs immunologiques ou les nutriments.
Résistance aux insecticides chez les vecteurs
En l'absence de vaccin efficace, la plupart des activités de contrôle des vecteurs repose sur l'utilisation d'insecticides. Mais l'usage répété d'insecticides peut développer une résistance chez les vecteurs.La résistance peut saper le contrôle des vecteurs et endommager l'environnement car des doses plus importantes d'insecticide doivent être utilisées.Le premier mécanisme qui permet aux insectes de résister aux insecticides s'appelle la résistance comportementale.Cela consiste pour l'insecte à éviter tout contact avec l'insecticide. Le second mécanisme est appelé résistance cuticulaire Il s'agit de la modification du cuticule de l'insecte qui altère la pénétration de l'insecticide dans l'insecte. Mais les mécanismes les plus importants sont: la modification du tissu atteint par l'insecticide et consiste en la mutation d'un gène et le codage de la protéine ciblée par l'insecticide. La dernière, qui est aussi importante, est la résistance métabolique. Il s'agit de la dégradation de la molécule de l'insecticide par des enzymes spécifiques appelées enzymes de détoxification[4].
Moustique et virus
Les principaux virus transportés par les moustiques sont les virus de la dengue (flavivirus), de la fièvre jaune (flavivirus), de la fièvre du Nile (flavivirus), du Zika (flavivirus) , du chikungunya (alphavirus) et de la fièvre de la vallée du Rift (phlebovirus). Ce groupe de virus qui se transmet par insecte s’appellent les arbovirus.
Fièvre de la vallée du Rift
La première description clinique a eu lieu au lac Naivasha, au Kenya, en 1912-1913 il fut isolé 1930. Le virus est sorti de son site d'origine pour la première fois en 1951 et a atteint l'Afrique du Sud.En 1977, la première épidémie s'est produite en Afrique du Nord, en Egypte, après la construction du barrage sur la rivière Aswan et a causé la mort de 600 personnes.
L'agent causal est un virus appartenant à la famille Bunyaviridae, du genre Phlebovirus, un virus ARN avec 3 segments, L, M et S, respectivement long, moyen et court dont il existe trois lignées géographiques ont été décrites : Afrique de l'Ouest, Egypte et Afrique Centrale/Orientale.Les vertébrés atteints par ce virus sont très variés mais les ruminants domestiques et les hommes sont les plus importants. Les bovins, les chèvres et les moutons sont les principaux ruminants impliqués dans le cycle de transmission.
Chez l'homme, les symptômes sont généralement bénins dans plus de 80 % des cas. Mais dans 2 à 4 % deviennent graves avec des hémorragies, des complications oculaires et parfois une méningoencéphalite.
Cette maladie ne se transmet pas uniquement par piqûre de moustique mais par contact direct avec les tissus ou le sang des animaux infectés.
Plus de 30 espèces de moustique sont associées au virus dans la nature ou bien, des expériences ont démontré qu'ils étaient compétents, notamment les moustiques Aedes, Culex, Mansonia et Anopheles. Le cycle de transmission se compose de trois parties.
- Un cycle enzootique qui se produit dans des étangs éphémères appelés « dambos », en Afrique de l'Est et qui impliquent le moustique Aedes, Aedes mcintoshi dans le contexte est-africain et Aedes vexans dans le contexte ouest-africain. Ces moustiques émergent principalement après de fortes chutes de pluie.
- Le second cycle implique, au-delà des moustiques Aedes, d'autres genres, comme Culex et Mansonia. Ce cycle se produit lorsqu'un troupeau est réuni, mais aussi en cas d'augmentation du nombre de vertébrés susceptibles autour de l'étang.
- le dernier est le cycle épidémique et épizootique qui implique ce mode de transmission vectoriel mais aussi le contact direct avec les animaux.
Un vaccin humain existe mais il est inadéquat pour des campagnes massives. Il est coûteux et requiert plusieurs doses pour protéger. C'est pourquoi on le réserve au personnel à risque qui travaille dans les laboratoires et aux militaires en opération dans les zones endémiques.
La prévention est très difficile. Les succès les plus importants sont basés sur la modélisation. Cette maladie est très dépendant des conditions météorologiques. Une modélisation basée les chutes de pluie, la variation de la végétation et les variations de température à la surface de la mer ont permis de prédire une épidémie plusieurs mois à l'avance.
Chikungunya
Le chikungunya a été isolé pour la première fois en Tanzanie en 1953, et est endémique à l'Afrique et l'Asie. Il s'est propagé à l'échelle mondiale avec le moustique tigre Aedes albopictus. La seule mutation d'un acide aminé en position 226 de la glycoprotéine E1, a facilité la transmission du virus par ce moustique. Il devient très vite infectieux, deux jours après l'ingestion d'un repas infecté. L'infection de l'intestin est essentielle pour faciliter la dissémination et la transmission du virus par Aedes albopictus. l'Aedes albopictus européen est très compétent pour transmettre le chikungunya[5].
Dengue
Insectes et parasites
Autres insectes
Culicoides
Les culicoides sont de petits moucherons (maximum 3 mm) piqueurs et hématophages qui comprend 1 400 espèces différentes dans le monde et sont impliqués dans la transmission de plus de 50 arbovirus dans le monde[6], y compris le virus de la fièvre catarrhale (BTV; Orbivirus, Reoviridae), le virus de Schmallenberg (SBV; Orthobunyavirus, Peribunyaviridae) et le virus de la peste équine (AHS; Orbivirus, Reoviridae).
Pathogène direct
À l'échelle mondiale, l'impact le plus commun des moucherons mordants de Culicoides sur la santé publique se produit par le biais de morsures nuisibles infligées par des femelles adultes, conduisant dans les cas graves à des papules prurigineuses pouvant aboutir à des cicatrices permanentes[7] - [8] - [9].
Nématodes
Les nématodes filariens transmis sont notamment Mansonella ozzardi, M. perstans et M. streptocerca[8] qui sont très répandus en Amérique latine et dans les Caraïbes et en Afrique occidentale et centrale. Étant donné que la manifestation clinique de la mansonellose est généralement bénigne ou entièrement asymptomatique, les études de la transmission par Culicoides sont relativement rares.
Humain
Actuellement, le seul arbovirus connu pour être principalement transmis par les culicoïdes à et entre les humains est le virus d'Oropouche (OROV; Orthobunyavirus, Peribunyaviridae) responsable de la fièvre d'Oropouche [10]. Les symptômes fréquemment observés de la fièvre d'Oropouche comprennent des maux de tête dans une proportion élevée de cas, mais peuvent également entraîner une arthralgie généralisée, une anorexie et, dans de rares cas, une méningite, dont l'incidence reste indéterminée dans la grande majorité des épidémies[11]. OROV est largement distribué dans une aire géographique qui comprendrait le Brésil, le Pérou, le Panama, la Colombie et la Trinité[12], mais n'a pas été enregistré à ce jour à proximité du Costa Rica, du Venezuela ou d'autres îles des Caraïbes[13]. Les principales épidémies de maladies OROV se sont largement concentrées sur le Brésil , où des milliers de cas cliniques peuvent survenir et une incidence annuelle qui serait supérieure la dengue bien que le manque de spécificité des symptômes cliniques, combiné avec une inu prévalence élevée de maladies fébriles, rende difficile de l’affirmer.. La distribution et l'incidence des OROV endémiques sont également en cours d'examen à la lumière de la récente découverte au Pérou du virus Iquitos, qui présente des manifestations cliniques similaires, mais dont le mode de transmission n'a pas encore été étudié en détail[14].
Tiques
Les tiques sont des arthropodes appartenant à la sous-classe des Acari dont il existe 869 espèces divisées en trois familles principales : Argasina, ou tique molle, puis Ixodina, ou tique dure, et enfin une famille intermédiaire appelée Nuttalliellina qui ne comporte qu'une espèce et qui n'a aucun impact sur la santé humaine ou vétérinaire. Les tiques sont capables d'infecter tous les hôtes vertébrés terrestres y compris les reptiles, les amphibiens, les oiseaux et, bien entendu, les mammifères dont les humains. Elles sont également le premier vecteur de l'hémisphère nord et, au niveau mondial, le premier vecteur impactant la santé animale et le second après les moustiques pour la santé humaine. Ixodes ricinus est la tique la plus courante et la plus abondante en Europe occidentale. la particularité des tiques est que l’hématophagie dure plusieurs jours
Pathogène direct
Elles peuvent être la cause d'une inflammation locale et d'une infection secondaire ainsi que d'une anémie à la suite de leur morsure. Elles sont également responsables de réactions allergiques.
Bactéries
Les bactéries les plus connues transmisses par les tiques sont la bartonella et une bactérie de la famille des spirochètes.
Virus
Arthropodes

Dans une approche One health ce domaine de l'entomologie médicale cible les arthropodes dits d'importance médicale et vétérinaire, généralement hématophages et vecteurs de maladies zoonotiques. Les chercheurs tentent notamment de mieux comprendre les facteurs environnementaux et/ou génétiques ou épigénétiques qui orient le vecteur vers son hôte et les mécanismes de coévoluation et d'adaptation qui rendent la lutte antivectorielle parfois inefficace (en raison notamment de l'apparition de phénomènes de résistance aux pesticides.
Du point de vue médical et vétérinaire, les arthropodes peuvent être pathogènes par eux-mêmes, ou en étant les hôtes ou vecteurs d'agents pathogènes[15].
Arthropodes hôtes ou vecteurs
Les transporteurs ou contaminateurs sont des véhicules passifs de contamination, le plus souvent à courte distance : mouches, blattes, etc.
Les hôtes intermédiaires, où l'arthropode est une étape obligatoire du parasite, mais en jouant un rôle passif (par exemple ingestion accidentelle par un animal broutant ou l'homme en pique-nique, comme une fourmi infestée par la petite douve du foie).
Les vecteurs jouent le rôle le plus important en entomologie médicale ou vétérinaire. Ils assurent la transmission biologique active et obligatoire de nombreux agents pathogènes. Ce sont les moustiques, les poux de corps, les puces, etc.
Perspectives
Outre la pharmacopée qui évolue, de nouveaux outils et approches écoépidémiologiques apparaissent, qui se basent de plus en plus sur la modélisation mathématique des épidémies, l'écologie des espèces, les relations parasite/vecteurs-hôtes, la biologie moléculaire, l'influence de l'environnement et du climat, une meilleure compréhension de la génétique et de l'évolution des maladies en cause, de l'immunité de l'hôte et du vecteur, etc.
Notes et références
- (en) Claudio R. Lazzari, « Chapter 1 Orientation Towards Hosts in Haematophagous Insects », dans Advances in Insect Physiology, vol. 37, Elsevier, (ISBN 978-0-12-374829-4, DOI 10.1016/s0065-2806(09)37001-0, lire en ligne), p. 1–58
- Lambrechts, Louis & Fellous, Simon & Koella, Jacob. (2006). Lambrechts L, Fellous S, Koella JC. Coevolutionary interactions between host and parasite genotypes. Trends Parasitol 22: 12-16. Trends in parasitology. 22. 12-6. 10.1016/j.pt.2005.11.008.
- (en) Nils Benjamin Tjaden, Stephanie Margarete Thomas, Dominik Fischer et Carl Beierkuhnlein, « Extrinsic Incubation Period of Dengue: Knowledge, Backlog, and Applications of Temperature Dependence », PLOS Neglected Tropical Diseases, vol. 7, no 6, , e2207 (ISSN 1935-2735, PMID 23826399, PMCID PMC3694834, DOI 10.1371/journal.pntd.0002207, lire en ligne, consulté le )
- Brogdon, W. G., & McAllister, J. C. (1998). Insecticide Resistance and Vector Control. Emerging Infectious Diseases, 4(4), 605-613. https://dx.doi.org/10.3201/eid0404.980410.
- (en-GB) Camilo Arias Goeta et Anna-Bella Failloux, « Evolution et adaptation du virus chikungunya vis-à-vis de ses hôtes vecteurs », Université Pierre-et-Marie-Curie (thèse), (lire en ligne, consulté le )
- P. S. Mellor, J. Boorman et M. Baylis, « Culicoides Biting Midges: Their Role as Arbovirus Vectors », Annual Review of Entomology, vol. 45, no 1, , p. 307–340 (ISSN 0066-4170, DOI 10.1146/annurev.ento.45.1.307, lire en ligne, consulté le )
- M.L. Felippe-Bauer, U.S. SternheimCulicoides paraensis (Diptera: Ceratopogonidae) infestations in cities of the Itapocu river valley, southern Brazil Entomol. News, 119 (2008), pp. 185-192
- (en) J.R. Linley, A.L. Hoch et F.P. Pinheiro, « Biting midges (Diptera: Ceratopogonidae) and human health », J. Med. Entomol., no 20, , p.347-364.
- Dermatozoonosis by Culicoides bite (Diptera, Ceratopogonidae) in Salvador, State of Bahia, Brasil. VI A clinical study Mem. Inst. Oswaldo Cruz, 63 (1965), pp. 27-37
- (en) Simon Carpenter, Martin H. Groschup, Claire Garros et Maria Luiza Felippe-Bauer, « Culicoides biting midges, arboviruses and public health in Europe », Antiviral Research, vol. 100, no 1, , p. 102–113 (ISSN 0166-3542, DOI 10.1016/j.antiviral.2013.07.020, lire en ligne, consulté le )
- Oropouche fever, T.P. Monath (Ed.), The Arboviruses: Epidemiology and Ecology, CRC Press, Florida (1989)
- N. KarabatosInternational Catalogue of Arboviruses, N. Karabatos (Ed.), 3rd ed., American Society of Tropical Medicine and Hygiene, San Antonio, Texas (1985)
- H.B. Vasconcelos, M.R.T. Nunes, L.M.N. Casseb, V.L. Carvalho, E.V.P. da Silva, M. Silva, S.M.M. Casseb, P.F.C. VasconcelosMolecular epidemiology of oropouche virus, Brazil, Emerg. Infect. Dis., 17 (2011), pp. 800-806
- P.V. Aguilar, A.D. Barrett, M.F. Saeed, D.M. Watts, K. Russell, C. Guevara, J.S. Ampuero, L. Suarez, M. Cespedes, J.M. Montgomery, E.S. Halsey, T.J. KochelIquitos virus: a novel reassortant orthobunyavirus associated with human illness in Peru Plos Negl. Trop. Dis., 5 (2011)
- F. Rodhain, Précis d'entomologie médicale et vétérinaire, Paris, Maloine, , 458 p. (ISBN 2-224-01041-9), p. 31-32.
Bibliographie
- Ba, Y., Diallo, D., Dia, I., & Diallo, M. (2006). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 99(4), 283-289.
- Coetzee, M., Van Wyk, P., Booman, M., Koekemoer, L., & Hunt, R. (2006). Entomologie médicale. Bull Soc Pathol Exot, 99(5), 400-403.
- Darriet, F., N’Guessan, R., Hougard, J. M., Traoré-Lamizana, M., & Carnevale, P. (2002). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 95(4), 299-303.
- Duvallet Gérard, Didier Fontenille, Vincent Robert (2017) ; Entomologie médicale et vétérinaire ; Éditions Quae
- Faraj, C., Adlaoui, E., Ouahabi, S., Lakraa, E., Elkohli, M., & El Aouad, R. (2008). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 101(1), 62-64.
- Neveu-Lemaire, M. (1938). Traité d'entomologie medicale et vétérinaire. Roy. 8vo (résumé)
- Rassi, Y., Abai, M. R., Javadian, E., Rafizadeh, S., Imamian, H., Mohebali, M., ... & Ismaili, K. (2008). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 101(5), 425-428.
- Ravoahangimalala, R. O., Randrianambinintsoa, F. J., Tchuinkam, T., & Robert, V. (2008). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 101(4), 348-352.
- Tia, E., Akogbeto, M., Koffi, A., Toure, M., Adja, A. M., Moussa, K., ... & Chandre, F. (2006). ENTOMOLOGIE MÉDICALE. Bull Soc Pathol Exot, 99(4), 278-282.
Voir aussi
Articles connexes
Liens externes
- MiVEGEC : Maladies Infectieuses et Vecteurs, Écologie, Génétique, Évolution et Contrôle
- (fr+en) MOOC : Entomologie médicale (6 semaines/séquences de formation); vidéos en anglais sous-titrées français et anglais ; connaissances en biologie requises