Virus de la stomatite vésiculaire
Le virus de la stomatite vésiculaire (VSV) est un virus enveloppé à ARN monocaténaire de polarité négative (ordre des Mononegavirales) à génome non segmenté[2], soit du groupe V selon la classification Baltimore, qui répond de façon très sensible à un traitement à l'interféron[3]. Il fait partie de l'ordre des Mononegavirales (les virus à polarité négative non-segmentés) et de la famille des Rhabdoviridae. Ce virus fait partie de la même famille que le virus de la rage beaucoup mieux connu.
_EM_18_lores.jpg.webp)
Le génome du virus a une forme de balles de fusil (bullet) soit cyclindrique avec une des extrémités moins arrondies (voir figure). Après infection virale de cellules in vitro, les produits viraux vont arrêter l'expression génétique de la cellule et prendre le contrôle complet du métabolisme interne de la cellule. L'infection par VSV va causer une destruction rapide des tissus car les produits viraux dépolymérisent le cytosquelette. L'infection virale provoque une réponse immunitaire qui inclut la production d'interféron et d'oxyde nitrique ce qui permet de contrôler rapidement la réplication virale. Enfin, par la production d'anticorps, la réponse adaptative immunitaire va prévenir de futures réinfections virales[2].
Structure protéique du virus
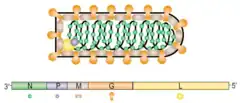
Le virus de la stomatite vésiculaire est le membre prototype du genre Vesiculovirus de la famille Rhabdoviridae. Le génome de ce virus est une simple molécule à polarité négative encodant cinq protéines majeures : la glycoprotéine (G), la protéine matrice (M), la nucléoprotéine ou nucléocapside (N), la protéine large (L) et la phosphoprotéine (P).
La glycoprotéine (G) sert à se lier à la surface de la cellule hôte ainsi qu’à fusionner les membranes cellulaires et virales[4] après l'endocytose de façon à permettre le relâchement du génome viral et la réplication dans le cytoplasme. La protéine G se lie à la phosphatidylsérine qui est une composante quasi universelle de la membrane cellulaire chez les animaux (d'où son utilisation possible en thérapeutique, voir section Recherches thérapeutiques).
La protéine matrice (M) composée de 229 acides aminés, joue un rôle crucial dans l’assemblage du virus, son bourgeonnement, l’apoptose et la perturbation de la réponse immunitaire de la cellule-hôte. La protéine M de VSV joue un rôle dans les premières phases de l’infection virale en l’aidant à éviter les programmes antiviraux cellulaires par deux moyens : interruption du programme de transcription cellulaire et en bloquant le transport des ARNm exporté du noyau. Dans ces deux mécanismes, le rôle de la protéine M est de bloquer l’expression de produits de transcription tels l’interféron. Cette inhibition implique une interaction entre protéine M et Nup98, un gène qui répond à l’interféron[4].
La nucléocapside ou nucléoprotéine (N) est une protéine qui entoure l’ARN.
Pouvoir pathogène
Le virus de la stomatite vésiculaire est un arbovirus transmis au bétail (bovins, porc, cheval) par des moucherons piqueurs : simulie, phlébotome. Une transmission mécanique par stomoxe est discutée[5].
Ce virus provoque chez l'animal infecté des lésions (vésicules) des muqueuses en particulier dans la bouche (stomatite). La maladie vétérinaire est généralement non mortelle, mais elle provoque des épizooties importantes aux Amériques, avec de grandes pertes économiques[5] - [6].
L'Homme peut être contaminé de façon occasionnelle (piqûre accidentelle d'un moucheron infecté), le plus souvent sous une forme bénigne (syndrome pseudo-grippal), mais des cas plus sévères (encéphalite) ont été signalés en Amérique du Sud[5].
Recherches thérapeutiques
Le fait que le VSV soit non ou peu pathogène chez l'homme, l'a fait choisir comme génétiquement modifiable. Pour cette raison, sa glycoprotéine G est souvent utilisée pour « pseudotyper » des vecteurs lentiviraux, oncovirus ou rétroviraux, utilisés en thérapie génique. Ainsi, en changeant la glycoprotéine d'enveloppe, ces vecteurs viraux sont capables de pénétrer dans un plus grand nombre de types cellulaires.
Ces VSV modifiés pourraient diriger spécifiquement leur activité lytique contre des cellules cancéreuses, ouvrant la voie à une virothérapie du cancer[7] ; ou servir de vecteurs recombinés à des candidats-vaccins, par exemple contre Ebola[8] ou la Covid-19[9] - [10] - [11].
Notes
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- Letchworth, Rodriguez et al., 1999. Vesicular stomatitis.
- Belkowski and Sen, 1987. Inhibition of vesicular stomatitis viral mRNA synthesis by interferons.
- Lichty, Power et al., 2004. Vesicular stomatitis virus: re-inventing the bullet
- Gérard Duvallet, Entomologie médicale et vétérinaire, Marseille, Versailles, IRD - QUAE, (ISBN 978-2-7099-2376-7), p. 313, 335 et 399.
- Paula Rozo-Lopez, Barbara S. Drolet et Berlin Londoño-Renteria, « Vesicular Stomatitis Virus Transmission: A Comparison of Incriminated Vectors », Insects, vol. 9, no 4, (ISSN 2075-4450, PMID 30544935, PMCID 6315612, DOI 10.3390/insects9040190, lire en ligne, consulté le )
- Suman Bishnoi, Ritudhwaj Tiwari, Sharad Gupta et Siddappa N. Byrareddy, « Oncotargeting by Vesicular Stomatitis Virus (VSV): Advances in Cancer Therapy », Viruses, vol. 10, no 2, (ISSN 1999-4915, PMID 29473868, PMCID 5850397, DOI 10.3390/v10020090, lire en ligne, consulté le )
- Anahita Fathi, Christine Dahlke et Marylyn M. Addo, « Recombinant vesicular stomatitis virus vector vaccines for WHO blueprint priority pathogens », Human Vaccines & Immunotherapeutics, vol. 15, no 10, , p. 2269–2285 (ISSN 2164-5515, PMID 31368826, PMCID 6816421, DOI 10.1080/21645515.2019.1649532, lire en ligne, consulté le )
- « Institut de recherche biologique de la défense israélienne (IIBR) », sur fr.timesofisrael.com (consulté le )
- (en) « Le vaccin israélien Brilife est meilleur que le Pfizer », sur World Israel News
- (en) Yfat Yahalom-Ronen, « A single dose of recombinant VSV-∆G-spike vaccine provides protection against SARS-CoV-2 challenge », Nature Communications, (lire en ligne)