Rage (maladie)
La rage est une encéphalite virale grave ne touchant que les mammifères. Après apparition des symptômes, elle est mortelle dans la quasi-totalité des cas. Cette infection est hautement contagieuse par morsure et transmissible de l'animal à l'être humain. Selon l'OMS, la maladie cause environ 59 000 décès humains chaque année dans le monde, pour la plupart dans les zones rurales d'Afrique et d'Asie ; 40 % des victimes ont moins de 15 ans.

| Causes | Virus de la rage |
|---|---|
| Transmission | Transmission par contact (d) et morsure |
| Incubation min | 7 j |
| Incubation max | 1 années |
| Symptômes | Paralysie, hydrophobie rabique (d), hallucination, insomnie, douleur, frissonnement (en), vomissement, irritabilité, hyperactivité (en), céphalée, paresthésie, peur, arrêt cardio-circulatoire, arrêt respiratoire (en), irritabilité, hypersialorrhée, photophobie, phonophobie, augmentation (d), augmentation (d), mydriase et fièvre |
| Traitement | Traitement post-exposition de l'infection (en) et Protocole de Milwaukee |
|---|---|
| Spécialité | Infectiologie et médecine vétérinaire |
| CIM-10 | A82 |
|---|---|
| DiseasesDB | 11148 |
| MedlinePlus | 001334 |
| eMedicine |
220967 eerg/493ped/1974 |
| MeSH | D011818 |
| Patient UK | Rabies-pro |
![]() Mise en garde médicale
Mise en garde médicale
Causés par un virus neurotrope, les symptômes sont principalement neurologiques accompagnés de désordres comportementaux. Classiquement, le sujet atteint peut présenter une agressivité impressionnante qui donne son nom à la maladie, bien qu'il existe aussi des formes plus frustes où le comportement est particulièrement calme.
La rage est une zoonose assez commune qui touche beaucoup les carnivores de certaines régions du monde, et il est impératif de faire vacciner son animal de compagnie pour des destinations où le risque, même faible, est avéré, ainsi qu'en cas de risque d'épizootie dans les régions où la maladie humaine n'est plus endémique.
De même, des autorités comme l'Office national des forêts en France usent de moyens de vaccination de la faune sauvage lors d'épisode épidémique, d'abattage des animaux suspects et éliminent les cadavres suspects. En Europe, la rage du renard a été efficacement éliminée de certains pays par distribution d'appâts imprégnés de vaccin dispersés dans la nature.
Agent causal
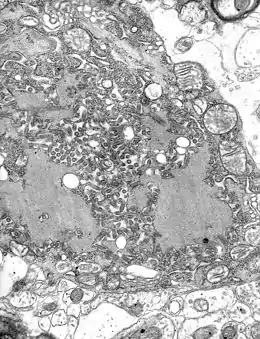
Structure et caractéristiques
La rage est causée par un virus de la famille des Rhabdoviridae et du genre Lyssavirus. Ce sont des virus enveloppés, leur génome est une molécule d'ARN monocaténaire (à un seul brin), de polarité négative, non segmenté, et de forme hélicoïdale, dans une enveloppe ayant la forme d'un obus ou d'une balle de révolver.
Ces caractéristiques leur confèrent une grande sensibilité aux agents physico-chimiques de désinfection et donc une faible résistance dans le milieu extérieur[alpha 1]. De même, ils ne disposent pas de moyen de contrôler les erreurs de réplication, ils sont donc capables d'évoluer très rapidement par mutation, d'échapper aux mécanismes de défense[1], et de franchir plus facilement les barrières d'espèces.
Le virus de la rage est un virus neurotrope, en particulier du système nerveux central. Il se multiplie dans le cytoplasme des cellules nerveuses où il forme des inclusions visibles en microscopie optique : les corps de Negri. Ce neurotropisme explique pour partie les troubles observés, comme l'hydrophobie, appellation historique de la rage[2], et présente dans 95 % des cas humains[3].
Le virus de la rage infecte tous les animaux à « sang chaud »[4] comme les mammifères, mais la température centrale de ceux-ci varie selon les espèces. Celle des mammifères placentaires est autour de 37–38 °C, supérieure à celle des marsupiaux (36 °C) et des monotrèmes (30 °C)[5], aussi la sensibilité à la rage varie selon les espèces. Par exemple, l'opossum est relativement résistant à la rage[6], alors que les mammifères placentaires sont plus sensibles, surtout les carnivores.
Origine et réservoirs
Le réservoir primitif du virus de la rage paraît être celui de certaines chauves-souris qui peuvent être porteuses saines ou malades selon les espèces. D'après une étude phylogénétique, le virus rabique aurait évolué à partir de rhabdovirus d'insecte, il y a environ dix mille ans. Le virus rabique actuel serait passé des chauves-souris aux carnivores, il y a près de 900 à 1 500 ans, ce qui n'exclut pas que d'autres passages aient eu lieu auparavant[1] - [7] - [8].
Les réservoirs-vecteurs de la rage humaine sont essentiellement les carnivores sauvages (rage sylvatique) et domestiques (rage urbaine ou rage des rues).
Pathogénie
Le temps d'incubation est variable selon les espèces. Chez les chiens et les chats, il est en moyenne de 38 jours[9].
Après morsure, le virus se multiplie localement dans le tissu musculaire, d'où l'importance de soins locaux immédiats. Pendant cette phase initiale, le virus ne peut pas être facilement détecté par le système immunitaire de l'hôte, et la vaccination peut toujours conférer une immunité.
Le virus a un tropisme prononcé pour le système nerveux, en particulier les neurones mais aussi d'autres cellules comme les astrocytes[10]. Après atteinte d'une densité locale suffisante dans le tissu musculaire, le virus diffuse jusqu'à une terminaison nerveuse (par exemple : motoneurone de plaque motrice), le virus va migrer à une vitesse de 8 à 20 mm par jour[11] du système nerveux périphérique vers le système nerveux central via les synapses.
Il infecte notamment la cellule pré-synaptique par bourgeonnement de la membrane cellulaire, en particulier par la glycoprotéine RABV-G de surface qui facilite l'entrée dans la nouvelle cellule hôte[12] - [13].
Le virion se lie en particulier au récepteurs p75NTR et est ainsi internalisé dans un endosome puis transporté le long de l'axone jusqu'au corps cellulaire, lieu de sa réplication[14]. Ce transport en apparence anodin engendre cependant un stress oxydatif supplémentaire dans la cellule et la détérioration de l'axone[15].
Une fois que le virus atteint le cerveau, une deuxième multiplication massive a lieu dans les neurones. Ce qui provoque rapidement une encéphalite avec apparition des symptômes. Les troubles comportementaux (en particulier l'agressivité) seraient en rapport avec une atteinte des circuits sérotoninergiques[16]. Il peut aussi infecter la moelle spinale, provoquant une myélite.
Toujours par voie nerveuse, le virus se dissémine ensuite dans tout l'organisme, pour être excrété vers les glandes salivaires, les yeux (rétine, glandes lacrymales…), la peau et les follicules pileux, les muqueuses nasales et digestives[17].
La mort survient par destruction des zones cérébrales contrôlant l'automatisme de la respiration[6].
Transmissions
La rage est avant tout une zoonose des vertébrés à sang chaud (mammifères), et plus rarement, des oiseaux[18], accidentellement transmise à l'homme, et dont le réservoir évolue selon les époques et d'un continent à l'autre[19].
La rage se transmet le plus souvent par morsure directe avec blessure (et non par une morsure qui ne transperce pas les vêtements). Elle peut être aussi transmise par griffure, ou léchage sur une peau lésée (le virus ne pénètre pas une peau saine et intacte) ; plus rarement par projection de salive contaminée sur une muqueuse (conjonctive par exemple)[17]. L'inhalation d'aérosols de gouttelettes ou de poussières infectées est exceptionnelle, mais possible dans des circonstances particulières, comme dans les grottes habitées par des chauves-souris infectées[17].
Rage animale
Les virus rabiques évoluent dans trois grands cycles naturels : la rage des mammifères terrestres (qui se subdivisent en sauvages et domestiques), et la rage des mammifères volants (chauves souris)[20]. Les espèces-réservoirs de virus rabique le transmettent le plus souvent par morsure, ce sont donc à la fois des réservoirs et des vecteurs de la rage.
Mammifères terrestres
Le virus de la rage circule d'abord chez les carnivores sauvages qui jouent le rôle de réservoir primaire, c'est la rage sylvatique ou rage des animaux sauvages[20]. Le principal réservoir mondial est celui des canidés sauvages (loup, renard, chacal, coyote.). Les autres carnivores sauvages de plus petite taille, comme les mustélidés, peuvent être aussi des réservoirs significatifs : mouffette, raton laveur, blaireau[19].
La rage animale sauvage survient à intervalles irréguliers, par vagues s'étendant sur des milliers de kilomètres en quelques décennies, à raison de quelques kilomètres à quelques dizaines de kilomètres par an[21].
Ces carnivores sauvages peuvent transmettre la rage, selon l'occasion, aux carnivores domestiques[21], principalement le chien, puis le chat[19]. La rage est alors dite rage urbaine ou rage des rues. D'autres mammifères, en élevage domestique ou servant de gibier, ainsi que les rongeurs, peuvent être atteints et mourir de la rage[21]. Les analyses moléculaires des différents virus suggèrent que la transmission entre espèces sauvages et domestiques peut se faire dans les deux sens[1].
Chiroptères
Les chauves-souris (chiroptères) d'Amérique et d'Europe peuvent être infectées. Le cycle de la rage des chiroptères est indépendant du cycle des carnivores, mais à l'exception des chauves-souris hématophages d'Amérique, leur rôle épidémiologique (rage humaine, ou animale domestique) parait limité[21], mais reste très surveillé[20].
Les premières recherches modernes concernant la rage des chauves-souris transmissible au bétail ont lieu au Brésil au début du XXe siècle. En 1931, le virus rabique est isolé de chauves-souris hématophages comme les chauves-souris vampires des genres Artibeus, Desmodus et Hemiderma[22].
Dans les années 1950, le virus rabique a été retrouvé chez des chauves-souris insectivores du sud des États-Unis[22] - [23]. En Guyane, des anticorps antirabiques ont été détectés sur des animaux ne présentant pas de symptômes et chez qui le virus ne pouvait pas être mis en évidence.
En Amérique latine, la rage des bovidés par chauve-souris hématophage tue 30 à 40 % des animaux non vaccinés. Les pertes annuelles au cours des années 1960-1970 seraient de l'ordre d'un demi-million de têtes[22]. Elles demeurent une charge économique significative en 2018[24].
La rage de chauve-souris autochtone est documentée en Europe depuis 1954 en Allemagne, puis dans les autres pays européens (France en 1989). L'espèce majoritairement en cause est une chauve-souris insectivore, la sérotine commune. Une chauve-souris enragée se caractérise par une activité diurne, un vol impossible, une paralysie ou une agressivité. Il est déconseillé de manipuler une chauve-souris à terre, trouvée en plein jour[25] - [26].
En Europe, les cas de chauve-souris enragées sont très rares : 10 à 50 cas par an de 1988 à 2000, en France 10 cas sur toute la période 1989 à 2000[25] - [26].
Rage humaine

L'homme est un hôte accidentel et terminal (en impasse), la transmission interhumaine étant quasi inexistante. Les cas humains surviennent rarement et de façon sporadique, soit en cas isolé, soit en petits groupes de quelques cas.
La quasi-totalité des cas humains (près de 98 %) proviennent de morsures de chien enragé[27], plus rarement directement d'animaux sauvages (chasseurs, trappeurs et bergers exposés).
La morsure d'un chat enragé est grave, car le plus souvent multiple et très pénétrante. L'attaque de loup enragé est la plus dangereuse, à cause de la taille, de la force, et de la capacité de l'animal à infliger des morsures multiples[21].
La transmission par herbivores domestiques est très rare, mais reste potentiellement dangereuse. En Afrique du Sud un cas de morsure par un cheval enragé a été signalé[28].
La transmission par chauve-souris est exceptionnelle en Europe : 4 cas humains en Europe de 1977 à 2012[27], et aucun en France métropolitaine (à la date de 2018)[29]. Un cas est survenu en Guyane française en 2008. Un homme âgé d'une soixantaine d'années est décédé de la rage à la suite d'un contact avec des chauves-souris qui nichaient dans son grenier, à Limoges, en . C'est le premier décès de ce genre détecté en France[30].
À la date de 2018, aucun cas de rage humaine par morsure de rongeur n'a été rapporté dans le monde ; ni par ingestion de viande crue d'un animal enragé, ou de lait cru de vache enragée[31].
La transmission interhumaine est théoriquement possible, mais en pratique elle est rarissime, elle a été décrite notamment lors de greffes de cornée[32].
Épidémiologie
Pour l'épidémiologie historique, voir
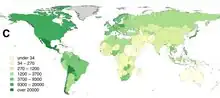
Selon l'OMS, la maladie cause environ 59 000 décès chaque année dans le monde, pour la plupart dans les zones rurales de l'Afrique et de l'Asie. 40 % des victimes sont des enfants de moins de 15 ans[33]. Le chiffre des décès est probablement sous-estimé, les pays les plus touchés étant ceux qui disposent du moins de moyens de diagnostic[34]. Le coût global de la maladie reviendrait à plus de cinq milliards d'euros par an[35] ou même à plus de huit milliards[36].
La rage n'est pas une maladie éradicable mondialement, le virus pouvant circuler dans la faune sauvage, mais elle peut être éliminée localement. L'objectif de l'OMS est de parvenir à des éliminations régionales de rage terrestre (la rage des chiroptères n'entre pas dans ces définitions), avec zéro décès de rage humaine dans le monde[37], d'ici 2030 (élimination mondiale de la rage humaine transmise par les chiens)[38].
Selon l'OMS, un pays est dit indemne ou libre de rage, lorsque aucun cas de rage humaine ou animale, transmise par le chien, n'a été confirmé depuis au moins deux ans[39]. L'OMS publie régulièrement une carte réactualisée des pays à risques selon 4 catégories : absence de risque, à risque faible, modéré, et élevé[40].
Le processus d'élimination se fait en 4 phases : « endémique » pays avec cas humains confirmés notifiés chaque mois, « contrôle » forte diminution des cas humains après mesures collectives, « zéro décès humain » indique l'interruption de la transmission à l'homme de rage canine, « élimination » indique l'arrêt de toute transmission de rage avec absence de cas de rage canine et humaine[37].
La situation d'un pays où la rage est éliminée (éradiquée localement) reste toujours fragile. C'est une phase de « maintenance » qui se réfère à la surveillance et à la prévention d'une nouvelle introduction de rage avec cas de rage canine ou humaine[37].
France
Selon les critères de l'OMS et de l'OIE, la France remplit les conditions de pays indemne de rage depuis 2010, mais compte tenu des risques de réintroduction, la situation française fait l'objet d'une surveillance permanente[27] - [41].
Rage des carnivores
En France, la rage du renard a été éradiquée (arrêté du du ministre de l'agriculture[42]). L'éradication a été menée, entre autres, grâce à la vaccination préventive des animaux de compagnie et des personnes potentiellement exposées au virus de la rage (chiroptérologues, vétérinaires, etc.) et par un plan de surveillance de cette maladie au niveau national.
Dans le domaine vétérinaire, écosystémique, éco-épidémiologique et cynégétique, cette zoonose est suivie par l'ONCFS avec le réseau SAGIR et l'appui de laboratoires spécialisés, dont le LERPAS (Laboratoire d'études sur la rage et la pathologie des animaux sauvages).
De 1968 à 2018, 42 chiens et 3 chats ont été diagnostiqués atteints de rage, tous ont été importés. L'apparition de ces cas a donné lieu à des prises en charge des personnes exposées, allant de 2 à 187 personnes (selon le déplacement de l'animal).
Des cas en provenance du Maroc, survenus en 2008[43], ont donné lieu à une procédure judiciaire à propos de l'euthanasie de chiens suspects en contact avec les animaux enragés. Les propriétaires ont obtenu gain de cause en portant plainte du fait que la rage de leurs chiens n'a pas été vraiment diagnostiquée[44] - [45].
À la date de septembre 2020[46], le dernier cas de rage de chat est survenu fin octobre 2013 dans le Val-d'Oise[47]. Le dernier cas de rage du chien date de (chiot revenant d'Algérie)[20].
La France était indemne de rage (mammifères terrestres) depuis le début de l'année 2001, elle a perdu ce statut en 2008 pour le retrouver en 2010[27].
Il existe un risque résiduel provenant des animaux importés illégalement, en particulier les chiens des pays de l'Europe de l'Est et d'Afrique du Nord (malgré la sanction prévue d'être condamné à cinq ans de prison et 75 000 euros d'amende).
Rage humaine
La rage humaine est surveillée par la déclaration obligatoire et le Centre national de référence à l'Institut Pasteur.
De 1970 à 2018, 23 cas de rage humaine ont été diagnostiqués en France, dont 8 cas âgés de 5 ans ou moins. 22 étaient des cas importés, contaminés pour la majorité en Afrique, dont un avait été contaminé par une greffe de cornée issue d’un donneur de retour d’Égypte. Le cas non importé est survenu en 2008 en Guyane, probablement lié à une contamination par une chauve-souris[27].
Le dernier cas importé est décédé en France (Rhône) en , un enfant de 10 ans mordu par un chiot avec qui il jouait au Sri Lanka[48].
Rage des chiroptères
48 cas positifs de chauve-souris enragée ont été identifiés de 1989 à 2014. Ces chiffres sont une sous-estimation, les chauve-souris étant une espèce protégée, la surveillance ne se fait pas par prélèvement actif dans la nature[29].
Cette rage est lié à un virus différent de celui de la rage vulpine, c'est un virus cousin avec de notables différences tant dans son expression (il peut rester à l'état latent pendant très longtemps) que dans ses espèces cibles. La seule recommandation est de ne toucher les chauves-souris qu'en cas de nécessité absolue et de le faire avec des gants, les professionnels exposés faisant l'objet d'un suivi particulier[27].
Europe
De façon générale, la rage terrestre est éliminée ou contrôlée dans les pays de l'Union européenne, mais des cas occasionnels de rage canine surviennent encore en Europe de l'Est. La rage peut franchir les frontières en touchant les populations de renards Vulpes vulpes, ou par transport d'animaux de compagnie provenant de pays endémiques[49].
La Finlande et les Pays-Bas sont déclarés exempts de rage depuis 1991[1].
L'Allemagne n'a pu se débarrasser de certains foyers persistants qu'en 2008, notamment dans le Land de Hesse. Ce foyer était la source de différentes infections épisodiques constatées dans d'autres länder. Ainsi, le Bade-Wurtemberg (), le Rhénanie-Palatinat () et le Kreiz de Kussel () ont révélé une progression de la rage vers l'Ouest. Ce « front » progressait selon diverses estimations à une vitesse de 20 à 60 km par an. D'autres estimations plus récentes faisaient état d'une progression encore plus rapide, et dans toutes les directions à partir de ce Land de Hesse.
Dans chacun des Lands touchés, l'Allemagne a entrepris des campagnes de vaccinations orales des renards. Vu l'absence de cas enregistrés en 2008 et 2009, l'Allemagne a déposé la demande de déclaration d'État « libre » de rage, tout comme son voisin l'Autriche.
Depuis 1998, l'Allemagne a détecté 642 animaux atteints par la rage, dont quarante-quatre animaux domestiques, 422 renards et 115 chauves-souris. Cependant, depuis 2001, seuls huit cas d'animaux domestiques ont été confirmés. Cinq humains sont morts de la rage.
Le , l'Allemagne a déclaré à l'Organisation mondiale de la santé animale avoir vaincu la rage sur son territoire[50].
En Belgique et au Luxembourg, la rage est déclarée éliminée en 2001[1]. Mais en , au Luxembourg, un homme a été mordu dans sa chambre par une chauve-souris tombée sur son lit durant la nuit. L'animal s'est révélé être porteur du virus[51].
La Suisse est reconnue indemne de rage depuis le . L'apparition de la maladie par voie terrestre de cas provenant d'animaux sauvages est très rare. Cependant, le cas de chauves-souris ou d'animaux importés porteurs n'est pas exclu. D'ailleurs, depuis cette date, trois cas ont été constatés : un cas de chauve-souris infectée a été reporté en 2002 dans le canton de Genève, le cas d'un chien importé d'Afrique du Nord en 2003, dans le canton de Vaud, ainsi qu'un cas de morsure de chauve-souris en août 2017 dans le canton de Neuchâtel[52].
L'Italie a réussi à éradiquer la rage en 1997, mais une épizootie en provenance des Balkans et touchant également l'Autriche se développe en 2011. Une campagne de vaccination des animaux est mise en place, et après un dernier cas sauvage détecté en 2011, l'Italie est de nouveau classée comme exempte en 2013[53] - [54] - [55].
Fin 2011, des cas de rage vulpine avaient été identifiés en république de Macédoine à 3 km de la frontière grecque. Une surveillance de la rage vulpine a été mise en œuvre en Macédoine[56].En , les premiers cas grecs de rage vulpine ont été identifiés à proximité de la frontière macédonienne. Depuis, 16 cas de rage chez des animaux ont été notifiés à l’Organisation mondiale de la santé animale en Grèce dans les régions de Macédoine de l’Ouest et Macédoine Centrale. Le , les autorités grecques ont rapporté la survenue d’un cas de rage chez un chat domestique d’une ferme de la région de Thessalie[56]. « Selon l’OMS, les pays voisins de la Grèce sont considérés comme à haut risque de rage. La Grèce est indemne de rage depuis 1987. Les événements survenus depuis et l’extension du foyer devraient rapidement entraîner la perte du statut indemne[56]. »
La Tchéquie, après de vastes campagnes de vaccination des renards, a vu son dernier cas de rage en 2002, et a été déclarée exempte en [57].
En Pologne, des vaccinations massives des renards sont organisées, les cas sont concentrés dans le sud-est du pays, au niveau de la zone frontalière avec l'Ukraine[58]. Seule une vingtaine de cas est relevée en 2016.
Afrique et Moyen-Orient
En Afrique, le nombre de décès par rage transmise par le chien est estimé à plus de 20 000 par an, soit près de 36 % des cas mondiaux. De nombreuses vies pourraient être sauvées avec une amélioration de l'accès au PPE (prophylaxie post-exposition) et une réduction de la rage canine[59].
Au Moyen-Orient, ces décès ont été estimés à 229 en 2015[59].
Asie
L'inde est le pays le plus touché avec près de 60 % des 35 000 décès annuels en Asie, représentant près de 35 % des cas mondiaux[59].
En Asie centrale, on compte près de 1875 décès par rage chaque année[59].
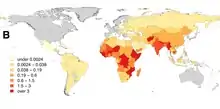
Depuis 2007, l'ONG tibétaine Tibet Charity organise des campagnes de vaccination de chiens et de chats à Dharamsala et dans des régions voisines comme Chauntra, Gopalpur et Trilokpur. Aucun cas de rage n'a été enregistré en 2007[60].
La république populaire de Chine recensait un pic de 3 279 cas de rage humaine en 2006. Les provinces du sud et du sud-est sont les plus touchées. La rage est parmi les trois premières causes de décès par maladie infectieuse notifiée, derrière le sida et la tuberculose[61] - [62]. Depuis les années 2010, la Chine notifie de 2000 à moins de 1000 cas humains par an[63] - [64]. La situation chinoise se caractérise par un développement économique rapide, avec plus d'animaux de compagnie et de l'industrie qui va avec, mais avec un défaut de surveillance et de contrôle, et un manque de vaccins antirabiques vétérinaires de qualité[65].
La République de Chine (Taïwan) est exempte de la rage de 1961 à 2013, mais la maladie ressurgit en 2013 parmi les Melogale[66] - [67].
La rage était endémique au Japon, avec un pic dans les années 1920, mais la vaccination des chiens et la lutte contre les chiens errants ont fait diminuer les cas[68]. En 1950, une loi a été votée pour lutter contre la rage[69], et les derniers cas sont recensés en 1954 et 1957[70] - [71].
Depuis cette date, le Japon est considéré comme étant exempt de rage, même si des cas contractés à l'étranger, notamment aux Philippines, sont parfois encore déclarés[68] - [72] - [73].
Australie
L'Australie est officiellement exempte de rage. Un premier cas aurait été signalé en 1867[74]. Deux morts ont été constatées, en 1987 et 1990, la maladie ayant été contractée à l'étranger[75]. Des craintes existent quant à l'introduction de cette maladie par des animaux en provenance de l'Indonésie voisine[76].
Amériques
Au Canada, la rage est une maladie qui doit obligatoirement être signalée. Chauve-souris, renard arctique ou roux, mouffette, raton-laveur ou animaux domestiques sont généralement la cause des infections[77]. L'Ontario est la province la plus touchée.
Aux États-Unis, en 2007, la rage canine a été déclarée éradiquée[78]. Chauves-souris, mouffettes et ratons-laveurs restent les principaux vecteurs d'infection[79].
L'épidémie de rage s'est déclarée chez les mouffettes dans le nord-est des États-Unis à partir des années 1970, et se répand dans les autres États. Le contrôle par vaccination orale[80] - [81] est plus difficile qu'en Europe, à cause de la diversité des vecteurs, de l'étendue des territoires à traiter, et du coût plus élevé de ces campagnes[1].
En Amérique centrale et du sud, les campagnes soutenues de contrôle de la rage canine ont réduit les cas humains de façon très significative. En 2016, les cas humains transmis par le chien sont au nombre de 10 dans deux pays Haïti (8) et Guatemala (2). On compte toutefois 23 décès humains de rage transmise par des animaux autres que le chien : Brésil (3), Colombie (2), Guatemala (1), Mexique (2), Pérou (15)[39].
Clinique
Rage animale
Chez l'animal, les symptômes dépendent de l'espèce concernée. Il s'agit le plus souvent de troubles du comportement (forme furieuse, léthargique, paralytique… ou formes intriquées, intermédiaires, évoluant l'une en l'autre), ou encore activité diurne d'un individu appartenant à une espèce nocturne[82].
Rage des carnivores
Chez le chien, la rage évolue en trois phases[9] :
- Le début où l'on observe une brusque modification du comportement habituel : chien devenant plus agressif ou au contraire plus caressant, ou encore chien apathique, recherchant la solitude et l'obscurité ;
- Puis vient une phase d'excitation avec une hyperesthésie et parfois des convulsions des muscles faciaux (en particulier des masséters). L'aboiement d'un chien enragé est spécifique (« bitonal »). Un comportement anormalement agressif est fréquent, mais pas systématique. L'animal cherche à mordre tout objet se situant à proximité de sa tête, et ne lâche pas prise après morsure. Le chien enragé peut ingérer n'importe quel objet (bois, pierre, paille…) et leur présence dans l'estomac d'un chien était autrefois une aide au diagnostic de rage[83] ;
- La dernière phase est paralytique, avec une hypersalivation marquée, dépression et coma[9]. La mort survient par arrêt respiratoire vers le dixième jour après le début des symptômes.
Le vétérinaire cherche ainsi systématiquement à écarter en première intention la rage lorsqu'un chien vient en consultation avec des troubles nerveux.

Rage des herbivores
Les bovidés sont très sensibles à la rage, de même les ovidés et caprinés peuvent présenter des formes furieuses de rage. Mais habituellement ils ne mordent pas et vont plutôt charger[83].
La rage du cheval est rare, mais elle est furieuse et dramatique : le cheval enragé se précipite sur tout animal à proximité, y compris l'homme, et sur tout objet jusqu'à se briser la mâchoire. Il peut aussi se déchirer et se mordre lui-même[83].
Rage humaine
L'incubation est variable, habituellement comprise entre un et trois mois[84] (extrêmes de quelques jours à plus d'un an[35]). Ce temps long d'incubation rend possible la prévention vaccinale de la rage, même après morsure.
Ce temps d'incubation varie selon l'importance de la dose infectieuse (quantité de virus inoculé), du lieu d'inoculation et de sa richesse en terminaisons nerveuses[85]. Par exemple une morsure rabique délabrant la face a une incubation plus courte qu'une morsure égratignant le mollet ; ou une morsure à la main qu'une morsure au tronc.
Début
Les premiers signes sont non spécifiques, à type de douleurs au niveau du point d'inoculation. Il peut exister un prurit, une réaction locale[86]. La maladie se poursuit par l'apparition de signes neurologiques : anxiété, confusion, agitation avec troubles du comportement avec insomnies, troubles des fonctions cérébrales supérieures. Ces troubles évoluent vers une encéphalite qui peut se présenter sous deux formes : la forme furieuse (70 à 90 % des cas) et la forme paralytique (10 à 30 % des cas)[84].
Forme furieuse
L'hydrophobie rabique serait présente plus fréquemment lorsque la transmission a été faite par un chien[87]. C'est un signe classique de rage, elle consiste en un spasme à la déglutition des liquides, avec risque d'étouffement et de fausse route. Ce spasme est lié à une hyperesthésie du pharynx et du larynx (sensation de brûlures insoutenable à l'ingurgitation d'eau). Par réflexe pavlovien, les spasmes de l'hydrophobie rabique se déclenchent à la seule perception (vision, audition…) ou évocation de l'eau[85].
Beaucoup moins fréquentes sont l'aérophobie réalisant un spasme facial extensif déclenché par un souffle d'air derrière l'oreille, avec peur réflexe des situations à courants d'air ou air frais[84] - [85], et la photophobie[3] qui se retrouve dans de nombreuses affections autres que la rage.
L'encéphalite proprement dite se manifeste par des hallucinations, doublement de vision et d'éventuels délires avec état d'agitation, pouvant être compliquées par des convulsions, une fièvre. Le décès survient en quelques jours par arrêt cardio-respiratoire.
Selon des chroniqueurs du XVIIe siècle, « À Sewen, dans la vallée de Masevaux, à l’automne en 1672 un loup mord beaucoup de personnes, chacune est prise d’un fou rire et en mourait après la morsure[88]. »
Forme paralytique
Dans 10 à 30 % des cas, la maladie prend la forme d'une paralysie ascendante ressemblant au syndrome de Guillain-Barré. L'évolution est plus longue, moins dramatique, sans hydrophobie[89], mais finalement presque toujours mortelle. Ces cas sont souvent mal diagnostiqués, d'où une sous-notification des cas de rage dans le monde[84].
Diagnostic
Le diagnostic est fait soit par la recherche d'ARN viral dans une biopsie cutanée au niveau de la nuque[35], soit par diverses techniques détectant tout ou partie du virus dans les tissus infectés (peau, urines ou salive) avant ou après la mort[90].
La présence d'anticorps anti-rabique est inconstante et retardée. Leur dosage par immunofluorescence dans le tissu cérébral, après la mort, est la méthode de référence de confirmation[90].
En France, le diagnostic chez l'animal repose sur la mise en évidence de l'antigène viral et de l'isolement du virus à partir de tissus cérébraux. Toutes les demandes de diagnostic sont traitées par le CNRR (Centre National de Référence de la Rage). Chaque année, ce centre reçoit 1 300 prélèvements issus d'animaux suspects décédés ou euthanasiés sous surveillance vétérinaire[91].
Traitement
Le traitement antirabique à visée curative, dit aussi de prophylaxie post-exposition (PPE), doit être réalisé aussitôt que possible après une plaie ou morsure à risque. La rage diffère de nombreuses infections par la longue durée de son incubation, et du fait qu'elle peut être prévenue à temps par une vaccination, même après une exposition aux virus rabiques[92].
Le traitement antirabique PPE correspond à une « course de vitesse » entre la diffusion du virus et le système immunitaire du sujet contaminé[93], avant l'apparition des signes cliniques. Le but est alors d'accélérer la production d'anticorps neutralisant le virus, par vaccination (immunisation active), et selon les cas par immunoglobulines spécifiques (immunisation passive).
Selon l'OMS, un traitement PPE réalisé rapidement est efficace à 100 % même en cas d'exposition grave. Les principales causes d'échecs et les décès qui s'ensuivent sont liées à une prise en charge tardive, une plaie mal soignée ou passée inaperçue, une atteinte directe des nerfs, et un traitement PPE incomplet ou mal suivi[92].
Traitement local
C'est la première étape et elle consiste à traiter localement afin d'éliminer un maximum d'agents pathogènes au niveau du point d'entrée de l'infection par des moyens à la fois mécanique (lavage) et chimique (antisepsie). En ce sens la plaie de la morsure doit être immédiatement lavée abondamment à l'eau savonneuse puis rincée à l'eau pure, et enfin désinfectée avec un antiseptique (alcool à 70°, dérivé iodé…)[94].
Les plaies importantes font l'objet d'une prise en charge aux urgences, où elles sont explorées et réparées chirurgicalement. L'antibiothérapie est indiquée selon les circonstances. La prévention du tétanos est systématique.
Évaluation du risque
Le risque de contamination rabique dépend de nombreux facteurs.
Il y a déjà le facteur territorial, avec une emphase sur les pays endémiques de rage des animaux terrestres. Dans d'autres pays, comme en France métropolitaine, la rage des animaux terrestres est considérée comme étant éliminée. Toute morsure de chauve-souris sur le territoire, ainsi que toute morsure survenue à l'étranger en pays endémique de rage, sont potentiellement à risque et doivent être traitées. Un risque exceptionnel persiste également en cas de morsure ou léchage par un chien illégalement importé.
Cela dépend aussi du sort de l'animal mordeur selon que l'animal est retrouvé vivant (mis en surveillance) ou mort, ou non retrouvé. Sur le territoire français (sauf Guyane et Mayotte), il n'est plus recommandé de vacciner les personnes mordues par un mammifère terrestre, quand l'animal n'est pas disponible (non retrouvé) ; le risque résiduel d'un animal importé infecté étant considéré comme négligeable à l'échelle nationale française, estimé à 7,52 × 10−10[95].
Il y a aussi la nature du contact : avec les plaies par morsures, griffures, etc, le risque est élevé tandis qu'il sera plus faible par contact direct simple (léchage, attouchement de la face de l'animal) ou indirect (objets souillés, animal qui vient d'être mordu par l'animal suspect)[94].
Entre aussi en compte le siège de l'éventuelle morsure (à la face, au cou, et aux extrémités, elles sont plus dangereuses). En l'absence de traitement, la probabilité moyenne de développer la rage après morsure d'un animal enragé est de 55 % pour une morsure à la tête, 22 % au membre supérieur, 9 % au niveau du tronc et 12 % au membre inférieur[31]. L'interposition de vêtements intacts (non déchirés) est considérée comme protectrice.
L'OMS distingue trois niveaux de risques avec un animal enragé ou présumé enragé[31], ces recommandations s'appliquent en France[94] :
- Catégorie I : contact ou alimentation de l'animal, léchage sur peau intacte. Pas de traitement antirabique ;
- Catégorie II : peau découverte mordillée, griffures bénignes sans saignements, léchage sur peau érodée. Vaccination immédiate, interrompue si la rage de l'animal n'est pas confirmée ;
- Catégorie III : morsure ou griffure ayant traversé la peau, contamination d'une muqueuse par la salive de l'animal. Administration immédiate d'immunoglobulines antirabiques en même temps que la vaccination.
Traitement spécifique

Le traitement post-exposition est réalisé dans un centre antirabique. Il repose sur plusieurs injections rapprochées de vaccin, associées selon les cas à des immunoglobulines spécifiques.
Les immunoglobulines antirabiques sont d'origine équine ou humaine, ces dernières étant plus chères. Si possible, elles sont injectées au niveau des morsures, et en même temps que la première injection de vaccin. Elles ne doivent pas être injectées après le septième jour du traitement vaccinal[95].
En France, on utilise des vaccins inactivés, produits sur cultures cellulaires soit cellules Vero, soit sur cellules d'embryon de poulet. Il existe différents protocoles par injections intramusculaires :
- protocole dit de « Essen » : en 5 injections aux jours 0, 3, 7, 14 et 28 ;
- dit de « Zagreb » : en 4 injections 2-1-1 aux jours 0, 7 et 21 ;
- dit de « Essen réduit » : en 4 injections aux jours 0, 3, 7, et 14 ;
- un schéma encore plus raccourci en 3 injections est en cours de validation par l'OMS[95].
En 2018, les données disponibles indiquent que la voie intradermique est d'une efficacité équivalente à la voie intramusculaire en réduisant les coûts et la dose nécessaire[96].
Traitement de la rage déclarée chez l'humain
Dans tous les cas, le patient doit être hospitalisé, avec des précautions d'hygiène simples pour le personnel, le virus ne se transmettant au soignant que si la peau est lésée.
La rage déclarée, c'est-à-dire la rage qui a déjà produit ses premiers symptômes (ce qui indique que le virus est parvenu aux centres nerveux), est une maladie presque toujours mortelle chez l'humain. L'accent est mis sur les soins palliatifs pour les patients à rage confirmée, respectant l'intimité, la dignité et les besoins culturels du patient et de sa famille[97].
Les principaux soins sont l'hydratation, des tranquillisants comme les benzodiazépines, et des sédatifs comme la morphine. Les soins invasifs sont à éviter[97].
Les cas de survie sont tout à fait exceptionnels. Fin 2004, à Wauwatosa dans le Wisconsin, un traitement expérimental a permis de sauver sans vaccination une jeune adolescente américaine, nommée Jeanna Giese, contaminée par une chauve-souris. Le traitement, depuis connu sous le nom de protocole de Milwaukee, consiste à plonger le patient dans un coma artificiel pour ralentir la progression de la maladie et à lui administrer un traitement médical intensif[98]. Un article paru en 2009 a recensé 25 tentatives d’application de ce traitement dans sa première version avec un taux de survie de 8 % (soit 2 sur les 25), et 10 dans sa seconde version avec deux survivants, soit 20 %[99]. Un article scientifique de 2016[100] et un rapport d'experts de l'OMS de 2018[97] recommandent de ne plus utiliser ce protocole, en raison du taux d'échecs et des séquelles graves en cas de survie.
Selon ce rapport, les traitements dits agressifs ou expérimentaux devraient être soumis et approuvés par des comités d'éthique, après discussion avec les familles[97].
Pour les animaux
Il faut signaler immédiatement tout cas de rage au chef technique ou à l'autorité administrative locale. Tout chien mordeur doit être considéré comme suspect de rage, car un chien infecté peut transmettre le virus avant l'apparition des premiers symptômes.
Aussi est-il nécessaire, si le diagnostic est incertain, de le garder en quarantaine en observation pendant au moins quinze jours, avec trois examens de vétérinaire aux jours 0, 7 et 15[95]. Le chien doit être nourri et abreuvé. Si le chien est enragé, et si les signes progressent après les premiers symptômes, il peut être euthanasié[101], car il mourra au bout de dix jours.
Prévention
En Belgique, en France et en Suisse, la rage est sur la liste des maladies infectieuses à déclaration obligatoire.
Surtout dans les pays où la rage est endémique, il est conseillé d'éviter tout contact avec un animal inconnu, domestique ou sauvage, vivant ou mort.
Vaccins
Un vaccin préventif contre la rage existe et reste recommandé en France pour les voyageurs, professionnels et chiroptérologues risquant d'être exposés au virus[27]. Il est inoculé aux personnes dont l'activité est un facteur de risque d'infection. Les vétérinaires ou les personnes se rendant dans les pays où la maladie est endémique en sont des exemples.
À noter que la chloroquine, médicament antipaludéen diminue l'efficacité du vaccin intramusculaire contre la rage et ce, en prophylaxie, comme en pré-exposition[102].

La vaccination préventive utilise les mêmes vaccins que ceux de la vaccination curative. En France, les deux vaccins humains disponibles appartiennent aux vaccins, dits de 3e génération, préparés sur cultures cellulaires[40] - [103] :
- vaccin inactivé, produit sur cellules Vero (PVRV, « purified Vero cell rabies vaccine ») : vaccin rabique Pasteur₢ ;
- vaccin inactivé, produit sur cellules embryonnaires de poulet (PCECV, purified chick embryo cell vaccine) : vaccin Rabipur₢.
Il existe d'autres vaccins, produits sur d'autres cultures cellulaires, telles que sur cellules diploïdes humaines (HDCV, « Human diploid cell culture rabies vaccine ») .
Le protocole est celui recommandé par l'OMS, en 3 injections aux jours 0, 7 et 28. Les rappels éventuels ultérieurs se font en fonction d'un suivi sérologique tous les 2 ans en situation à faible risque et tous les 6 mois en risque élevé. Ce vaccin préventif ne dispense pas d'une vaccination curative en cas de morsure : chez le sujet déjà vacciné, non immunodéprimé, elle est réduite à deux injections aux jours 0 et 3[95].
Ces vaccins sont très supérieurs aux anciens vaccins préparés sur tissus nerveux, aussi bien du point de vue de l'efficacité que de l'innocuité. Depuis 1984, l'OMS recommande l'abandon complet de ces anciens vaccins[96]. En 2018, ce type de vaccin sur tissu nerveux reste encore utilisé en usage humain dans quatre pays : Algérie, Argentine, Bolivie et Éthiopie[104].
Les effets indésirables des vaccins antirabiques sur cultures cellulaires sont des douleurs et inflammations mineures chez 35 % à 45 % des sujets vaccinés, et des manifestations bénignes telles que réaction fébrile, maux de tête, malaises et troubles digestifs chez 5 à 15 % des vaccinés. Les manifestations graves sont rares et la survenue de troubles neurologiques n'a pas été démontrée[105].
Lutte contre la rage animale
Le commerce international d'animaux domestiques et sauvages obéit à une réglementation incluant la présentation d'un certificat vétérinaire international validé. La règlementation de chaque pays pour l'importation d'animaux vivants doit être conforme aux standards de l'OIE[106].
Les épizooties de rage sauvage terrestre se traitent par vaccination, notamment par voie orale. La réduction des populations sauvages n'est pas recommandée.
Rage des chiens
Les campagnes de vaccination de masse ciblent principalement les chiens. Cette stratégie s'est avérée efficace sur tous les continents, en arrêtant la transmission entre les chiens, et en réduisant la transmission du chien à l'homme et à d'autres mammifères[33], avec une couverture vaccinale minimum de 70 %. Cette vaccination doit s'accompagner, selon le contexte, d'un contrôle des chiens errants, mais pas de leur abattage qui est inefficace à long terme, et contre-productive (le ciblage des chiens errants fait négliger la vaccination des chiens domestiques)[101].
De même une stratégie de stérilisation des chiens peut être envisagée dans des situations particulières, mais la priorité est à la vaccination, moyen le plus efficace pour réduire la rage canine, et indirectement la rage humaine[107].
Rage des renards
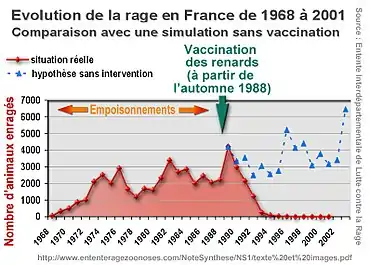
Au cours de la Seconde Guerre mondiale, une rage des renards réapparait en Europe de l'Est (probablement à la suite de l'élimination des loups de ces régions). Signalée en Pologne en 1945, elle progresse vers l'Ouest à une vitesse moyenne de 40 km par an et parvient en France (Moselle) en 1968[108] - [109]. Dans les années 1970, la rage des renards s'étend sur le quart nord-est du territoire français. Le maximum est atteint en 1989 (27 départements touchés, et 4212 cas de rage animale confirmés en laboratoire)[109].
Le Danemark s'est protégé sur sa frontière, par la destruction systématique des renards sur une bande de 30 km de large. Cette méthode a été critiquée pour son efficacité de courte durée, les renards des régions voisines venant réoccuper les zones traitées. En Suisse et en Allemagne, des essais de capture de renards, vaccinés comme les chiens (injection intra-musculaire) puis relâchés, sont des échecs, car trop difficiles à réaliser[110].
À partir de 1971, des chercheurs américains démontrent qu'il est possible de vacciner les renards par voie orale par virus vivant atténué. En 1978, les Suisses sont les premiers à appliquer cette méthode sur le terrain, en utilisant comme appâts des têtes de poulets contenant une capsule de vaccin.
On a montré en laboratoire que le virus peut être transmis par voie orale à des rongeurs[111]. Aussi les autres pays, appuyés par l'OMS, préfèrent garder une attitude prudente. C'est seulement à partir de 1983, que d'autres essais ont lieu en utilisant d'autres appâts et d'autres vaccins améliorés grâce à la technique des anticorps monoclonaux. C'est notamment le cas de pays comme le Luxembourg, la Belgique, l'Allemagne, l'Autriche et l'Italie[110].
La France adopte cette méthode d'appâts vaccinant en 1986, par largage à partir d'hélicoptères en 1988. À partir de 1990, la rage du renard diminue régulièrement et fortement chaque année, jusqu'à atteindre des niveaux négligeables en 1998 (4 cas de rage animale, chacun sur une espèce différente : un renard, une chauve-souris, un chien et un chat)[109].
La vaccination des renards a lieu lors de la lutte contre la rage vulpine. Des appâts contenant une dose du vaccin dans une capsule sont mis en place, généralement par hélicoptère, et sont mangés par les renards, permettant la libération du vaccin[112]. La vaccination orale a été expérimentée la première fois en Suisse en 1978.
Des vaccinations massives de ce type permettent l'éradication de la maladie chez les renards. Le taux de vaccination des renards doit être d'au moins 75 %.
Rage des chauves-souris
En ce qui concerne la rage des chauves-souris, celles-ci sont peu accessibles. L'éducation du public est primordiale[113]. Dans des zones où des chauves-souris vampires sont porteuses de rage de manière endémique (Amérique du Sud), il est recommandé de se protéger des morsures de chauves-souris pendant la nuit. Ainsi, les voyageurs en forêt dormiront sous moustiquaire même en l'absence de moustiques. La moustiquaire devra être disposée de façon suffisamment ample pour qu'il soit impossible à une chauve-souris de mordre la personne au travers de la moustiquaire.
En Europe, la rage de chauve-souris autochtone est documentée depuis 1954 en Allemagne, puis dans les autres pays européens (France en 1989). L'espèce majoritairement en cause est une chauve-souris insectivore, la sérotine commune. Une chauve-souris enragée se caractérise par une activité diurne, un vol impossible, une paralysie ou une agressivité. Il est déconseillé de manipuler une chauve-souris à terre, trouvée en plein jour[25] - [26].
Notes et références
Notes
- Le virus ne supporte pas les températures de 38 à 40 °C, il devient inactif en peu de temps cependant une fois dans un organisme il est protégé.
Références
- F. Cliquet et E. Picard-Meyer, « Rabies and rabies-related viruses: a modern perspective on an ancient disease », Revue Scientifique Et Technique (International Office of Epizootics), vol. 23, no 2, , p. 625–642 (ISSN 0253-1933, PMID 15702724, lire en ligne, consulté le )
- Voir par exemple Ant. Jean Louis Magistel, « Les symptômes de la rage ou hydrophobie, après l’attaque d'un loup à Beurlay », Journal de l’hôpital de Beurlay, 1822, Bibliothèque Municipale de Saintes – MS 68, consultable sur le site Histoire Passion.
- Human rabies in Delhi
- https://www.anses.fr/fr/system/files/SANT-Fi-Rage.pdf
- Sherwood (trad. de l'anglais), Physiologie animale, Louvain-la-Neuve (Belgique)/Paris, De Boeck, , 61 p. (ISBN 978-2-8073-0286-0, lire en ligne), p. 742-743.
- Prescott 2010, p. 944.
- Hassan Badrane et Noël Tordo, « Host Switching in Lyssavirus History from the Chiroptera to the Carnivora Orders », Journal of Virology, vol. 75, no 17, , p. 8096–8104 (ISSN 0022-538X, PMID 11483755, DOI 10.1128/JVI.75.17.8096-8104.2001, lire en ligne, consulté le )
- (en) Cécile Troupin, Laurent Dacheux, Marion Tanguy et Claude Sabeta, « Large-Scale Phylogenomic Analysis Reveals the Complex Evolutionary History of Rabies Virus in Multiple Carnivore Hosts », PLOS Pathogens, vol. 12, no 12, , e1006041 (ISSN 1553-7374, PMID 27977811, PMCID PMC5158080, DOI 10.1371/journal.ppat.1006041, lire en ligne, consulté le )
- « La rage animale », sur draaf.paca.agriculture.gouv.fr (consulté le )
- « Astrocyte Infection during Rabies Encephalitis Depends on the Virus Strain and Infection Route as Demonstrated by Novel Quantitative 3D Analysis of Cell Tropism »(en)
- Prescott (trad. de l'anglais), Microbiologie, Bruxelles/Paris, De Boeck, , 1088 p. (ISBN 978-2-8041-6012-8), p. 944.
- « Monosynaptic Circuit Tracing with Glycoprotein-Deleted Rabies Viruses »(en)
- « Rabies Virus Hijacks and Accelerates the p75NTR Retrograde Axonal Transport Machinery »(en)
- « From bite site to brain: How rabies virus hijacks and speeds up transport in nerve cells »(en)
- « Diabolical effects of rabies encephalitis »(en)
- « A Case of Fatal Serotonin Syndrome–Like Human Rabies Caused by Tricolored Bat–Associated Rabies Virus »(en)
- Jean-Marie Huraux 2003, p. 557-558.
- Natural Rabies Infection in a Domestic Fowl (Gallus domesticus): A Report from India https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4511517/
- Jean-Marie Huraux 2003, p. 558-560.
- E. Pilly 2017, p. 485.
- Kenneth F. Kiple 1993, p. 962-963.
- Jean Théodoridès 1986, p. 238-241.
- (en) Berton Roueché, The Medical Detectives, Plume Publ., (ISBN 9780452265882), « The Incurable Wound »
- WHO 2018, p. 101.
- Emmanuelle Ferry, « Morsure de chauve-souris », La Revue du Praticien - médecine générale, vol. 14, no 497, , p. 825-826.
- Y. Rotivel, « La rage des chiroptères en France », Bulletin Epidémiologique Hebdomadaire, (lire en ligne)
- Haut Conseil de la santé publique (2013), Avis relatif à la vaccination antirabique préventive, traitement post-exposition et suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues), Avis publié le 22/02/2013 et rapport Vaccination antirabique préventive, traitement post-exposition et suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues) publié le 22/02/2013
- Exposition humaine à la rage après morsure de cheval au KwaZulu-Natal en Afrique du Sud Médecine des voyages ; Publié le 3 mars 2018
- HAS 2018, p. 9.
- « Un homme mort de la rage après avoir été en contact avec des chauves-souris », sur www.20minutes.fr (consulté le )
- OMS 2018, p. 203.
- Helmick CG, Tauxe RV, Vernon AA, Is there a risk to contacts of patients with rabies?, Rev Infect Dis, 1987;9:511-8
- OMS 2018, p. 202.
- Nel LH, Discrepancies in data reporting for rabies, Africa, Emerg Infect Dis, 2013;19:529-33
- Crowcroft NS, Thampi N, The prevention and management of rabies, BMJ, 2015;350:g7827
- Hampson K, Coudeville L, Lembo T, Sambo M, Kieffer A, et al., « Estimating the Global Burden of Endemic Canine Rabies », (2015): en ligne. PLOS Neglected Tropical Diseases 9(5): e0003786. doi: 10.1371/journal.pntd.0003786
- WHO 2018, p. 120-124.
- « Unis contre la rage », sur OIE Bulletin (consulté le )
- WHO 2018, p. 4.
- HAS 2018, p. 22-24.
- « La rage, par l'ANSES », sur www.anses.fr (consulté le )
- La rage en France en 2011 sur le site de l'Institut Pasteur Lire en ligne
- Ministère de l'alimentation, de l'agriculture et de la pêche, « Recherche des personnes et animaux en contact avec les trois animaux enragés », sur agriculture.gouv.fr, (consulté le )
- Florence Reynald, « Les propriétaires des chiens en colère », sur www.ladepeche.fr, La Dépêche du midi, (consulté le )
- Florence Reynald, « Préfecture condamnée », sur www.ladepeche.fr, La dépêche du midi, (consulté le )
- HCSP, « Avis relatif au traitement post-exposition de la rage », sur hcsp.fr, , p. 9.
- « Argenteuil : un cas de rage détecté sur un chaton », sur Le Parisien, (consulté le )
- « Explications et conseils suite au cas de rage survenu en France », Institut Pasteur, (lire en ligne, consulté le )
- Anthony R. Fooks et Nicholas Johnson, « Jet set pets: examining the zoonosis risk in animal import and travel across the European Union », Veterinary Medicine (Auckland, N.Z.), vol. 6, , p. 17–25 (ISSN 2230-2034, PMID 30101093, PMCID PMCPMC6067792, DOI 10.2147/VMRR.S62059, lire en ligne, consulté le )
- (de) « Deutschland ist frei von Tollwut » lire en ligne
- Frédéric Soumois, « Un Luxembourgeois contaminé par la rage après une morsure de chauve-souris », (consulté le )
- « Mordu par une chauve-souris porteuse de la rage dans le canton de Neuchâtel », sur RTS.ch, (consulté le )
- « Archived copy » [archive du ] (consulté le )
- « Archived copy » [archive du ] (consulté le )
- « La rage est de retour dans le nord de l’Italie », sur destination santé, (consulté le )
- Bulletin Hebdomadaire International no 392,
- Anne-Lise Rodier, « LA RAGE ÉRADIQUÉE EN RÉPUBLIQUE TCHÈQUE », sur Radio Prague, (consulté le ).
- (en) General Veterinary Inspectorate - Polish Veterinary Inspection, « RESULTS OF THE IMPLEMENTATION OF 2016 RABIES ERADICATION PROGRAMME » (consulté le ).
- WHO 2018, p. 5.
- (en) Tenzin Dharpo, Local NGO champions eradication of rabies from Dharamshala, Phayul.com, 6 octobre 2015
- Isoline Fontaine, « Epidémie de rage en Chine », sur sciences et avenir, (consulté le )
- Yuehong Wei, Xiaoning Liu, Dapeng Li et Shouyi Chen, « Canine rabies control and human exposure 1951–2015, Guangzhou, China », Bulletin of the World Health Organization, vol. 97, no 1, , p. 51–58 (ISSN 0042-9686, PMID 30618465, PMCID 6307510, DOI 10.2471/BLT.18.217372, lire en ligne, consulté le )
- (en) Xing-Quan Zhu, Lili Cao et Quan Liu, « Major emerging and re-emerging zoonoses in China: a matter of global health and socioeconomic development for 1.3 billion », International Journal of Infectious Diseases, vol. 25, , p. 65–72 (ISSN 1201-9712, PMID 24858904, DOI 10.1016/j.ijid.2014.04.003, lire en ligne, consulté le )
- « Epidemiology of human rabies in China, 2016 (résumé en anglais) », sur ncbi.nlm.nih.gov, Zhonghua Liu Xing Bing Xue Za Zhi, (consulté le )
- Xianfu Wu, Rongliang Hu, Yongzhen Zhang et Guanmu Dong, « Reemerging Rabies and Lack of Systemic Surveillance in People’s Republic of China », Emerging Infectious Diseases, vol. 15, no 8, , p. 1159–1164 (ISSN 1080-6040, PMID 19751575, PMCID 2815959, DOI 10.3201/eid1508.081426, lire en ligne, consulté le )
- (en) Wenjie Bao, « Rabies Reemerges in Taiwan After Half a Century of Silence », sur health map, (consulté le )
- « La rage réapparaît à Taiwan », sur Taiwan info, (consulté le )
- Yamada, Akio Challenges and risk for rabies free countries Retrieved July 15, 2016
- Inoue, Dr Satoshi http://www.npo-bmsa.org/ewf055.htm No.55 Prevention and risk management of rabies in Japan Retrieved July 15, 2016
- Takahashi-Omoe, Hiromi Regulatory Systems for Prevention and Control of Rabies, Japan Volume 14, Number 9—September 2008 Retrieved July 15, 2016
- Inoue, Dr Satoshi The Rabies Prevention and the Risk Management in Japan Retrieved July 15, 2016
- Rabies still poses a threat December 21, 2006 Japan Times Retrieved July 15, 2016
- Dog-bit Kyoto man who caught rabies in Philippines dies November 18, 2006 Japan Times Retrieved July 15, 2016
- Attwood, Bronwyn Murdoch Rabies and Australian Bat Lyssavirus January 2007 Retrieved July 15, 2016
- Rabies - Queensland Government Retrieved July 15, 2016
- Drewitt, Andy Health experts say Australia must brace for rabies arrival from Indonesia January 3, 2012 The Australian
- http://www.inspection.gc.ca/animaux/animaux-terrestres/maladies/declaration-obligatoire/rage/cas-de-rage-au-canada/fra/1356156989919/1356157139999
- (en) Maggie Fox, « U.S. free of canine rabies virus », sur Reuters.com, (consulté le )
- (en) Randy Pirtle, « Two-thirds of rabies deaths in US attributed to bat exposure », sur examiner-entreprise, (consulté le )
- « Compendium of animal rabies prevention and control, 2006: National Association of State Public Health Veterinarians, Inc. », Centers for Disease Control and Prevention (CDC), vol. 55, no RR-5, , p. 1–8 (PMID 16636647, lire en ligne)
- (en-US) « Oral Rabies Vaccine Project – Environmental Epidemiology », sur www.vdh.virginia.gov (consulté le )
- WHO 2018, p. 78.
- A. Rochaix, « La Rage » (fascicule 8064-A), Encyclopédie Médico-Chirurgicale, maladies infectieuses, , p. 2-4.
- « Rage », sur World Health Organization (consulté le )
- Jean-Marie Huraux 2003, p. 560-561.
- Hemachudha T, Laothamatas J, Rupprecht CE, Human rabies: a disease of complex neuropathogenetic mechanisms and diagnostic challenges, Lancet Neurol, 2002;1:101-9
- Udow SJ, Marrie RA, Jackson AC, Clinical features of dog- and bat-acquired rabies in humans, Clin Infect Dis, 2013;57:689-96
- Pfeiffer T (2006) Le loup en Alsace : de mémoire d’homme ; Revue d’Alsace, (132), 175-203
- (en) NHS, « Rabies - Symptoms », sur www.nhs.uk (consulté le )
- OMS 2018, p. 205.
- Perrine Parize, « Rage », La Revue du Praticien, vol. 69, no 4, , p. 423-428.
- OMS 2018, p. 206.
- Direction Générale de la Santé 2012, p. 181.
- E. Pilly 2017, p. 486.
- E. Pilly 2018, p. 487-488.
- OMS 2018, p. 207.
- WHO 2018, p. 43-44.
- (en) Rodney E. Jr Willoughby, KS Tieves et GM Hoffman, « Survival after treatment of rabies with induction of coma », New England Journal of Medicine, vol. 352, no 24, , p. 2508-2514 (ISSN 0028-4793, lire en ligne)
- (en) Rodney E. Jr Willoughby, « Are we getting closer to the treatment of rabies?: medical benchmarks », Future Virology, vol. 4, no 6, , p. 563–570 (ISSN 1746-0794, lire en ligne)
- (en) Alan C. Jackson, « Human Rabies: a 2016 Update », Current Infectious Disease Reports, vol. 18, no 11, , p. 38 (ISSN 1523-3847 et 1534-3146, DOI 10.1007/s11908-016-0540-y, lire en ligne, consulté le )
- WHO 2018, p. 79-80.
- (en) Timothy P. Endy, Paul B. Keiser, Don Cibula et Mark Abbott, « Effect of Antimalarial Drugs on the Immune Response to Intramuscular Rabies Vaccination Using a Postexposure Prophylaxis Regimen », The Journal of Infectious Diseases, vol. 221, no 6, , p. 927–933 (ISSN 0022-1899, DOI 10.1093/infdis/jiz558, lire en ligne, consulté le )
- Direction Générale de la Santé 2012, p. 184.
- WHO 2018, p. 48.
- OMS 2018, p. 210.
- WHO 2018, p. 89.
- WHO 2018, p. 90.
- Y. Rotivel, « Actualités sur la rage », Le Concours Médical, vol. 119, no 11, , p. 767-773.
- Bernard Toma, « La rage en France en 1999 », La Revue du Praticien, vol. 49, , p. 1262-1265.
- Michel Aubert, « La rage bientôt éradiquée en Europe occidentale ? », La Recherche, vol. 25, no 265, , p. 582-584.
- OMS (1973), Comité OMS d'experts de la Rage. Huitième rapport technique, 824 (PDF, 60 p.)
- Martine Duprez, « MAITRE RENARD, PAR L'APPAT ALLECHE, SE VACCINE », sur Le Soir, (consulté le ).
- WHO 2018, p. 106-107.
Voir aussi
Bibliographie
- OMS (1984). Comité OMS d'Experts de la Rage, pdf, 116 p.
- Jean Théodoridès, Histoire de la rage : cave canem, Paris/New York/Barcelone, Masson, , 289 p. (ISBN 2-225-80710-8).
 .
. - (en) Kenneth F. Kiple (dir.), The Cambridge World History of Human Disease, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), partie VIII, chap. 115 (« Rabies »), p. 962-967.

- Jean-Marie Huraux, Traité de virologie médicale, Paris, Estem, , 699 p. (ISBN 2-84371-203-3).
- (en) Stanley Plotkin, Vaccines, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), chap. 27 (« Rabies vaccines »), p. 687-714.
- Direction Générale de la Santé, Guide des vaccinations 2012, INPES, (ISBN 978-2-916192-28-4, lire en ligne), « La vaccination contre la rage », p. 181-191.
- E. Pilly, Maladies infectieuses et tropicales, Paris, CMIT -Alénia Plus, , 720 p. (ISBN 978-2-916641-66-9), chap. 98 (« Rage »), p. 485-488.

- OMS, « Vaccins antirabiques : Note de synthèse », Relevé Epidémiologique Hebdomadaire, no 16, , p. 201-219. (lire en ligne).
- HAS, Vaccination contre la rage, (lire en ligne)
- (en) WHO, WHO Expert Consultation on Rabies : Third Report, WHO Press, , 183 p. (ISBN 978-92-4-121021-8, lire en ligne).
 .
.