Tétanos
Le tétanos (en grec ancien : τέτανος, « rigidité spasmodique du corps » ), est une toxi-infection touchant l'être humain et autres animaux. Il est dû à une infection locale par la bactérie Clostridium tetani produisant une neurotoxine, la tétanospasmine, ciblant le système nerveux central. Cette toxine est l'un des plus puissants poisons biologiques connus. Elle entraîne la mort dans 20 à 30 % des cas. La guérison s'obtient après plusieurs jours ou semaines d'hospitalisation en réanimation et soins intensifs.

| Causes | Clostridium tetani |
|---|---|
| Transmission | Transmission par contact (d) |
| Incubation min | 3 j |
| Incubation max | 31 j |
| Symptômes | Spasme, fièvre, céphalée, insuffisance respiratoire, irritabilité, douleur, trismus, rire sardonique, dysphagie, triade diagnostique du tétanos (d), raideur de la nuque (en), salivation et tachycardie |
| Traitement | Pharmacothérapie, respirateur artificiel, myorelaxant, antitoxine tétanique, antiépileptique, traitement chirurgical primaire de la plaie (d), bêta-bloquant, glycoside cardiaque et antipyrétique |
|---|---|
| Médicament | Metocurine iodide (d), orphenadrine, Cyclobenzaprine, méthocarbamol, métronidazole, gidazepam (en) et fhenazepam |
| CISP-2 | N72 |
|---|---|
| CIM-10 | A33-A35 |
| CIM-9 | 037, 771.3 |
| DiseasesDB | 2829 |
| MedlinePlus | 000615 |
| eMedicine | 229594 |
| MeSH | D013742 |
![]() Mise en garde médicale
Mise en garde médicale
Dans les pays développés, si cette maladie est en voie de disparition, elle persiste encore par insuffisance de vaccination. Ailleurs, elle touche surtout les femmes qui viennent d'accoucher et les nouveau-nés des régions les plus pauvres, du fait d'une absence d'hygiène et de vaccination. En 2019, ce tétanos maternel et néonatal demeure un problème de santé publique dans 12 pays en développement.
Cette maladie n'est ni immunisante (il est possible d'être infecté plusieurs fois), ni contagieuse (pas de transmission de personne à personne). Elle n'est pas éradicable car les bactéries sont en permanence dans le sol et l'environnement, mais elle est totalement évitable par la vaccination et l'hygiène des plaies.
Historique
L'ère clinique
Les manifestations d'un tétanos déclaré sont suffisamment spectaculaires et caractéristiques pour avoir été reconnues dès la Haute Antiquité. En Égypte, le papyrus Kahun (2000 av. J.-C.) concernant les maladies des femmes, mentionne une contraction des mâchoires s'étendant à la partie postérieure du corps[1]. En Grèce (Ve siècle av. J.-C.), le tétanos est nommé par Platon[2] et décrit par Hippocrate (Des Maladies, III) sous deux formes : le tétanos (contraction des mâchoires avec rigidité du tronc et des membres) et l'opisthotonos (avec rigidité dorsale postérieure concave). Selon sa doctrine des jours critiques, il énumère les différents jours où le malade meurt ou survit (3e, 5e, 7e, 14e). Dans le texte hippocratique Aphorismes (5e section), on peut lire : « le spasme qui survient après une blessure est mortel ».
Une première description complète et précise apparaît au IIe siècle apr. J.-C. dans le Traité des maladies aiguës (livre I, chapitre 6) d'Arétée de Cappadoce (médecin romain, originaire d'Anatolie centrale). Cette description se termine ainsi :
« Calamité monstrueuse, spectacle désagréable, pénible à voir, mal irrémédiable ; dans cet état leurs amis mêmes ne peuvent les reconnaître. Si les vœux qu'on faisait auparavant pour leur mort avaient pu paraître impies, ils deviennent maintenant charitables, parce qu'il n'y a que la perte de la vie qui puisse mettre un terme à tant de souffrances, à tant de difformités. Le médecin, en effet, quoique présent ne trouve en son art aucun moyen, je ne dis pas de les guérir, mais même de les soulager. Ce serait en vain qu'il essaierait de changer leur posture : il les mettrait plutôt en pièces. Il ne lui reste donc qu'à s'affliger sur le sort de son malade, qu'il voit aux prises avec un mal auquel il ne peut remédier, et certes, il n'y a point de situation plus pénible et plus malheureuse pour un médecin[3]. »
Aucun changement notable n'apparaît jusqu'à la fin du XVIIIe siècle. Durant les guerres napoléoniennes, les premières statistiques de médecine militaire sur le tétanos font état de 12 à 13 cas de tétanos pour 1 000 blessés[4].
L'ère bactériologique
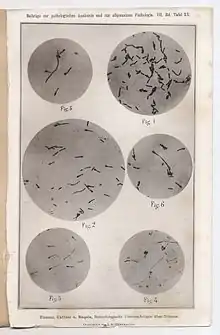
Au début du XIXe siècle, le tétanos est discuté sous deux formes : le tétanos chirurgical ou traumatique (lié à une plaie), le tétanos médical ou spontané (sans plaie reconnue). Les origines et les conditions du tétanos restent inconnues ou confuses : origine digestive, musculaire, nerveuse ? Conditions climatiques locales ? En 1854, Simpson émet l'idée d'un poison pénétrant dans la plaie. En effet, les manifestations du tétanos ressemblent à celles d'un empoisonnement massif à la strychnine (isolée en 1818 à partir de la noix vomique). Les recherches s'orientent alors vers la reproduction du tétanos chez l'animal.
En 1884, Antonio Carle (it) et Giorgio Rattone (it) réussissent cette transmission au lapin, en inoculant, dans le nerf sciatique, le pus d'un abcès à l'origine d'un tétanos humain.
La même année, Arthur Nicolaier fait de même chez le lapin et le cobaye en inoculant, sous leur peau, des terres de rues ou de jardins. Dans le pus des abcès provoqués, il décèle des bacilles allongés, de nature anaérobie, qu'il décrit comme l'agent spécifique du tétanos. Il ne les retrouve pas dans le tissu nerveux, renforçant l'idée que le tétanos est dû à un poison lié à une infection bactérienne locale (toxi-infection).
En 1889, Kitasato parvient à cultiver la bactérie en laboratoire, à montrer ses deux formes, végétative et sporulée.
En 1890, Knud-Faber obtient la toxine par filtration du bouillon de culture. Cette toxine tétanique, isolée et purifiée, peut alors être étudiée à la lumière des travaux menés en parallèle sur la toxine diphtérique.
Sérums
.jpg.webp)
Toujours en 1890, Kitasato et von Behring immunisent des lapins par la toxine atténuée. Ils montrent que ces lapins produisent des antitoxines protectrices, injectées à d'autres lapins non immunisés, elles les protègent du tétanos. Par la suite, l'antitoxine tétanique sera obtenue en grandes quantités par l'immunisation de chevaux. C'est le début de la sérothérapie antitétanique applicable à l'Homme, celle-ci offre une protection rapide mais de courte durée (à l'époque, 8 jours environ).
Le conflit de 14-18 réalise une expérience à grande échelle, jugeant la valeur des progrès obtenus. Au début de la guerre, les réserves de sérum étaient insuffisantes, et les chirurgiens militaires étaient divisés en querelles d'écoles sur la meilleure façon de traiter les plaies. Au 1er trimestre du conflit, l'armée britannique enregistre 8 cas de tétanos pour 1 000 blessés. À partir d'août 1915, l'Institut Pasteur fournit 4 000 doses de sérum par jour et 6 millions sur toute la durée du conflit[5]. Avec l'amélioration continue du traitement des plaies et de la disponibilité du sérum, le taux de tétanos chute à moins de 1,5 cas pour 1 000 blessés. Quand l'armée américaine intervient en 1917, elle a l'avantage de profiter de l'expérience de ses alliés, avec un taux de 0,16 cas de tétanos pour 1 000 blessés à la fin du conflit[4].
Toutefois, il est apparu aussi que la sérothérapie antitétanique avait des effets indésirables, parfois graves, dont la maladie sérique (réaction allergique au sérum de cheval), ce qui limitait les possibilités de répéter les injections. Elle n'était efficace qu'effectuée rapidement, dans les 24 h après les blessures. Un vaccin humain préventif, plus sûr et de longue durée d'action, était nécessaire.
Vaccins
La recherche vaccinale se heurte à une difficulté : l'immunisation animale alors utilisée pour la production de sérum, n'est pas applicable à l'Homme[6]. Elle est trop risquée, car la toxine atténuée, chauffée et iodée, n'est pas stable, elle peut retrouver sa toxicité. Le problème est d'obtenir une anatoxine, c'est-à-dire une toxine atténuée stable (sécurité) conservant ses propriétés immunogènes (efficacité).

Pierre Descombey, Gaston Ramon, Christian Zoeller trouvent la solution durant la période 1922-1927. La toxine atténuée doit être chauffée et formolée (formaldéhyde) pour la sécurité. D'autre part, l'efficacité peut être améliorée par l'ajout de substances stimulant l'immunité, comme les sels d'aluminium, c'est l'adjuvant. Enfin Ramon met au point les premières méthodes de titrage permettant de doser et mesurer la quantité et l'efficacité biologique des anatoxines. Les premières méthodes vaccinales sont précisées : nombre de doses, intervalles de temps, périodicité, rappels, etc.
À partir de 1929, en France, plusieurs types de vaccins antitétaniques sont disponibles : le vaccin simple sous forme diluée, sans adjuvant, le vaccin adsorbé, avec adjuvant, et le vaccin divalent tétanos-diphtérie.
La guerre de 39-45 sera, pour les vaccins, ce qu'a été 14-18 pour les sérums, l'occasion de juger à grande échelle. D'autant plus que les doctrines de médecine militaire, au début du conflit, sont différentes selon les belligérants. La France, le Royaume-Uni, le Canada utilisent le vaccin adsorbé ; les États-Unis, le vaccin fluide pour l'armée de terre et le vaccin adsorbé pour la marine. Les Britanniques font 2 doses sans rappel, les Américains 3 doses et un rappel, etc. Les Allemands préfèrent en rester aux sérums, en réservant la vaccination aux parachutistes, seuls susceptibles d'opérer loin de leur propre service de santé[7].
En 1942, l'armée britannique, qui compte 22 cas de tétanos depuis le début du conflit, adopte le schéma américain. Les États-Unis compteront 12 cas de tétanos sur un peu plus de 2,7 millions de blessés durant tout le conflit (ensemble des opérations), soit un taux de 0,44 pour 100 000. Du début de la Première Guerre mondiale à la fin de la seconde, les statistiques militaires des cas de tétanos sont passées de l'échelle sur 1 000 à l'échelle sur 100 000. En revanche, les hôpitaux américains et britanniques qui reçoivent les blessés allemands prisonniers font état de 53 cas de tétanos sur un seul mois de l'hiver 44-45. Durant la bataille de Normandie, les Allemands auraient eu 80 cas de tétanos, aucun chez leurs parachutistes engagés comme troupe au sol[8] - [9].
De la biochimie à la génétique moléculaire
Après la guerre, la toxine tétanique et son mode d'action font l'objet d'une recherche fondamentale[10]. En 1946-1948, ce sont les premières estimations du poids moléculaire de la toxine, les travaux sur sa constitution en sous-unités et leurs structures se poursuivent au moins jusqu'en 1989. En 1957, c'est la première étude suggérant une action de la toxine sur la neurotransmission. En 1959, cette action s'opère par affinité avec des récepteurs spécifiques du tissu nerveux. En 1986, le séquençage du gène de la toxine est effectué et en 2003, celui du génome complet de la bactérie Clostridium tetani.
Parallèlement, les études sur l'action de la toxine à l'échelle moléculaire se poursuivent jusqu'à nos jours. Il s'agit d'identifier et de comprendre tous les évènements biochimiques qui se succèdent en cascade à partir de sa fixation au neurone jusqu'à son mode d'action terminal.
Sur le plan médical, les progrès de l'immunologie permettent de remplacer les sérums antitétaniques d'avant-guerre par leurs principes actifs purifiés, les immunoglobulines antitétaniques d'origine équine. Elles ont une plus longue durée d'action que les premiers sérums, mais avec un risque allergique persistant. Dans les années 1960, les premières immunoglobulines d'origine humaine sont disponibles, le risque allergique est réduit au minimum, mais elles coûtent beaucoup plus cher. Elles s'imposeront finalement pour être la norme dans les pays développés. Dans les années 2000, la plupart des pays en développement y accèdent progressivement, en fonction de leurs moyens et de la baisse des coûts[11].
Enfin, à partir de 1960, les progrès de la réanimation et des soins intensifs (sédation, assistance respiratoire, soutien nutritionnel, etc.) ont permis d'abaisser la mortalité du tétanos déclaré à 20-30 % contre 80-90 % à la fin du XIXe siècle[4]. Mais il ne s'agit pas là d'un traitement curatif. Il s'agit de soulager et maintenir en vie le malade, jusqu'à ce que la toxine s'épuise d'elle-même par consommation (au bout de quelques jours ou de plusieurs semaines). Un peu comme Hippocrate, qui surveillait le passage des jours critiques.
Le cas particulier du tétanos néo-natal
Si le tétanos de l'enfant est connu depuis l'Antiquité, le tétanos du nouveau-né est pratiquement ignoré des médecins jusqu'au XVIIIe siècle[12]. À l'exception d'un obscur médecin de l'Antiquité tardive, Moschion (en), qui pensait que le trismus (contraction des mâchoires) du nouveau-né était dû à une stagnation du sang dans l'ombilic. La maladie sera connue dans les milieux populaires sous les noms de « maladie des 3-6 jours » en Chine, « maladie des 7 jours » ou « maladie des 8 jours » ailleurs. Aujourd'hui, selon l'OMS, la maladie survient, dans 90 % des cas, entre 3 et 14 jours[11].
Au XVIIIe siècle, l'accouchement et les soins aux nouveau-nés sortent progressivement de la sphère populaire et privée (femmes, matrones) pour entrer dans le domaine des médecins et de l'État (santé publique)[13]. En France, les médecins des Lumières commencent à décrire une maladie des nouveau-nés apparaissant à la première semaine, et qu'ils appelaient « induration » ou « enfant gelé ». Au début du XIXe siècle, l'idée d'une maladie de l'ombilic n'était qu'une théorie parmi des dizaines d'autres : irritation digestive, air froid, air marin, atmosphère impure, feux de cheminées, faute de la matrone, etc. En 1818, Abraham Colles est le premier à remarquer les similitudes entre cette maladie et le tétanos. Durant le XIXe siècle, sa mortalité de 99 % était telle que, selon Sally McMillen, « peu de parents éprouvaient le besoin d'appeler un médecin ».
En 1923, Broeck et Bauer, montrent que le sérum antitétanique peut traverser le placenta. En 1927, Ramon suggère de protéger le nouveau-né en immunisant la mère. En 1961, Schofield et Wesbrook, étudiant la maladie en Nouvelle-Guinée, montrent qu'ils peuvent réduire la fréquence de la maladie en vaccinant les femmes enceintes.
En 1989, l'OMS lance sa campagne pour l'élimination mondiale du tétanos néo-natal (voir ci-dessous).
Épidémiologie
Dans les pays développés
Le tétanos est en déclin dès le début du XXe siècle, sous l'influence de plusieurs facteurs[14] :
- l'urbanisation moderne et la mécanisation, qui tendent à supprimer la proximité de l'Homme avec les sols et les animaux, notamment les chevaux ;
- l'hygiène médicalisée de l'accouchement et du nouveau-né ;
- l'asepsie chirurgicale et le traitement moderne des plaies.
Autant de facteurs qui diminuent considérablement les risques d'exposition au tétanos, mais sans les supprimer. De fait, dans les années 1930, le tétanos représente encore en moyenne 1 à 3 cas pour 100 000 habitants et par an, le tétanos néo-natal, lui, étant déjà en voie de quasi-disparition.
L'arrivée de la vaccination généralisée, réellement appliquée à partir de 1950, accélère le processus. En France, l’incidence du tétanos est passée de 25 cas par million d’habitants en 1946[15], à moins de 0,15 cas par million d’habitants au cours des années 2012 à 2017[16].
Pour cette même période (2012-2017), 35 cas de tétanos ont été déclarés en France, dont 8 décès (létalité de 23 %). Les cas concernent principalement des personnes âgées (71 % avaient 70 ans ou plus) et des femmes (63 %). 3 cas avaient moins de 10 ans, tous nés et vivant en métropole (2 non vaccinés et 1 vacciné de façon incomplète). Des séquelles (difficultés motrices, complications musculaires et ostéo-articulaires) ont été signalées pour 12 patients (34 %), dont 2 des 3 enfants. Tous les cas dont le statut vaccinal a pu être documenté étaient non ou mal vaccinés[16].
En Europe de l’Ouest, seule l’Italie garde une incidence plus élevée que la France avec, en moyenne, une soixantaine de cas déclarés chaque année entre 2006 et 2015 (1 cas pour un million d’habitants)[16].
Le rôle de la vaccination se constate par la modification des catégories à risques. Au début du XXe siècle, le tétanos se voyait le plus souvent chez le jeune adulte. Depuis la vaccination, les cas de tétanos appartiennent surtout aux catégories suivantes : les personnes âgées, avec une prédominance féminine qui serait liée à l'absence des rappels du service militaire obligatoire des hommes de leur âge ; les immigrants en provenance de pays à faible politique vaccinale ; les usagers de drogue injectable, comme l'héroïne par exemple ; enfin, les personnes opposées à la vaccination et leurs enfants, pour des raisons religieuses ou socio-culturelles[14].
En quelque sorte, le tétanos résiduel des pays développés épouse en creux les insuffisances de la couverture vaccinale[14] - [15], notamment le manque de rappels. Si le tétanos devient de plus en plus rare, sa gravité entraîne systématiquement une hospitalisation prolongée en service de réanimation, avec une létalité élevée et des séquelles fréquentes[16].
Dans les pays en développement
Dans les années 1980, les décès par tétanos dans les pays en développement étaient estimés à un million par an, dont 80 % par tétanos néo-natal (défini par l'OMS comme tétanos survenant dans les 28 premiers jours de vie). Ceci représentait six décès pour 1 000 naissances vivantes.
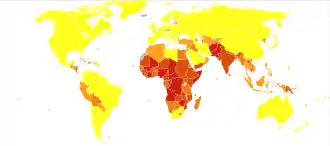
Les pays les plus touchés se situent sur la zone équatoriale de l'Afrique-Asie. Les cas surviennent de façon groupée dans des zones rurales, pauvres et isolées, dépourvues d'hygiène et sans accès à la vaccination, la mortalité pouvant dépasser 50 pour 1 000 naissances.
En 1989, l'OMS lance son appel en faveur de l'élimination mondiale du tétanos néonatal, puis en 1993 du tétanos maternel (défini par l'OMS comme tétanos de la femme enceinte et jusqu'à six semaines de l'accouchement), les deux réunis en tétanos maternel et néo-natal (TMN). Les moyens d'action s'articulent sur deux axes : vaccination des femmes en âge de procréer et stratégie des « trois propretés » — des mains, du cordon ombilical et de la table d'accouchement.
Cela concernait 90 pays, qui se donnent comme objectif d'éliminer le TMN en tant que problème de santé publique. L'élimination est certifiée pour un pays lorsqu'il atteint moins de un cas de TMN pour 1 000 naissances au niveau de tous les districts (définition de OMS : 3e niveau d'administration, apparemment l'équivalent du département en France)[17].
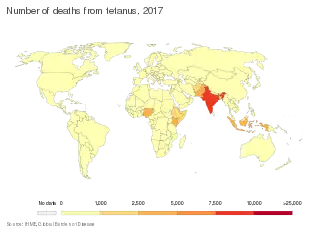
En 2002, le nombre mondial de décès est réduit à 180 000, mais ces bons résultats sont stagnants. Il reste encore 57 pays où moins de 60 % des femmes sont vaccinées et où moins de 50 % ont accès à l'hygiène de l'accouchement. Les difficultés sont nombreuses, malgré l'implication renforcée de l'UNICEF et d'autres organisations humanitaires. Les entraves sont les restrictions budgétaires, les difficultés d'accès (manque d'infrastructure, conflits armés…), l'opposition à la vaccination du fait qu'elle vise les jeunes femmes (rumeurs d'un vaccin contraceptif ou stérilisant)[11].
Depuis 2013, le nombre mondial de décès est passé sous la barre des 50 000, ce qui représente une réduction de 94 % en 20 ans. En 2017, 30 848 cas de TN sont notés dans le monde, contre un million deux décennies auparavant.
En 2019, le TMN reste encore un problème de santé publique dans 12 pays que sont : Afghanistan, Angola, République centrafricaine, Guinée, Mali, Nigeria, Pakistan, Papouasie-Nouvelle-Guinée, Somalie, Soudan, Soudan du Sud et Yémen[18] - [19].
En 2021, ces 12 pays n'ont toujours pas atteint le niveau minimum de couverture vaccinale (deux doses), de suivi de la grossesse, et de soins aux accouchées et nouveau-nés, qui devrait être d'au moins 80 % des femmes en âge de procréer (soit 107 millions de femmes). Les obstacles sur le chemin de l'élimination mondiale du TMN sont la fragilité et l'insuffisance des systèmes de santé, et des facteurs socio-économiques comme[20] :
- Femmes pauvres et peu éduquées en zone rurale : éloignement des centres de santé, transports indisponibles, interdit social (femme ne se déplaçant qu'avec la permission du mari, ou ne voulant pas voyager seule) ;
- crises humanitaires, conflits armés, déplacements de population… ;
- Autres priorités de santé : ces pays préfèrent utiliser leurs moyens vaccinaux contre les risques épidémiques (poliomyélite, rougeole…) .
La pandémie de COVID-19 perturbe la lutte contre le TMN en détournant ressources et moyens de santé (préventifs et de surveillance). Par exemple, sur les 12 pays, seuls le Nigéria et le Pakistan ont pu fournir des données sur les pratiques de soins du cordon ombilical, tandis que l'incidence réelle du tétanos néonatal devient plus difficile à déterminer[20].
Agent causal
Clostridium tetani (Bacillus tetani, ou bacille de Nicolaïer) est un bacille gram positif sporulant anaérobie strict. C'est une bactérie tellurique ubiquitaire, plus fréquente sous les tropiques que dans les pays tempérés ou froids[22]. Elle peut se présenter sous deux formes : la forme végétative active et la forme sporulée inactive (Plectridium tetani). Les deux formes se transforment l'une en l'autre, essentiellement selon la teneur en oxygène, mais aussi selon le pH, la température, et les conditions chimiques du milieu. La forme active apparaît en anaérobie, c'est-à-dire en absence ou pauvreté d'oxygène (moins de 5 %).
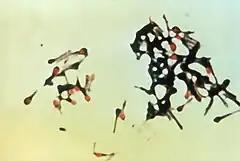
La forme sporulée (inactive) est très résistante, à la chaleur, à la dessiccation et aux désinfectants. Ces spores se trouvent dans le sol (réservoir naturel de la bactérie). Plus particulièrement dans les sols fertiles, en climat chaud et humide, riches en matières organiques comme les régions cultivées et de pâturage. À l'abri de la lumière solaire, elles peuvent survivre pendant des années. On peut les retrouver dans la poussière, sur les plantes (grains, fourrages, etc.), dans les selles animales et, à l'occasion, humaines[11].
La quantité de terre nécessaire et suffisante pour détecter la bactérie a été estimée à 1 mg[10]. Une faible quantité de terre contaminée dans une blessure est susceptible de provoquer un tétanos.
Lorsque ces spores sont avalées par un animal brouteur, elles résistent au processus de digestion, pour être rejetées à l'extérieur avec les selles. Leur germination et leur développement éventuel dans le tube digestif (conditions d'anaérobie en fin de côlon) reste une question discutée.
L'Homme entre accidentellement dans le cycle des deux formes, à l'occasion de plaies souillées. Si les circonstances sont favorables (tissus nécrotiques, corps étrangers, etc.), il se crée dans la plaie des micro-environnements pauvres en oxygène (anaérobie, faible potentiel d’oxydo-réduction). Les spores germent et reprennent leurs formes végétatives (bactéries pouvant libérer la toxine responsable de la maladie). Ces bactéries ne sont pas invasives (elles ne pénètrent pas dans l'organisme, ni ne s'y développent), elles restent localisées dans la plaie.
Mode de transmission
Toute effraction cutanée, même minime, contaminée par la terre, la poussière, les déjections animales peut être la porte d'entrée des spores tétaniques. Le plus souvent, dans la moitié des cas, il s'agit de plaies accidentelles : abrasions, lacérations, brûlures, piqûres, griffures, fracture ouverte, etc. Dans un tiers des cas, de plaies ou suppurations chroniques : ulcères de jambes, escarre dans les pays développés ou otite, infection dentaire dans les pays en développement.
Tout acte, médical ou pas, qui perce la peau ou les muqueuses avec des instruments mal stérilisés est susceptible de transmettre le tétanos. C'est particulièrement le cas des régions les plus pauvres des pays en développement (manque de moyens, ou pratiques traditionnelles) : injection, tatouages, scarifications, piercings, circoncision, excision, section du cordon ombilical, etc. L'accouchement et l'interruption de grossesse en mauvaise conditions hygiéniques sont aussi des portes d'entrées. Les circonstances sont innombrables, on a même décrit le tétanos par cure-dent[23].
Dans 10-15 % des cas, on ne retrouve pas de porte d'entrée, une plaie minime est passée inaperçue. Dans tous les cas, la présence de corps étrangers, de pus, de tissus nécrosés, favorise l'établissement des spores dans la plaie.
Pour qu'un tétanos se déclare, trois conditions sont nécessaires :
- une vaccination antitétanique absente ou incomplète ;
- une pénétration des spores dans l'organisme ;
- des conditions d'anaérobie au niveau de la plaie.
Physiopathologie
Depuis la plaie infectée, quand les conditions s'y prêtent, les spores prennent leur forme germinative. La bactérie se multiplie, élaborant deux toxines : la tétanolysine, qui n'entre pas en jeu lors des manifestations de la maladie (tout au plus, rôle d'initiation locale, favorisant l'installation des bactéries) et la tétanospasmine, une puissante neurotoxine, cause directe de la maladie.
La tétanospasmine est l'une des plus puissantes neurotoxines biologiques connues, avec une dose mortelle minimum de moins de 2,5 ng par kilogramme de poids, soit 175 milliardièmes de gramme pour un homme de 70 kg. C'est l'explication de la nature non immunisante de la maladie : une quantité infime de toxine, suffisante pour provoquer la maladie, ne l'est pas pour déclencher une production d'anticorps[24] - [25]. Il existe différentes tétanospamines (selon le type de clostridium tetani), mais elles sont identiques sur le plan antigénique, aussi une même antitoxine les neutralise toutes[22].
À l'intérieur des bactéries, durant leur phase de croissance, cette toxine est synthétisée comme une chaîne polypeptidique inactive. Elle est libérée lors de la mort de la bactérie (autolyse et éclatement des parois). Elle est activée en se transformant en une chaîne lourde liée à une chaîne légère. La chaîne lourde sert de moyen d'entrée et de transport dans les neurones (liaison aux récepteurs neuronaux et pénétration intracellulaire). La chaîne légère porte les propriétés toxiques. Pour les détails au niveau moléculaire, voir l'article détaillé
Cette toxine est d'abord circulante, une partie diffuse dans le muscle, pour se fixer sur les jonctions neuro-musculaires au niveau des terminaisons nerveuses les plus proches. L'autre partie emprunte la voie lymphatique et sanguine, se disséminant largement et y persister plusieurs jours[22], avant de pénétrer les neurones en divers sites.
La toxine qui pénètre les neurones moteurs est dite toxine fixée. En fait, elle chemine à l'intérieur du neurone, de façon rétrograde, à l'allure de 3 à 13 mm à l'heure, jusqu'au système nerveux central, en franchissant les espaces intersynaptiques. Arrivée à destination, la chaîne légère se détache pour bloquer la neurotransmission. Les muscles d'action opposée se désynchronisent, ce qui provoque spasmes et contractures. En plus du système moteur, la toxine agit sur le système autonome en bloquant les réflexes sympathiques des organes internes, ce qui représente une menace vitale.
L'action de la toxine dans les neurones peut persister pendant des semaines. Son action s'épuise d'elle-même et ses effets sont réversibles[26]. Les mécanismes de récupération restent encore mal compris[10] - [27].
Chez l'animal
Toutes les espèces animales sont susceptibles de présenter un tétanos, mais de façon très variable selon les espèces. Le tétanos est pratiquement inconnu chez les animaux à sang froid (poïkilothermes) qui sont les plus résistants. La grenouille, dans un environnement froid (de moins de 18 °C), est insensible à la toxine tétanique, mais devient susceptible à plus de 27 °C[28].
_(20690604576).jpg.webp)
En pratique, le tétanos existe surtout chez les mammifères, mais toujours avec une sensibilité variable selon les espèces. Les carnivores sont les plus résistants. Chez le chien le tétanos est lié le plus souvent à une plaie des pattes antérieures, avec contracture des muscles faciaux, difficultés respiratoires et hyperthermie. Les jeunes chiots présentent une forme plus sévère que les chiens les plus âgés. Près de la moitié des chiens survivants gardent des troubles du sommeil (spasmes musculaires, aboiement)[28].
Chez le chat, le tétanos se présente sous une forme locale et modérée (raideur en extension d'une patte), l'animal récupérant en quelques semaines[11] - [28].
Le cheval[29] et les primates sont les plus sensibles. Le taux de mortalité peut aller jusqu'à plus de 80 %. Les animaux survivants ont une convalescence de deux à six semaines. Aucune immunité ne se développe[11].

Le tétanos est commun chez le cheval non vacciné : les oreilles se dressent, les naseaux se dilatent, on observe une chute de la 3e paupière. L’animal transpire, il a des difficultés à avancer, à tourner et à reculer. Les spasmes généralisés s'accompagnent de problèmes cardiovasculaires et respiratoires. Dans les formes suraigües, la mort survient en un ou deux jours, sinon en une à trois semaines. Dans les formes modérées, le tétanos se limite à des contractures musculaires locales qui régressent en quelques semaines. Dans une série de 176 cas de tétanos, survenus chez le cheval en Europe de 2000 à 2014, le taux de mortalité était de 68,2 %[28].
Les pratiques d'élevage peuvent être source de tétanos (injections vétérinaires, ferrage ou écornage des sabots, pose d'anneaux, castrations, etc.) si elles ne sont pas faites dans des conditions d'asepsie. Chez les moutons, les chèvres et les porcs : le tétanos se manifeste par des troubles de la marche, une chute et un opisthotonos. Le tétanos est plus fréquent chez les agneaux et les porcelets (contamination lors de la section du cordon ombilical)[28].
Le tétanos expérimental de laboratoire touche rat, souris, cobaye et lapin. Les différences de sensibilité seraient dues à des variations de structure moléculaire des récepteurs nerveux, la toxine tétanique s'adaptant au mieux à ceux de l'Homme et du cheval[11].
Chez l'humain
Le diagnostic du tétanos est uniquement clinique. Les examens biologiques et complémentaires sont inutiles (aucune aide au diagnostic positif), sauf dans quelques cas douteux nécessitant un diagnostic différentiel.
La durée d'incubation de la maladie varie de 3 jours à 3 semaines (médiane 7 à 8 jours). Des durées plus courtes ou plus longues sont possibles. La durée d'incubation dépend de la situation du foyer infectieux initial par rapport au système nerveux central (l'incubation est plus longue pour une plaie au pied que pour une plaie à la tête).
Cette durée d'incubation est une indication de pronostic. Plus l'incubation est courte (moins de 7 jours), plus le tétanos sera sévère. Au-delà de 10 jours la forme sera d'autant plus modérée[11]. Il existe trois formes de tétanos[30] : le tétanos généralisé (touchant tout le corps, forme la plus grave, se produisant dans 80 % des cas), le tétanos localisé à un membre ou à un groupe musculaire, et le tétanos localisé à la tête (tétanos céphalique, atteinte des nerfs crâniens).
Début
Le premier signe est le spasme des muscles masticateurs, le trismus, ou l'impossibilité d'ouvrir la bouche par contraction invincible des mâchoires. Le test de l'abaisse-langue peut être utile dans les formes frustes ou débutantes : la paroi postérieure du pharynx est touchée avec un abaisse-langue. Chez l'individu non atteint, ceci déclenche un réflexe nauséeux. L'individu atteint, lui, va mordre l'abaisse-langue sans chercher à le recracher. Le trismus s'accompagne du « rictus sardonique », grimace caractéristique par contraction des muscles de la face. Chez les personnes âgées, le premier signe peut être une difficulté à avaler (dysphagie).
Généralisation
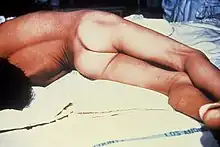
Puis la maladie se généralise selon un modèle descendant pour s'étendre à d'autres muscles : cou, thorax, dos, abdomen et extrémités. Des spasmes continus peuvent aboutir à l'opisthotonos, réalisant une hyper-extension de la nuque et du dos par contracture des muscles paravertébraux. Viennent ensuite les spasmes généralisés (membres supérieurs en flexion, membres inférieurs en extension), déclenchés par n'importe quel stimulus (bruit, lumière, toucher) ou survenant spontanément dans les formes graves. Avant l'ère de l'anesthésie-réanimation, les spasmes étaient extrêmement douloureux, le malade restant conscient[23] - [11].
Complications
La violence des spasmes peut se compliquer par des fractures, luxations, rhabdomyolyse. La contracture des sphincters peut entraîner une rétention aiguë d'urine et/ou fécale. Surinfection bactérienne, pneumonie d'inhalation, apparition d'escarres, embolie pulmonaire, déshydratation ou dénutrition surviennent surtout chez les sujets âgés ou fragilisés. La mort peut survenir par arrêt respiratoire (spasme de la glotte ou des muscles respiratoires) ou par atteinte des fonctions végétatives (hyper/hypothermie, hypertension artérielle/hypotension, arythmies cardiaques).
La guérison s'obtient après quelques jours ou plusieurs semaines.
Autres formes
Le tétanos localisé est très rare chez les humains. Les spasmes restent localisés à un groupe musculaire proche de la blessure initiale et peuvent durer plusieurs semaines avant de disparaître progressivement. L'extension à un tétanos généralisé est possible, mais de bon pronostic (moins de 1 % de mortalité).
Le tétanos céphalique fait suite à une infection ou plaie de la tête (notamment près de l'orbite ou sur le territoire du nerf facial). L'incubation est courte, l'extension à une forme généralisée est possible.
Le tétanos néo-natal

Il est dû à l'infection de la section du cordon ombilical. Il survient, dans 90 % des cas, du 3e au 14e jour de vie, principalement au 6e-8e jour. C'est un trait distinctif, car les autres causes de mortalité du nouveau-né apparaissent dès les deux premiers jours. Après une phase de deux jours au moins, où le nouveau-né tète et se comporte normalement, surviennent rapidement des pleurs incessants et une incapacité de téter, puis les spasmes se généralisent. Souvent, ce qui se déroule en jours chez l'adulte, se déroule en heures chez le nouveau-né[31] - [27].
Les survivants d'un tétanos néo-natal peuvent présenter des séquelles neurologiques : paralysie cérébrale, troubles psychomoteurs, troubles du comportement[32].
Diagnostic différentiel
Un trismus peut avoir de nombreuses causes : angine, abcès, troubles de l'articulation temporo-mandibulaire, infection des parotides, trouble neurologique autre que le tétanos, etc.
Le tétanos céphalique peut être confondu au début avec une paralysie faciale ou une névralgie du trijumeau.
La rage se distingue du tétanos par ses hallucinations, l'hydrophobie, agitation ou stupeur, et la notion de morsure animale.
Des situations métaboliques et toxiques peuvent ressembler au tétanos : la tétanie hypocalcémique (mais il n'y a pas de trismus), l'empoisonnement par la strychnine, l'intoxication aux phénothiazines (présence du toxique dans l'estomac, le sang ou les urines, selon le cas).
Chez les patients hystériques, l'observation un peu prolongée note des contractions cloniques (en secousses) ou des relâchements musculaires, plutôt que des spasmes toniques persistants (contractures permanentes)[33].
Prévention
Politiques vaccinales
L'expérience acquise par la médecine militaire au cours de la Seconde Guerre mondiale (voir l'historique) a permis de corriger et préciser les meilleures politiques vaccinales de chaque pays. À partir de 1965, l'OMS émet les premières recommandations internationales du vaccin antitétanique. D'abord les standards internationaux du produit vaccin (composition, formulation, etc.), puis ceux de la vaccination elle-même (doses, rappels, etc.). Les standards du produit ont été établis en 1965, et révisés en 1981 et 2000. Ces recommandations s'appliquent aux producteurs (privés ou publics), et en tant qu'utilisateurs, aux gouvernements et aux agences de l'ONU, comme l'UNICEF.
Les vaccins qui satisfont aux critères OMS sont dits « pré-qualifiés ». Chaque pays reconnaît un ou plusieurs « préqualifiés » pour les qualifier à son propre usage. Ces recommandations ne sont pas contraignantes, un pays comme les États-Unis peut imposer des critères plus stricts que ceux de l'OMS. Des pays en développement ont des difficultés à atteindre le minimum requis. Ainsi, dans les années 1990, il y avait 63 producteurs de vaccins répartis dans 42 pays, 22 producteurs locaux ne répondaient pas aux critères. En 2007, les producteurs fournissant les vaccin antitétaniques « pré-qualifiés » sont une douzaine, les deux premiers étant Sanofi Pasteur et GlaxoSmithKline[11].
L'OMS recommande un calendrier de vaccination antitétanique durant l'enfance de 5 doses. Les trois premières avant l'âge de 12 mois, plus deux rappels (entre 4 et 7 ans, entre 12 et 15 ans). Une 6e dose est recommandé chez le jeune adulte. Il s'agit de recommandations minimum. Ce calendrier est appliqué de diverses façons selon les pays, selon leur situation épidémiologique, leur histoire administrative et économique[17].
Ainsi la France a eu longtemps un calendrier de 6 doses durant l'enfance, plus un rappel tous les dix ans chez l'adulte. Depuis 2013, elle s'est alignée sur les recommandations de l'OMS avec 5 doses chez l'enfant. Les rappels chez l'adulte se faisant à l'âge de 25, 45 et 65 ans, puis tous les 10 ans.
Le 30 mars 2023, pour la diphtérie, le tétanos et la poliomyélite, la Haute Autorité de santé préconise que la vaccination DTP ne soit plus obligatoire chez les professionnels de santé mais fortement recommandée, sauf à Mayotte où elle devrait rester obligatoire. Le jour même le ministre de la Santé et de la Prévention, annonce se conformer immédiatement à la préconisation[34].
Efficacité
.jpg.webp)
Le vaccin antitétanique est considéré comme l'un des plus efficaces. L'efficacité sérologique (capacité à induire des anticorps protecteurs) est proche de 100 %, l'efficacité clinique et/ou de terrain (capacité à réduire l'incidence de la maladie) se situe entre 80 et 100 %[17].
Toutefois ces évaluations sont atténuées par deux sujets notables. Le premier concerne des échecs vaccinaux signalés lors des campagnes contre le tétanos néonatal dans les années 1990 au Bangladesh, où l'efficacité a chuté à moins de 50 %. Après discussion sur des causes administratives (défaut d'organisation) ou médicales (mauvais transfert des anticorps à travers le placenta, lié au paludisme ou au SIDA)[17] - [24], c'est la faible activité du vaccin, d'origine locale, qui a été mis en cause[11].
Le second concerne la question du « seuil protecteur », c'est-à-dire le taux d'anticorps nécessaire et suffisant pour garantir une protection. Celui-ci est obtenu à partir de données animales (souris, cobaye) extrapolées à l'Homme. À ces tests in vivo, s'ajoutent des tests in vitro (neutralisation, ELISA standards ou modifiés)[17]. Le « seuil protecteur » est une convention, établie par consensus, censé répondre à toutes les situations. Toutefois, des cas exceptionnels de tétanos chez des personnes correctement immunisées (au-dessus du seuil protecteur) ont été documentés[24]. Un tel risque est estimé à 4 pour 100 millions[35].
La durée de l'immunité (après le 2e rappel) était évaluée en moyenne à 10 ans (95 % des sujets protégés à 5 ans, 91 % à 10 ans, 60 % après 15 ans)[30]. Des études plus récentes suggèrent des durées beaucoup plus longues, avec une demi-vie des anticorps tétaniques de 11 ans, soit de 20 à 30 ans[17].
Effets secondaires
Le vaccin antitétanique est aussi considéré comme très sûr. Le plus souvent, il s'agit de manifestations locales mineures (douleur, rougeur transitoires). La fréquence et la gravité des réactions locales et générales augmentent avec l'âge et le nombre de rappels reçus. Les réactions générales bénignes (fièvre, douleur) apparaissent dans moins de 1 % des cas[17].
Les manifestations graves sont très rares, ce sont des réactions allergiques : anaphylaxie (1 à 6 cas par million de doses administrées), phénomène d'Arthus (réactions locales survenant chez des sujets hyperimmunisés), névrite brachiale (5 à 10 cas par million de doses).
Aucun lien n'a été trouvé avec le syndrome de Guillain-Barré, après une dizaine d'années de surveillance[36].
L'adjuvant aluminium, qui se retrouve dans de nombreux autres vaccins inactivés, peut entraîner une lésion histologique locale dite myofasciite à macrophages, mais le fait qu'elle puisse être la cause d'un ensemble de troubles non spécifiques reste controversé[37]. Des associations de patients[38] militent pour cette reconnaissance.
Prise en charge des plaies
L'objectif est de supprimer toute source potentielle de toxines. Selon l'importance de la plaie, on procède à sa mise à plat, ablation des corps étrangers, nettoyage et lavage, débridement (enlèvement des tissus morts), désinfection et parage. L'antibiothérapie n'est pas systématique, elle se fait en cas de plaie souillée, vue tardivement, avec délabrement important. L'évaluation de l'état immunitaire (à jour ou pas de ses vaccinations) se fait sur document médical ou par un test rapide (dosage des anticorps antitétaniques).
En situation de plaie mineure, propre, la vaccination est proposée aux personnes non à jour.
En situation de plaie majeure ou à risques (plaie étendue, pénétrante, avec corps étranger, vue tardivement), les personnes non à jour sont vaccinées dans un bras, et dans l'autre bras, immunoglobulines anti-tétaniques (250 UI IM en dose unique) dites aussi gammaglobulines. Elles assurent une protection immédiate (en 2 ou 3 jours, ce qui est suffisant par rapport à la durée d'incubation) et persistant plus de 4 semaines, le vaccin prenant le relais pour une protection différée mais de longue durée. Il s'agit là des recommandations françaises[39]. Les conduites à tenir peuvent varier selon les pays, mais les principes de bases restent les mêmes.
Depuis les années 1960, les gammaglobulines anti-tétaniques d'origine équine sont remplacées par des immunoglobulines d'origine humaine. Il s'agit d'un médicament dérivé du sang, obtenu à partir de fractionnement du plasma de sujets hyperimmunisés[40] - [41].
Pour prévenir le tétanos chez le nouveau-né, la vaccination maternelle doit être à jour pour permettre une immunisation passive par voie placentaire. Les instruments et autres produits pour la section du cordon ombilical doivent être stérilisés et l'antisepsie doit être respectée pour les soins du cordon.
En France, certains services d'urgence utilisent un test rapide de détection du seuil des anticorps pour une aide à la décision, dans le but d'éviter une prescription inutile (et coûteuse) de gammaglobulines. Cette procédure est en cours d'évaluation et, en 2016, elle n'a pas été intégrée dans les recommandations, ni généralisée à tous les services. Cette décision reste de la seule responsabilité des médecins seniors des urgences[42].
Traitement
Le traitement du tétanos déclaré a plusieurs objectifs : 1) supprimer la production de toxine si cela n'a pas été déjà fait (traitement des plaies), 2) neutraliser la toxine encore circulante, 3) contrôler les spasmes et soutenir le patient durant toute la durée de la maladie[11].
L’antibiothérapie vise à réduire la prolifération bactérienne au niveau de la plaie. La pénicilline G, le métronidazole ou la doxycycline sont les plus utilisés. Le métronidazole serait la meilleure option, mais son avantage ne serait que théorique (études contradictoires)[43].
L’administration d’immunoglobuline anti-toxine tétanique (sérothérapie) permet de neutraliser la toxine circulante qui n’a pas encore pénétré les neurones ; la posologie optimale et la meilleure voie d'administration (intramusculaire ou intrathécale) restent en discussion[11] - [43] - [44].
La clé du traitement est le contrôle des spasmes. Le patient doit d'abord être placé dans un environnement calme et sans lumière pour limiter au maximum les stimuli susceptibles de déclencher des séries de spasmes, il faut aussi éviter autant que possible de le manipuler. Pour le versant pharmacologique, les produits standards actuels sont les benzodiazépines : diazépam (Valium), midazolam. Ils ont l'avantage d'avoir des effets combinés : myorelaxant, anticonvulsif, anxiolytique et sédatif. D'autres produits peuvent être aussi utiles contre les spasmes, comme le sulfate de magnésium intraveineux, ou le baclofène en intrathécal[43].
Dans les formes graves ou prolongées, une ventilation mécanique peut être nécessaire, avec curarisation, intubation, voire trachéotomie. De même, il faut assurer l'hydratation et la nutrition (sonde naso-gastrique ou tube de gastrotomie). La maladie tétanos provoque une forte demande énergétique (contractions musculaires, transpiration) avec catabolisme accéléré[23].
La toxine a aussi des effets, difficiles à traiter, sur le système végétatif. Les bêta-bloquants, la clonidine, la morphine sont utilisés. Dans tous les cas, il faut prévenir toutes les complications inhérentes à une réanimation prolongée : infections nosocomiales, complications cardiovasculaires (thromboses, embolies…), ulcères de décubitus, etc[11].
La vitamine C en intraveineux pourrait réduire la mortalité chez l'animal, voire chez l'homme[45], mais cela n'a pas été confirmé, ce qui en fait une mesure qui ne peut être recommandée[46] ou qui est difficile à commenter[43].
Du point de vue de la médecine fondée sur les faits (EBM evidence-based medicine), il est difficile de juger les différentes modalités de traitement, pour des raisons logistiques et éthiques (on ne peut pas donner de placebo à un tétanique)[43]. Toutefois, c'est bien aux progrès des soins intensifs que l'on doit la réduction notable de la mortalité des tétanos déclarés.
Notes et références
- Thierry Bardinet, Les papyrus médicaux de l'Égypte pharaonique : traduction intégrale et commentaire, Fayard, , 590 p. (ISBN 978-2-213-59280-0), p. 222.
- Platon, Timée [détail des éditions] [lire en ligne], 84 e.
- « Arétée (de Cappadoce), Traité des signes, des causes et de la cure des maladies aiguës et chroniques », sur biusante.parisdescartes.fr.
- (en) Robert J.T. Joy, Tetanus, Cambridge University Press, , article « Tetanus », p. 1 045, dans The Cambridge World History of Human Disease, K.F. Kiple Editor.
- Alain Larcan, Le service de santé aux armées pendant la Première Guerre mondiale, Paris, LBM, , 596 p. (ISBN 978-2-915347-63-0), p. 341-342.
- Anne-Marie Moulin Edgar Relyveld (dir.) et Edgar Relyveld, L'aventure de la vaccination, Fayard, (ISBN 2-213-59412-0), chap. XVII (« Une histoire des anatoxines »), p. 251-253.
- (en) John R. Graham, « Notes on the treatement of tetanus », The New England Journal of Medicine, , p. 846-852.
- (en) « Tetanus in the United States Army in world war II », The New England Journal of Medicine, , p. 411-413.
- (en) « IMMUNIZATION TO TETANUS », sur history.amedd.army.mil (consulté le ).
- M.-R. Popoff, « Mode d'action des neurotoxines botuliques et tétaniques », Bulletin Académie Vétérinaire de France, no 3, (lire en ligne).
- (en) Steven G.F Wassilak, Tetanus toxoid, Philadelphie, Saunders Elsevier, , p. 806-814 dans S. Plotkin, Vaccines, 5e édition (ISBN 978-1-4160-3611-1, lire en ligne).
- (en) Sally McMillen, Tetanus Neonatal, Cambridge University Press, , dans The Cambridge World History of Human Disease, K.F. Kiple Editor, p. 1 046-1 049.
- Jacques Gelis, La sage-femme ou le médecin, une nouvelle conception de la vie, Fayard, , 560 p. (ISBN 978-2-213-01918-5).
- (en) M.H. Roper, Tetanus Toxoid, , 746-772 dans Plotkin, Vaccines. Saunders Elsevier. 6e édition.
- D. Antona, « Tétanos : de la nécessité du maintien d'une couverture vaccinale. », La Revue du Praticien, vol. 61, , p. 235-236.
- Denise Antona, « Le tétanos en France de 2012 à 2017 », Relevé épidémiologique hebdomadaire, no 42, , p. 828-833 (lire en ligne).
- OMS, « Vaccin antitétanique », Relevé épidémiologique hebdomadaire, no 20, , p. 200.
- (en) « Maternal and Neonatal Tetanus Elimination (MNTE) », sur OMS (consulté le ).
- (en) « Weekly Epidemiological Record », sur OMS, (consulté le ), p. 505–512.
- Nasir Yusuf, Azhar A Raza, Diana Chang-Blanc et Bilal Ahmed, « Progress and barriers towards maternal and neonatal tetanus elimination in the remaining 12 countries: a systematic review », The Lancet. Global Health, vol. 9, no 11, , e1610–e1617 (ISSN 2214-109X, PMID 34678200, PMCID 8551683, DOI 10.1016/S2214-109X(21)00338-7, lire en ligne, consulté le )
- Ministère de la Santé et des Services sociaux. MSSS - Sujets - Santé publique - Prévention et contrôle - Maladies à déclaration obligatoire (MADO). En ligne (page consultée le 23 août 2011).
- Rapport du Haut Conseil de Santé Publique, Immunisation post-exposition. Vaccinations et Immunoglobulines, , p. 55.
- (en) J.J. Farrar, « Tetanus », J. Neurol Neurosurg Psychiatry, no 69, .
- (fr + en) « Tetanus OMS 2006 », sur who.int, .
- (en) R. Borrow, The immunological basis for immunization series : module 3 Tetanus, WHO, (lire en ligne), paragraphe 2.1, page 3.
- Rapport HCSP février 2016, op. cit., p. 56.
- (en) Martha H. Roper, « Maternal and neonatal tetanus », Lancet, vol. 370, no 9 603, , p. 1947-59 (PMID 25149223, PMCID PMC5496662, DOI 10.1016/S0140-6736(14)60236-1).
- Michel R. Popoff, « Tetanus in animals », Journal of Veterinary Diagnostic Investigation : Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc, vol. 32, no 2, , p. 184–191 (ISSN 1040-6387, PMID 32070229, PMCID 7081504, DOI 10.1177/1040638720906814, lire en ligne, consulté le )
- Gwenaël Vourc'h et al., Les zoonoses : Ces maladies qui nous lient aux animaux, Éditions Quæ, coll. « EnjeuxScience », (ISBN 978-2-7592-3270-3, lire en ligne), Qui nous transmet quoi et comment ?, « Les chevaux », p. 69, accès libre.
- [PDF] « La vaccination contre le tétanos », Guide des vaccinations, éd. 2006 - Direction générale de la santé, Comité technique des vaccinations (CTV) - éd. INPES - p. 3-[267].
- [PDF] « Le tétanos », Les maladies à déclaration obligatoire (MDO), avril 2007 - Sur le site MedQual, p. 2-3.
- S.G.F. Wassilak, op. cit., p. 806.
- S.G.F. Wassilak, op. cit., p. 808.
- (en) Zvi Shimoni, « Tetanus in an immunised patient », British Medical Journal, no 319, , p. 1 049.
- (en) R. Baxter, « Recurrent Guillain-Barré Syndrome Following Vaccination », Clinical Infectious Diseases, .
- HCSP, « Aluminium et vaccins », sur hcsp.fr, , p. 19-22.
- Association d'Entraide aux Malades atteints de Myofasciite à Macrophages ou E3M
- « Avis relatif aux rappels de vaccination antitétanique dans le cadre de la prise en charge des plaies ». Haut Conseil de la Santé Publique. .
- « Fiche info - GAMMATETANOS 250 UI/2 ml, solution injectable (IM) - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- (en) Steven Wassilak, Tetanus toxoid, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), p. 808-809.dans Vaccines. Plotkin. 5e edition.
- Rapport HCSP, février 2016, op. cit., p. 59.
- (en) R. Chaturaka, « Pharmalogical management of tetanus : an evidence-based review », Critical Care, no 18:217, (lire en ligne).
- Elizabeth K. George, Orlando De Jesus et Renuga Vivekanandan, « Clostridium Tetani », dans StatPearls, StatPearls Publishing, (PMID 29494091, lire en ligne)
- (en) [PDF] Jahan K., Ahmad K., Ali MA., « Effect of ascorbic acid in the treatment of tetanus », Bangladesh Med Res Counc Bull, 1984 ; 10:24-8, .
- (en) Hemilä H., Koivula TT., « Vitamin C for preventing and treating tetanus », Cochrane Database Syst Rev, 2008 ; (i.e. (2)):CD006665, .
Voir aussi
Bibliographie
- (en) Apte N.M., Karnad D.R., « Short report: the spatula test: a simple bedside test to diagnose tetanus », Am J Trop Med Hyg, octobre 1995 ; 53(4): 386-7.
- (en) Centers for Disease Control and Prevention, « Epidemiology and Prevention of Vaccine-Preventable Diseases » par Atkinson W., Wolfe S., Hamborsky J., eds. 12th ed., second printing. Washington DC: Public Health Foundation, 2012.
- (en) Cook T.M., Protheroe R.T., Handel J.M., « Tetanus: a review of the literature, » Br J Anaesth, septembre 2001 ; 87(3): 477-87.
- Marc Gentilini, « Tétanos » dans Médecine Tropicale, Collection Médecine-Science, Flammarion, 6e édition, 2001.
- (en) Sanders R.K., « The management of tetanus 1996 » Trop Doct, juillet 1996 ; 26(3): 107-15.
Articles connexes
- Le tétanos (maladie professionnelle)
- Repère historique du tétanos, et description de la tétanospasmine
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- « Tétanos : Évaluation du risque » sur Urgences Online.
- Dossier « tétanos » sur le site de l'Institut de Veille Sanitaire, (InVS).
- (en) « Trends in Tetanus Epidemiology in the United States », 1972-2001, Center for Disease Control.
- [PDF] « Le traitement du tétanos en zone rurale d’Afrique de l’Est ».
- (en) « Tetanus », Emedicine.com.