Syndrome de Parsonage-Turner
Le syndrome de Parsonage-Turner (ou neuropathie brachiale aigüe, plexopathie brachiale aigüe, névralgie amyotrophiante de l'épaule, amyotrophie névralgique de l'épaule[1] est un syndrome neurologique, résultant d'une inflammation (ayant une composante probablement auto-immune), de cause inconnue du plexus brachial, mais il peut également toucher d'autres nerfs et racines. Il associe une douleur très intense, une amyotrophie et une faiblesse musculaire faisant suite à cette douleur[2]. L'affection est souvent désignée, dans les pays anglo-saxons par l’appellation neuralgic amyotrophy[3] et également Parsonage-Aldren-Turner syndrome, brachial neuritis (névrite brachiale), ou brachial plexitis (plexite brachiale).
| Spécialité | Neurologie |
|---|
![]() Mise en garde médicale
Mise en garde médicale
L'amyotrophie névralgique a un taux d'incidence présumé d'une personne sur 1000 chaque année. Avec un quart des cas concernant une récidive[3].
Chez la moitié environ des patients touchées, aucun évènement déclencheur n'est retrouvé[4] - [5], mais chez les autres, les contextes spécifiques suivant sont retrouvés : post-infection, post-vaccination, post-immunothérapie, post-intervention chirurgicale, grossesse ou accouchement, traumatisme ou détresse psychologique[3].
Description clinique
Le début est brutal avec une douleur aiguë, extrêmement intense et invalidante d'une épaule, irradiant souvent dans le bras, d'un seul côté, résistant à tous les antalgiques. Cependant la névralgie amyotrophiante peut toucher d'autres parties du corps que le plexus brachial. Des atteintes du nerf phrénique sont retrouvées dans 8% des cas et celles du plexus lombo-sacré dans 10 % des cas[3].
Cette douleur s'estompe spontanément dans un délai très variable selon les cas (une semaine à plusieurs années) pour faire place à une amyotrophie d'un ou plusieurs groupes musculaires de la ceinture scapulaire, du membre supérieur, ou de groupes musculaires d'autres membres atteints, selon les nerfs touchés. Une parésie plus ou moins prononcée des muscles est observée[2]. La faiblesse du muscle grand dentelé se traduit par un décollement de l'omoplate (« scapula alata » ou aile d'ange), un des signes caractéristiques de l'affection.
Diagnostic
Clinique
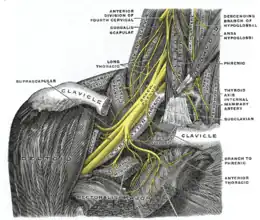
Il s'agit d'une neuropathie touchant principalement le plexus brachial, mais peut également toucher d'autres nerfs, associant une douleur aiguë suivie d'une paralysie flasque. Elle peut toucher différentes racines et nerfs : long thoracique, phrénique, supra-scapulaire, axillaire, radial, médian, interosseux antérieur ou postérieur, plexus lombaire, nerf fémoral, tronc lombo-sacré[3].
Signe du sablier : selon Sneag & al. (2019), une spécificité de ce syndrome semble être l'apparition, visible à l'IRM, d'une constrictions intrinsèques en forme de sablier des nerfs ou des faisceaux nerveux affectés, en phase aigüe (avant ou durant la 4e semaine) du SPT[6]. Cette constriction n'a pas été signalée dans d'autres neuropathies spontanées[7] - [6].
Examens complémentaires
Le diagnostic sera donc affirmé par l'électromyogramme qui pourra montrer une discordance entre une atteinte du contingent moteur et un contingent sensitif respecté, ceci au niveau d'un ou plusieurs nerfs du plexus brachial.
Une IRM peut aider au diagnostic[8] via une neurographie par résonance magnétique qui permettra de mettre en évidence des signes de dénervation musculaire.
Étiologie
Elle est encore mal comprise. Chez environ 50 % des personnes touchées, on ne retrouve pas d'événement déclencheur identifiable[4] - [5], mais chez les autres, quatre contextes facteurs de risque spécifiques sont identifiés[9] :
Quatre contextes facteur de risque
Ce sont, sous réserve de confirmation par des études plus approfondies[10] :
- les contextes postopératoire ;
- les contextes post-infectieux (ex : à la suite d'une hépatite E ou au SRAS-CoV-2[11] - [12], ou encore à une maladie de Lyme)[13] ; une infection par l'herpès simplex, le zona/varicelle, le virus d'Epstein-Barr, le cytomégalovirus, le VIH, le virus de l'hépatite B ont aussi été cités comme pouvant précéder l'amyotrophie névralgique[10] ;
- les contextes post-traumatiques (dont parfois à la suite d'un exercice physique intense, ou à la suite d'un tatouage[14]) ;
- les contextes post-vaccinaux (voir plus bas les sections Composantes immunitaires et vaccination).
Ce syndrome pourrait avoir trois types de composantes[4] :
Composantes environnementales ?
Ce syndrome fait partie des risques sanitaires induits par le tatouage (occurrence rare dans ce cas), mais on ignore si ce sont les colorants et/ou une infection associée qui sont en jeu dans ce cas[14] (origine infectieuse et/ou toxicologique ?).
Composantes immunitaires ?
Les vaccins à ARNm suscitent de fortes réponses à l'interféron de type I, qui induisent une inflammation et peuvent être associées à un risque accru de réactions auto-immunes[15].
Ces réactions pourrait passer par deux mécanismes connus pour être susceptibles d'apparaître après une infection (par exemple, l'hépatite E ou le SARS-CoV-2)[11] ou après une vaccination :
- le « mimétisme moléculaire » (une théorie voulant que parce que certains fragments de virus ressemblent à des fragments de tissu de l’organisme, le système immunitaire peut parfois attaquer (par erreur) ces parties de tissu de l’organisme, quand il cible aussi les fragments de virus ;
- l'« Effet du témoin » (« bystander effect » pour les anglophones) {{référence nécessaire}}.
la vaccination, parfois cause ou facteur déclenchant
Dans 4,3 % à 15,5 % des cas, le syndrome de SPT a été précédé par une vaccination (contre le tétanos le plus souvent, mais aussi contre la diphtérie ou la polio par exemple)[16] ou encore contre le virus du papillome humain, la grippe, le zona et l'encéphalite à tiques[17].
Quand il survient après une vaccination, le syndrome se manifeste le plus souvent dans les 28 jours suivant la vaccination, parfois dès le premier jour[5] {{référence nécessaire}}.
Le mécanisme et l'éventuel lien de cause a effet sont encore mal compris[4] - [5] - [16]. La névralgie amyotrophiante n'est pas une conséquence directe d'une atteinte d'un nerf par le vaccin car la version post-vaccinale (comme d'autres neuropathies périphériques) peut, souvent, commencer par se manifester du côté opposé à celui de l'injection[17]. Cependant une surveillance postérieure à la phase d'autorisation administrative est nécessaire, pour surveiller les effets indésirables rares qui n'ont peut-être pas été observés ou que très rarement pendant les essais cliniques[17].
En 2021, des cas de neuropathies périphériques (syndrome de Guillain-Barré notamment) sont aussi signalées après une vaccination contre la COVID-19, dans un premier temps sans preuves suffisantes d'un lien direct entre les vaccins et ces événements ; puis, aux États-Unis et en Europe, les organismes de réglementation ont révisé les étiquettes des vaccins Ad26.COV2.S de Johnson & Johnson et Vaxzevria d'AstraZeneca (tous deux à vecteur viral) pour intégrer le risque accru de syndrome de Guillain-Barré observé après vaccination[18].
Trois études au moins ont décrit un SPT (sans résultats d'imagerie)[19] - [20] - [21] - [22] - [23] - [24]), puis en 2022, une étude[17].
Traitement et prise en charge
En 2021, il n'existe pas encore de traitement spécifique approuvé pour cette affection d'étiologie encore très mal comprise.
Un diagnostic rapide et précis du SPT (souvent tardif dans la réalité) atténuera le stress du patient et orientera vers une prise en charge plus appropriée.
Le traitement est essentiellement symptomatique, visant à calmer la douleur par des antalgiques, et de pratiquer une rééducation par kinésithérapie et ergothérapie, de manière à favoriser la récupération musculaire ainsi que l'autonomie du patient pour les actes de la vie quotidienne.
- la prednisone (en prise orale précoce) peut réduire la durée et l'intensité des symptômes du SPT[25].
- pour les cas récalcitrants, la neurolyse chirurgicale a aussi montré une efficacité[26].
Pronostic
L'amyotrophie et la faiblesse peuvent persister sur une très longue durée, mais dans la plupart des cas l'évolution finit par être favorable, avec une récupération qui peut être complète.
Éponymie
Le syndrome doit son nom à deux neurologues britanniques, Maurice John Parsonage et John W. Aldren Turner[27].
Notes et références
- (en) Wheeless, Clifford R., « Parsonage-Turner Syndrome », Wheeless' Textbook of Orthopedics @ wheelessonline.com, (consulté le ).
- (en) « NINDS Brachial Plexus Injuries: Information Page », National Institute of Neurological Disorders and Stroke, last updated september 29, 2008 - see bottom of webpage) (consulté le ).
- (en-US) Jos IJspeert, Renske M. J. Janssen et Nens van Alfen, « Neuralgic amyotrophy », Current Opinion in Neurology, vol. 34, no 5, , p. 605 (ISSN 1350-7540, DOI 10.1097/WCO.0000000000000968, lire en ligne, consulté le )
- Nens van Alfen et Baziel G. M. van Engelen, « The clinical spectrum of neuralgic amyotrophy in 246 cases », Brain, vol. 129, no 2, , p. 438–450 (ISSN 1460-2156 et 0006-8950, DOI 10.1093/brain/awh722, lire en ligne, consulté le ).
- Peter Tsairis, « Natural History of Brachial Plexus Neuropathy », Archives of Neurology, vol. 27, no 2, , p. 109 (ISSN 0003-9942, DOI 10.1001/archneur.1972.00490140013004, lire en ligne, consulté le ).
- Darryl B. Sneag, Zsuzsanna Arányi, Esther M. Zusstone et Joseph H. Feinberg, « Fascicular constrictions above elbow typify anterior interosseous nerve syndrome », Muscle & Nerve, vol. 61, no 3, , p. 301–310 (ISSN 0148-639X et 1097-4598, DOI 10.1002/mus.26768, lire en ligne, consulté le ).
- Darryl B. Sneag, Eliana B. Saltzman, David W. Meister et Joseph H. Feinberg, « MRI bullseye sign: An indicator of peripheral nerve constriction in parsonage-turner syndrome », Muscle & Nerve, vol. 56, no 1, , p. 99–106 (ISSN 0148-639X, DOI 10.1002/mus.25480, lire en ligne, consulté le ).
- (en) William E. Brant et Clyde A. Helms, Fundamentals of diagnostic radiology, Lippincott Williams & Wilkins, , 1559 p. (ISBN 978-0-7817-6135-2, lire en ligne), p. 1–.
- (en) Joseph H. Feinberg et Jeffrey Radecki, « Parsonage-Turner Syndrome », HSS Journal, vol. 6, no 2, , p. 199–205 (ISSN 1556-3316 et 1556-3324, DOI 10.1007/s11420-010-9176-x, lire en ligne, consulté le ).
- (en) Maria A. Mitry, Lee K. Collins, J. Jacob Kazam et Shipra Kaicker, « Parsonage-turner syndrome associated with SARS-CoV2 (COVID-19) infection », Clinical Imaging, vol. 72, , p. 8–10 (PMID 33190028, PMCID PMC7654330, DOI 10.1016/j.clinimag.2020.11.017, lire en ligne, consulté le ).
- Maria A. Mitry, Lee K. Collins, J. Jacob Kazam et Shipra Kaicker, « Parsonage-turner syndrome associated with SARS-CoV2 (COVID-19) infection », Clinical Imaging, vol. 72, , p. 8–10 (ISSN 0899-7071, DOI 10.1016/j.clinimag.2020.11.017, lire en ligne, consulté le ).
- (en) Maria Beatrice Zazzara, Anna Modoni, Alessandra Bizzarro et Alessandra Lauria, « COVID-19 atypical Parsonage-Turner syndrome: a case report », BMC Neurology, vol. 22, no 1, , p. 96 (ISSN 1471-2377, PMID 35296278, PMCID PMC8924565, DOI 10.1186/s12883-022-02622-4, lire en ligne, consulté le ).
- Daniel Wendling, Philippe Sevrin, Agnès Bouchaud-Chabot et Aline Chabroux, « Parsonage–Turner syndrome revealing Lyme borreliosis », Joint Bone Spine, vol. 76, no 2, , p. 202–204 (ISSN 1297-319X, DOI 10.1016/j.jbspin.2008.07.013, lire en ligne, consulté le ).
- Steiner I, Farcas P, Wirguin I. (2000), Tatoo-related brachial plexopathies with adjacent muscle atrophy ; Ann Intern Med. juillet 2000 18;133(2):158-9
- Ans De Beuckelaer, Johan Grooten et Stefaan De Koker, « Type I Interferons Modulate CD8 + T Cell Immunity to mRNA Vaccines », Trends in Molecular Medicine, vol. 23, no 3, , p. 216–226 (ISSN 1471-4914, DOI 10.1016/j.molmed.2017.01.006, lire en ligne, consulté le ).
- Aline Hamati-Haddad et Gerald M. Fenichel, « Brachial Neuritis Following Routine Childhood Immunization for Diphtheria, Tetanus, and Pertussis (DTP): Report of Two Cases and Review of the Literature », Pediatrics, vol. 99, no 4, , p. 602–603 (ISSN 1098-4275 et 0031-4005, DOI 10.1542/peds.99.4.602, lire en ligne, consulté le ).
- (en) Sophie C. Queler, Alexander J. Towbin, Carlo Milani et Jeremy Whang, « Parsonage-Turner Syndrome Following COVID-19 Vaccination: MR Neurography », Radiology, vol. 302, no 1, , p. 84–87 (ISSN 0033-8419 et 1527-1315, PMID 34402669, PMCID PMC8488809, DOI 10.1148/radiol.2021211374, lire en ligne, consulté le ).
- (en) Office of the Commissioner, « Coronavirus (COVID-19) Update: July 13, 2021 », sur FDA, (consulté le ).
- Shalini Mahajan, Felicia Zhang, Arjun Mahajan et Simon Zimnowodzki, « Parsonage Turner syndrome after COVID‐19 vaccination », Muscle & Nerve, vol. 64, no 1, (ISSN 0148-639X et 1097-4598, DOI 10.1002/mus.27255, lire en ligne, consulté le ).
- Nicole Diaz‐Segarra, Arline Edmond et Courtney Gilbert, « Painless idiopathic neuralgic amyotrophy after COVID-19 vaccination: A case report », PM&R, (ISSN 1934-1482 et 1934-1563, DOI 10.1002/pmrj.12619, lire en ligne, consulté le ).
- J.A. Crespo Burillo, C. Loriente Martínez, C. García Arguedas et F.J. Mora Pueyo, « Amyotrophic neuralgia secondary to Vaxzevri (AstraZeneca) COVID-19 vaccine », Neurología (English Edition), vol. 36, no 7, , p. 571–572 (ISSN 2173-5808, DOI 10.1016/j.nrleng.2021.05.002, lire en ligne, consulté le ).
- Sadia Waheed, Angel Bayas, Fawzi Hindi et Zufe Rizvi, « Neurological Complications of COVID-19: Guillain-Barre Syndrome Following Pfizer COVID-19 Vaccine », Cureus, (ISSN 2168-8184, DOI 10.7759/cureus.13426, lire en ligne, consulté le ).
- Waqar Waheed, Magalie E. Carey, Sarah R. Tandan et Rup Tandan, « Post COVID‐19 vaccine small fiber neuropathy », Muscle & Nerve, vol. 64, no 1, (ISSN 0148-639X et 1097-4598, DOI 10.1002/mus.27251, lire en ligne, consulté le ).
- Shreena Umit Patel, Ruhaid Khurram, Anjali Lakhani et Bernadine Quirk, « Guillain-Barre syndrome following the first dose of the chimpanzee adenovirus-vectored COVID-19 vaccine, ChAdOx1 », BMJ Case Reports, vol. 14, no 4, , e242956 (ISSN 1757-790X, DOI 10.1136/bcr-2021-242956, lire en ligne, consulté le ).
- J J J van Eijk, N van Alfen, M Berrevoets et G J van der Wilt, « Evaluation of prednisolone treatment in the acute phase of neuralgic amyotrophy: an observational study », Journal of Neurology, Neurosurgery & Psychiatry, vol. 80, no 10, , p. 1120–1124 (ISSN 0022-3050, DOI 10.1136/jnnp.2008.163386, lire en ligne, consulté le ).
- Karthik R. Krishnan, Darryl B. Sneag, Joseph H. Feinberg et Ogonna K. Nwawka, « Outcomes of Microneurolysis of Hourglass Constrictions in Chronic Neuralgic Amyotrophy », The Journal of Hand Surgery, vol. 46, no 1, , p. 43–53 (ISSN 0363-5023, DOI 10.1016/j.jhsa.2020.07.015, lire en ligne, consulté le ).
- (en) Ole Daniel Enersen, « Notice biographique », sur Who Named It?.
Voir aussi
Articles connexes
Bibliographie
- (en) Spillane, JD, « Localised neuritis of the shoulder girdle. », The Lancet, vol. 242, no 6270, , p. 532–535 (DOI 10.1016/S0140-6736(00)72665-1)
- (en) Parsonage, MJ & Turner, A, « Neuralgic amyotrophy. The shoulder-girdle syndrome. », The Lancet, vol. 251, no 6513, , p. 973–978 (DOI 10.1016/S0140-6736(48)90611-4)