Vaccin à ARN
Un vaccin à ARN, ou vaccin à ARN messager, est un type de vaccin activant le système immunitaire adaptatif au moyen d'ARN messagers[1] dont la séquence nucléotidique code une protéine identique ou semblable à un antigène d'agent pathogène ou à un antigène tumoral (en). Cette protéine est produite directement dans les cellules cibles par traduction de l'ARN messager contenu dans le vaccin, et est reconnue par le système immunitaire de l'organisme, qui réagit en produisant des anticorps dirigés contre l'agent pathogène ou le cancer qu'on cherche à neutraliser. L'ARN messager peut être nu, c'est-à-dire délivré directement en solution, ou bien encapsulé (en) dans des nanoparticules lipidiques ; des virus à ARN sont également étudiés comme vecteurs possibles de vaccins à ARN.
Ce type de vaccins présente certains avantages sur les vaccins à ADN du point de vue de la fabrication, du mode d'administration aux patients et de la sécurité d'utilisation[2] - [3], et a pu montrer des effets prometteurs lors d'essais cliniques sur les humains[3]. Les vaccins à ARN pourraient également présenter un intérêt contre certains cancers[4]. Plusieurs laboratoires pharmaceutiques tels que CureVac et Moderna développent de tels vaccins, dont plusieurs depuis début 2020 contre la COVID-19. Le vaccin Tozinaméran, développé par BioNTech et Pfizer, a reçu le 2 décembre 2020 au Royaume-Uni la première autorisation pour l'utilisation grand public d'un vaccin à ARN de la part d'un organisme national de régulation des médicaments[5].
Production
Un vaccin à ARN est généralement fabriqué par transcription in vitro. L'ARN peut être injecté dans la cellule par transfection[6], électroporation[7] (électroperméabilisation), biolistique[8] ou transfert adoptif de cellules ex vivo[9]. La transfection peut être réalisée à l'aide de nanoparticules lipidiques[10] - [11], de peptides de pénétration cellulaire[12], de protéines et de polymères. On peut également utiliser des nanoparticules d'or d'environ 80 nm de diamètre[6] - [11] - [13]. Ces structures sont nécessaires pour favoriser l'absorption par les cellules de l'ARN, qui est instable in vivo[14]. L'ARN absorbé par transfection pénètre dans la cellule par endocytose médiée par des récepteurs[15] - [16]. L'absorption cellulaire en culture ne permet de présager que faiblement de l'absorption cellulaire in vivo et il n'y a aucune corrélation entre l'absorption en culture cellulaire et l'effet vaccinal observé in vivo[17], de sorte que ce dernier ne peut être évalué avant la phase d'essais cliniques[18].
Règlementation
Au sein de l'Union européenne, les vaccins à ARN luttant contre les maladies infectieuses sont considérés comme des médicaments biologiques et plus précisément comme des médicaments immunologiques au sens de la directive 2001/83/CE consolidée[19].
Mode d'action
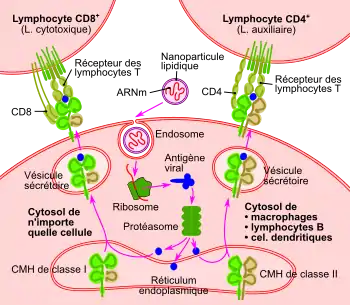
La production d'antigène dans le cytosol de la cellule conduit, après clivage par des protéases, à présenter les épitopes de l'antigène au complexe majeur d'histocompatibilité de classe I, qui active l'immunité cellulaire, et au complexe majeur d'histocompatibilité de classe II, qui active l'immunité humorale[20].
Un ARN messager peut être traduit en un nombre de protéines d'autant plus élevé que cet ARNm est stable. La demi-vie biologique d'un ARNm peut varier de quelques minutes, par exemple pour des protéines régulatrices, à quelques heures. Elle peut être allongée par la présence d'une coiffe à l'extrémité 5’, de régions non traduites 5'-UTR et 3'-UTR, et d'une queue Poly(A) qui retardent l'action des ribonucléases et augmentent donc la quantité d'antigène produite[6].
Une extension limitée de la demi-vie biologique, et donc de la quantité d'antigène produite, peut être obtenue à l'aide d'ARN auto-amplificateurs qui stimulent leur propre expression génétique[6] - [21] - [22]. Ceci doit permettre de réduire la quantité d'ARN utilisée pour la vaccination sans réduire l'effet vaccinal[23], 50 ng d'ARN ayant été décrits comme suffisants pour produire une vaccination effective[8].
Les ARN auto-amplificateurs étant sensiblement plus grands que les ARN messagers, le mécanisme d'absorption cellulaire de tels ARN peut être différent[1]. Des adjuvants peuvent améliorer la réponse immunitaire[24], et ces vaccins sont plus efficaces lorsqu'ils sont formulés avec l'adjuvant MF59 dans une nanoémulsion cationique ayant un diamètre de gouttelettes inférieur à 100 nm[25].
Modes d'administration
Les modes d'administration peuvent grossièrement être classés en ex vivo et in vivo selon que le transfert de l'ARNm aux cellules est réalisé respectivement à l'extérieur de l'organisme ou à l'intérieur de celui-ci.
Ex vivo
Les cellules dendritiques sont des phagocytes du système immunitaire qui présentent des antigènes sur leur membrane plasmique, d'où des interactions avec les lymphocyctes T qui déclenchent une réponse immunitaire. Il est possible d'introduire l'ARNm vaccinal dans les cellules dendritiques prélevées sur un patient puis de réinjecter ces cellules dendritiques ainsi modifiées pour qu'elles expriment l'antigène et sollicitent le système immunitaire afin de réaliser la vaccination[9].
In vivo
L'intérêt pour le mode d'administration in vivo croît progressivement depuis la découverte de l'expression in vivo d'ARN messagers transcrits in vitro après administration directe au patient[26]. Ces techniques présentent plusieurs avantages par rapport à l'administration ex vivo, principalement en évitant la collecte coûteuse des cellules dendritiques des patients et en imitant une infection par un agent infectieux. Il reste cependant plusieurs obstacles à franchir avant de pouvoir faire de cette approche un mode d'administration efficace et sûr. Il faut commencer par limiter la dégradation de l'ARN vaccinal par les ribonucléases destinées à protéger les cellules des acides nucléiques étrangers. Il faut ensuite permettre à l'ARN vaccinal de diffuser dans les cellules afin qu'il ne soit pas éliminé par les processus cellulaires avant d'avoir pu être traduit en antigène.
L'absorption d'ARNm est connue depuis 2007[15] - [16] et l'utilisation d'ARN comme vaccin a été découverte dans les années 1990 sous forme d'ARNm auto-amplificateur[27]. Il est apparu que les différentes voies d'injection (sous-cutanée, intraveineuse, intramusculaire, etc.) se traduisent par des niveaux d'absorption d'ARNm différents, ce qui fait du mode d'injection un choix déterminant de l'administration du vaccin. On a pu montrer que l'injection dans les ganglions lymphatiques conduisent à la réponse aux lymphocytes T la plus élevée[28]. L'administration des ARNm auto-amplificateurs peut cependant différer sensiblement de cette approche car ce sont en pratique des molécules bien plus grosses[1].
L'encapsulation de l'ARN messager dans des nanoparticules lipidiques est intéressante à plusieurs titres[10]. Tout d'abord, la couche lipidique protège l'ARN de la dégradation, ce qui accroît la quantité d'antigène produit. De plus, sa composition permet de cibler des cellules précises de l'organisme à l'aide de ligands. La mise au point de tels vaccins est cependant difficile, avec une absence de corrélation entre l'absorption cellulaire d'ARNm observée in vitro et celle observée in vivo[17]. Les nanoparticules peuvent être administrées et véhiculées dans l'organisme par différentes voies, comme la perfusion intraveineuse ou par le système lymphatique.
Vecteur viral
Outre les méthodes d'administration non virales, on a également modifié des virus à ARN pour induire un effet vaccinal. Les virus généralement utilisés à cette fin sont par exemple des rétrovirus, des lentivirus, des alphavirus et des rhabdovirus, chacun ayant ses spécificités[29]. Plusieurs essais cliniques ont employé de tels virus contre diverses maladies sur des modèles animaux tels que les souris, les poulets et les primates[30] - [31] - [32].
Avantages et risques par rapport aux vaccins à ADN
Par rapport aux vaccins à ADN, l'intérêt des vaccins à ARN est qu'ils sont traduits dans le cytosol des cellules, ce qui les dispense de devoir pénétrer dans les noyaux cellulaires et écarte le risque de voir leur matériel génétique être incorporé au génome de l'hôte[1] - [alpha 1]. Il est en outre possible d'optimiser le cadre de lecture ouvert (ORF) et les régions non traduites (UTR) des ARN messagers, par exemple en augmentant leur taux de GC[33] ou en sélectionnant des régions non traduites connues pour favoriser la traduction[34]. Un cadre de lecture ouvert supplémentaire peut également être ajouté pour fournir un mécanisme de réplication amplifiant la traduction en antigène, ce qui donne un ARN auto-amplificateur qui réduit la quantité initiale d'ARN nécessaire pour obtenir l'effet désiré[23].
Le principal risque des vaccins à ARN est celui du déclenchement d'une réponse immunitaire excessive par activation du système immunitaire inné[6] - [35]. La réponse immunitaire innée est activée par liaison de l'ARN aux récepteurs de type Toll, comme la protéine TLR7[36], à la protéine RIG-I (en) et la protéine kinase R (en)[37]. On atténue ce risque en concevant des ARN messagers ayant des séquences semblables à celles produites par les cellules de mammifères[38] et en introduisant, dans l'ARN messager, des nucléosides modifiés, comme la pseudouridine[39], la 5-méthylcytidine[39] ou des nucléosides 2’-O-méthylés[35] - [40] - [41] comme la 2’-O-méthyladénosine, ce qui a pour effet de limiter la réponse immunitaire contre cet ARN étranger, et donc de retarder sa dégradation, d'où un meilleur taux de traduction en antigène. On peut également optimiser les codons et utiliser certaines régions non traduites[37] - [42], ce qui ralentit également la dégradation de l'ARN. Par ailleurs, la présence de traces d'ARN bicaténaire contaminant les préparations d'ARNs produits in vitro peuvent déclencher une interférence par ARN, ce qui peut conduire à la dégradation prématurée de l'ARN vaccinal et réduire sa durée d'action[6], imposant une purification en plusieurs étapes[42] - [43]. L'ARN bicaténaire indésirable peut être éliminé par traitement à la RNAse III ou à moindre frais par adsorption sur la cellulose[44].
Certains vaccins à ARN peuvent également produire une forte réponse immunitaire avec des interférons de type I, associés à l'inflammation ainsi qu'à des manifestations auto-immunes, ce qui fait des personnes sujettes aux maladies auto-immunes des sujets potentiellement à risque pour ces vaccins[8].
Par ailleurs, l'ARN extracellulaire est connu pour être un facteur favorisant la coagulation sanguine[45] et augmentant la perméabilité de l'endothélium[46]. L'accroissement de la perméabilité endothéliale peut entraîner un œdème et stimuler la coagulation sanguine ce qui entraîne un risque de formation de thrombus, d'où des risques d'infarctus (notamment d'infarctus cérébral), de thrombose ou encore d'embolie pulmonaire. L'ARN qui se retrouve dans le sang est toutefois détruit très rapidement par des RNases et il n'est pas internalisé efficacement dans les cellules[47].
Essais cliniques
Contre la Covid-19
Plusieurs vaccins à ARN potentiels pour protéger du SARS-CoV-2 et de la COVID-19 sont étudiés depuis le début de l'année 2020.
- mRNA-1273 de Moderna — Le 16 mars 2020, le laboratoire américain Moderna lance un essai clinique pour son vaccin mRNA-1273, en collaboration avec le Vaccine Research Center (VRC) du National Institute of Allergy and Infectious Diseases (NIAID), institut des National Institutes of Health (NIH). Ce vaccin contient l'ARN messager de la protéine S avec laquelle les coronavirus se lient aux cellules épithéliales. L'ARN messager est intégré à des nanoparticules lipidiques (cholestérol, distéaroyl-phosphatidylcholine (DSPC) et DMG-PEG 2000), qui sont administrées par injection intramusculaire[48].
- Les cellules qui absorbent cet ARN messager produisent la protéine S du SARS-CoV-2. Celle-ci est reconnue comme corps étranger par le système immunitaire, qui stimule la formation d'anticorps protecteurs. Un essai clinique de phase 2 se déroule au printemps 2020 sur un grand nombre de sujets[49], la phase 3 avec des doses comprises entre 25 et 100 µg devant débuter en juillet selon le laboratoire[50].
- En , le médecin en chef de Moderna, Tal Zaks, déclare que « le public ne devrait pas « surinterpréter » les résultats des essais de vaccins et supposer que la vie pourrait revenir à la normale après la vaccination ».
- Les résultats des essais montrent que le vaccin peut empêcher une personne de tomber malade ou « gravement malade » du Covid-19, mais ne montrent pas que le vaccin empêche la transmission du virus[51].
- BNT162 de BioNTech — Le , l'Institut Paul Ehrlich (en) (PEI) approuve le premier essai clinique d'Allemagne pour un vaccin à ARN, le BNT162 de BioNTech[52]. Les types d'ARNm retenus sont l'ARNm contenant l'uridine (uRNA), l'ARNm à nucléosides modifiés (modRNA) et l'ARNm auto-amplificateur (saRNA) avec une forte immunogénicité. Les nanoparticules lipidiques (LNP) sont utilisées comme réactifs de transfection de l'ARNm. Ces nanoparticules lipidiques sont stables après l'injection et peuvent pénétrer dans les cellules avec l'ARNm[53]. Cet ARNm génère une forte réponse en anticorps et une forte réponse en lymphocytes T (CD8, CD4). L'essai clinique de phase 1 de BioNTech a débuté le 29 avril 2020[54].
- Pfizer et BioNtech partagent les résultats finaux de leur vaccin contre le coronavirus, BNT162b2, dans un communiqué de presse paru le . Selon la société pharmaceutique, BNT162b2 a démontré une efficacité supérieure à 90 % pour prévenir la Covid-19, sept jours après une seconde injection. Le communiqué de presse, qui n'est pas accompagné d'une publication scientifique des résultats, indique que la protection est atteinte 28 jours après la première immunisation et nécessite un seul rappel[55].
- CVnCoV de CureVac — CureVac a reçu le 17 juin 2020 l'accord de l'Institut Paul Ehrlich (en) (PEI) et de l'Agence fédérale des médicaments et des produits de santé (AFMPS) de Belgique pour l'essai clinique de phase 1 de son programme de vaccination pour la prévention du COVID-19. Le vaccin potentiel donne une réponse immunitaire équilibrée et conduit à la production de lymphocytes T reconnaissant les protéines S du SARS-CoV-2. L'essai clinique de phase 1 comprenait 168 volontaires sains âgés de 18 à 60 ans et couvrait une gamme de doses de 2 à 12 µg[56] - [57].
- En novembre 2020, le laboratoire a dévoilé les données provisoires de la première partie, montrant que son traitement « était généralement bien toléré pour toutes les doses testées » et induisait une forte réponse immunitaire. La biotech allemande a annoncé le 14 décembre 2020 avoir recruté le premier participant à l'essai clinique de phase 2b/3. Dernière étape avant une future demande d'autorisation d'utilisation conditionnelle, cette étude ne réunira pas moins de 35 000 participants, et sera menée principalement en Europe et en Amérique latine. Le dosage retenu pour cette dernière étude est de 12 microgrammes[58]. Une caractéristique du vaccin CureVac est qu’il utilise un ARN messager naturel, non modifié, pour déclencher une réponse immunitaire. Selon le patron de Curevac : Franz-Werner Haas, son produit nécessiterait également un dosage bien plus faible de seulement 12 microgrammes, contre 30 microgrammes pour BioNTech et 100 pour Moderna, permettant d’être fabriqué en masse plus rapidement[59].
- Par ailleurs, l'Imperial College London a lancé en juin 2020 l'essai d'une formulation d'ARN auto-amplificateur (saRNA) à nanoparticules lipidiques (LNP) nommé LNP-nCoVsaRNA[60]. Cette étude a reçu le soutien notamment du Medical Research Council et du National Institute for Health Research (en), tandis que le vaccin est produit pour la phase 1 par une société autrichienne[61].
- Selon les premiers résultats des études publiés le , l'efficacité du vaccin serait seulement de 47%[62]. Ceci est largement inférieure aux vaccins à ARNm de Pfizer-BioNTech et de Moderna[63]. Des spécialistes expliquent les résultats par l'utilisation d'une dose trop faible et de nucléotides naturels entrainant une dégradation trop rapide de l'ARN[64]. Le développement de ce vaccin a été interrompu[65].
Autres vaccins à ARN pour humains
D'autres vaccins à ARN sont à l'essai clinique contre des cancers[66] - [67] - [4] depuis 2008, contre la grippe[68] depuis 2018 et contre la rage[3] depuis 2009 (CV7201).
- Vaccin antigrippal — La recherche sur les vaccins antigrippaux à ARNm est soutenue dans l'Union européenne (UE) par des organismes tels que CORDIS, service d'information sur la recherche et le développement de l'UE[69], et par le projet UniVax[70], avec onze institutions de sept pays de l'UE[71]. Ces vaccins visent à la fois à bloquer la réplication virale dans les cellules infectées et à préparer le système immunitaire aux futurs variants du virus de la grippe[68].
- En 2022, une équipe de l’université de Pennsylvanie met au point une vaccin à ARNm immunisant contre les 20 souches connues du virus de la grippe A ou B. Les résultats cliniques sur souris et sur furets montrent l’acquisition d'une immunité contre les 20 souches pendant 4 mois[72] - [73].
- Vaccin antirabique — Ces vaccins utilisent de l'ARNm codant le principal antigène du virus de la rage, la glycoprotéine d'enveloppe dite protéine G. Des essais précliniques avec cet ARNm RABV encapsulé dans des nanoparticules lipidiques montrent que les souris et les primates non humains ont une meilleure réponse vaccinale. Ces résultats font actuellement l'objet d'un suivi dans des essais cliniques sur les humains[3].
- Vaccin anticancéreux — Le développement de tels vaccins n'en est qu'au début des essais cliniques. À partir d'un plasmide de production en ADN, l'ARNm est transcrit à l'aide d'ARN polymérases recombinantes avant d'être séparé, par un processus de purification en plusieurs étapes, de l'ADN, des produits de transcription trop longs, trop courts ou incorrects, ainsi que des nucléotides résiduels. Le potentiel de ces traitements exploratoires contre les cancers humains actuellement incurables reste à démontrer. Selon Steve Pascolo (chercheur à l'hôpital universitaire de Zurich) le 16 avril 2021, ils « donnent des résultats excellents, combinés à d'autres traitements »[74]. L'entreprise Transgene pense pouvoir mettre cette technologie à disposition à partir de 2026[75].
- En juin 2021, la société BioNTech a engagé les essais cliniques de phase II (première injection chez un patient) d'un vaccin à ARNm dirigé contre le mélanome[76]. Ce traitement en cours de développement est destiné à être administré en combinaison avec le cemiplimab à des patients présentant des mélanomes de stade 3 ou 4.
- Des recherches utilisent des nanoparticules lipidiques ayant la capacité de cibler des organes et des tissus spécifiques, en ciblant prioritairement les ganglions lymphatiques. En effet, les antigènes tumoraux ne sont pas aussi étranger à l'organisme que les antigènes viraux et le vaccin peut entrainer des réactions immunitaires causant, notamment dans le cas des premiers vaccins contre le mélanome, une inflammation du foie. Cette nouvelle approche, permet d'obtenir une forte réponse de lymphocytes T CD8+ contre la tumeur. Associé à un médicament pour éviter que les cellules cancéreuses n'inhibent la réponse immunitaire, ce traitement a permis la rémission de souris atteintes de mélanome métastatique avec une mémoire immunitaire durable contre les cellules tumorales[77] - [78].
- Vaccin contre le Zika — en phase d'essais[79].
Vaccins vétérinaires à ARN
- Vaccin contre influenza porcine - depuis 2018[81]
Réticence à la vaccination
Des campagnes de désinformation soutiennent que les vaccins à ARNm pourraient altérer l'ADN du noyau cellulaire[82]. En fait, l'ARNm présent dans le cytosol se dégrade très rapidement avant d'avoir le temps de pénétrer dans le noyau cellulaire. (On rappelle que les vaccins à ARNm doivent être conservés à très basse température pour éviter la dégradation de l'ARNm.) Un rétrovirus, qui peut lui aussi être constitué d'un ARN simple brin, pénètre dans le noyau cellulaire et utilise la transcriptase inverse pour y produire de l'ADN à partir de son ARN. Mais ce rétrovirus dispose de mécanismes spécifiques lui permettant d'entrer dans le noyau, alors que les ARNm vaccinaux n'ont pas ces mécanismes. À l'intérieur du noyau, la création d'ADN à partir d'ARN ne peut pas se produire sans une amorce, présente dans les rétrovirus, mais qui manquerait à l'ARNm vaccinal dans l'hypothèse où il serait rentré dans le noyau[83].
Notes et références
Notes
- L'ARN vaccinal ne doit pas davantage pénétrer dans les mitochondries, et n'a donc pas non plus d'interaction avec l'ADN mitochondrial.
Références
- (en) Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt et Heleen Dewitte, « Three decades of messenger RNA vaccine development », Nanotoday, vol. 28, , article no 100766 (DOI 10.1016/j.nantod.2019.100766, lire en ligne)
- (en) Steve Pascolo, « Vaccination With Messenger RNA », Methods in Molecular Medicine, vol. 127, , p. 23-40 (PMID 16988444, DOI 10.1385/1-59745-168-1:23, lire en ligne)
- (en) Nicole Armbruster, Edith Jasny et Benjamin Petsch, « Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies », Vaccines, vol. 7, no 4, , article no 132 (PMID 31569785, PMCID 6963972, DOI 10.3390/vaccines7040132, lire en ligne)
- (en) Megan A. McNamara, Smita K. Nair et Eda K. Holl, « RNA-Based Vaccines in Cancer Immunotherapy », Journal of Immunology Research, vol. 2015, , article no 794528 (PMID 26665011, PMCID 4668311, DOI 10.1155/2015/794528, lire en ligne)
- (en) Medicines and Healthcare products Regulatory Agency (en), « Vaccine BNT162b2 – Conditions of authorisation under Regulation 174, 2 December 2020 », sur https://www.gov.uk/, Gouvernement du Royaume-Uni, (consulté le ).
- (en) Cristina Poveda, Amadeo B. Biter, Maria Elena Bottazzi et Ulrich Strych, « Establishing Preferred Product Characterization for the Evaluation of RNA Vaccine Antigens », Vaccines, vol. 7, no 4, , p. 131 (PMID 31569760, PMCID 6963847, DOI 10.3390/vaccines7040131, lire en ligne)
- (en) Kate E. Broderick et Laurent M. Humeau, « Electroporation-enhanced delivery of nucleic acid vaccines », Expert Review of Vaccines, vol. 14, no 2, , p. 195-204 (PMID 25487734, DOI 10.1586/14760584.2015.990890, lire en ligne)
- (en) Norbert Pardi, Michael J. Hogan, Frederick W. Porter et Drew Weissman, « mRNA vaccines — a new era in vaccinology », Nature Reviews Drug Discovery, vol. 17, no 4, , p. 261-279 (PMID 29326426, PMCID 5906799, DOI 10.1038/nrd.2017.243, lire en ligne)
- (en) Daphné Benteyn, Carlo Heirman, Aude Bonehill, Kris Thielemans et Karine Breckpot, « mRNA-based dendritic cell vaccines », Expert Review of Vaccines, vol. 14, no 2, , p. 161-176 (PMID 25196947, DOI 10.1586/14760584.2014.957684, lire en ligne)
- (en) Andreas M Reichmuth, Matthias A Oberli, Ana Jaklenec, Robert Langer et Daniel Blankschtein, « mRNA vaccine delivery using lipid nanoparticles », Therapeutic Delivery, vol. 7, no 5, , p. 319-334 (PMID 27075952, PMCID 5439223, DOI 10.4155/tde-2016-0006, lire en ligne)
- (en) Itziar Gómez-Aguado, Julen Rodríguez-Castejón, Mónica Vicente-Pascual, Alicia Rodríguez-Gascón, María Ángeles Solinís et Ana del Pozo-Rodríguez, « Nanomedicines to Deliver mRNA: State of the Art and Future Perspectives », Nanomaterials, vol. 10, no 2, , p. 364 (DOI 10.3390/nano10020364, lire en ligne)
- (en) Vimal K. Udhayakumar, Ans De Beuckelaer, Joanne McCaffrey, Cian M. McCrudden, Jonathan L. Kirschman, Daryll Vanover, Lien Van Hoecke, Kenny Roose, Kim Deswarte, Bruno G. De Geest, Stefan Lienenklaus, Philip J. Santangelo, Johan Grooten, Helen O. McCarthy et Stefaan De Koker, « Arginine‐Rich Peptide‐Based mRNA Nanocomplexes Efficiently Instigate Cytotoxic T Cell Immunity Dependent on the Amphipathic Organization of the Peptide », Advanced Healthcare Materials, vol. 6, no 13, , article no 1601412 (PMID 28436620, DOI 10.1002/adhm.201601412, lire en ligne)
- (en) Thomas Démoulins, Pavlos C. Englezou, Panagiota Milona, Nicolas Ruggli, Nicola Tirelli, Chantal Pichon, Cédric Sapet, Thomas Ebensen, Carlos A. Guzmán et Kenneth C. McCullough, « Self-Replicating RNA Vaccine Delivery to Dendritic Cells », RNA Vaccines, vol. 1499, , p. 37-75 (PMID 27987142, DOI 10.1007/978-1-4939-6481-9_3, lire en ligne)
- (en) Stanley A. Plotkin et al., Plotkin's Vaccines, Elsevier, 7e éd., Philadelphie, 2017, p. 1297. (ISBN 978-0-323-35761-6)
- (en) J. Probst, B. Weide, B. Scheel, B. J. Pichler, I. Hoerr, H.-G. Rammensee et S. Pascolo, « Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent », Gene Therapy, vol. 14, no 15, , p. 1175-1180 (PMID 17476302, DOI 10.1038/sj.gt.3302964, lire en ligne)
- (en) Christina Lorenz, Mariola Fotin-Mleczek, Günter Roth, Christina Becker, Thanh Chau Dam, Wouter P. R. Verdurmen, Roland Brock, Jochen Probst et Thomas Schlake, « Protein expression from exogenous mRNA: Uptake by receptor-mediated endocytosis and trafficking via the lysosomal pathway », RNA Biology, vol. 8, no 4, , p. 627-636 (PMID 21654214, DOI 10.4161/rna.8.4.15394, lire en ligne)
- (en) Kalina Paunovska, Cory D. Sago, Christopher M. Monaco, William H. Hudson, Marielena Gamboa Castro, Tobi G. Rudoltz, Sujay Kalathoor, Daryll A. Vanover, Philip J. Santangelo, Rafi Ahmed, Anton V. Bryksin et James E. Dahlman, « A Direct Comparison of in Vitro and in Vivo Nucleic Acid Delivery Mediated by Hundreds of Nanoparticles Reveals a Weak Correlation », Nano Letters, vol. 18, no 3, , p. 2148-2157 (PMID 29489381, PMCID 6054134, DOI 10.1021/acs.nanolett.8b00432, lire en ligne)
- (en) Sarah E. McNeil, Anil Vangala, Vincent W. Bramwell, Peter J. Hanson et Yvonne Perrie, « Lipoplexes Formulation and Optimisation: In Vitro Transfection Studies Reveal No Correlation With in Vivo Vaccination Studies », Current Drug Delivery, vol. 7, no 2, , p. 175-187 (PMID 20158478, DOI 10.2174/156720110791011774, lire en ligne)
- (en) Guerriaud Mathieu and Kohli Evelyne, « RNA-based drugs and regulation: Toward a necessary evolution of the definitions issued from the European union legislation », Frontiers in Medicine, (lire en ligne
 )
) - (en) Thomas Kramps et Knut Elbers, « Introduction to RNA Vaccines », RNA Vaccines, vol. 1499, , p. 1-11 (PMID 27987140, DOI 10.1007/978-1-4939-6481-9_1, lire en ligne)
- (en) Alicia Rodríguez-Gascón, Ana del Pozo-Rodríguez et María Ángeles Solinís, « Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles », International Journal of nanomedicine, vol. 9, , p. 1833-1843 (PMID 24748793, PMCID 3986288, DOI 10.2147/IJN.S39810, lire en ligne)
- (en) Kenneth C. McCullough, Panagiota Milona, Lisa Thomann-Harwood, Thomas Démoulins, Pavlos Englezou, Rolf Suter et Nicolas Ruggli, « Self-Amplifying Replicon RNA Vaccine Delivery to Dendritic Cells by Synthetic Nanoparticles », Vaccines, vol. 2, no 4, , p. 735-754 (PMID 26344889, PMCID 4494254, DOI 10.3390/vaccines2040735, lire en ligne)
- (en) Annette B. Vogel, Laura Lambert, Ekaterina Kinnear, David Busse, Stephanie Erbar, Kerstin C. Reuter, Lena Wicke, Mario Perkovic, Tim Beissert, Heinrich Haas, Stephen T. Reece, Ugur Sahin et John S. Tregoning, « Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses », Molecular Therapy, vol. 26, no 2, , p. 446-455 (PMID 29275847, PMCID 5835025, DOI 10.1016/j.ymthe.2017.11.017, lire en ligne)
- (en) Małgorzata Anna Marć, Enrique Domínguez-Álvarez et Carlos Gamazo, « Nucleic acid vaccination strategies against infectious diseases », Expert Opinion on Drug Delivery, vol. 12, no 12, , p. 1851-1865 (PMID 26365499, DOI 10.1517/17425247.2015.1077559, lire en ligne)
- Luis A. Brito, Michelle Chan, Christine A Shaw, Armin Hekele, Thomas Carsillo, Mary Schaefer, Jacob Archer, Anja Seubert, Gillis R Otten, Clayton W Beard, Antu K Dey, Anders Lilja, Nicholas M Valiante, Peter W Mason, Christian W Mandl, Susan W Barnett, Philip R Dormitzer, Jeffrey B Ulmer, Manmohan Singh, Derek T O'Hagan et Andrew J Geall, « A cationic nanoemulsion for the delivery of next-generation RNA vaccines », Mol. Ther., vol. 22, no 12, , p. 2118-2129 (PMID 25027661, DOI 10.1038/mt.2014.133)
- (en) J. A. Wolff, R. W. Malone, P. Williams, W. Chong, G. Acsadi, A. Jani et P. L. Felgner, « Direct Gene Transfer Into Mouse Muscle in Vivo », Science, vol. 247, no 4949, , p. 1465-1468 (PMID 1690918, DOI 10.1126/science.1690918, Bibcode 1990Sci...247.1465W, lire en ligne)
- (en) X. Zhou, P. Berglund, G. Rhodes, S. E. Parker, M. Jondal et P. Liljeström, « Self-replicating Semliki Forest virus RNA as recombinant vaccine », Vaccine, vol. 12, no 16, , p. 1510-1514 (PMID 7879415, DOI 10.1016/0264-410x(94)90074-4, lire en ligne)
- (en) Sebastian Kreiter, Abderraouf Selmi, Mustafa Diken, Michael Koslowski, Cedrik M. Britten, Christoph Huber, Özlem Türeci et Ugur Sahin, « Intranodal Vaccination with Naked Antigen-Encoding RNA Elicits Potent Prophylactic and Therapeutic Antitumoral Immunity », Cancer Research, vol. 70, no 22, , p. 9031-9040 (PMID 21045153, DOI 10.1158/0008-5472.CAN-10-0699, lire en ligne)
- (en) Kenneth Lundstrom, « RNA Viruses as Tools in Gene Therapy and Vaccine Development », Genes, vol. 10, no 3, , p. 189 (PMID 30832256, PMCID 6471356, DOI 10.3390/genes10030189, lire en ligne)
- (en) Tiffany T. Huang, Shraddha Parab, Ryan Burnett, Oscar Diago, Derek Ostertag, Florence M. Hofman, Fernando Lopez Espinoza, Bryan Martin, Carlos E. Ibañez, Noriyuki Kasahara, Harry E. Gruber, Daniel Pertschuk, Douglas J. Jolly et Joan M. Robbins, « Intravenous Administration of Retroviral Replicating Vector, Toca 511, Demonstrates Therapeutic Efficacy in Orthotopic Immune-Competent Mouse Glioma Model », Human Gene Therapy, vol. 26, no 2, , p. 82-93 (PMID 25419577, PMCID 4326030, DOI 10.1089/hum.2014.100, lire en ligne)
- (en) Stacey Schultz-Cherry, Jody K. Dybing, Nancy L. Davis, Chad Williamson, David L. Suarez, Robert Johnston et Michael L. Perdue, « Influenza Virus (A/HK/156/97) Hemagglutinin Expressed by an Alphavirus Replicon System Protects Chickens against Lethal Infection with Hong Kong-Origin H5N1 Viruses », Virology, vol. 278, no 1, , p. 55-59 (PMID 11112481, DOI 10.1006/viro.2000.0635, lire en ligne)
- (en) Thomas W. Geisbert et Heinz Feldmann, « Recombinant Vesicular Stomatitis Virus–Based Vaccines Against Ebola and Marburg Virus Infections », The Journal of Infectious Diseases, vol. 204, no 3, , S1075-S1081 (PMID 21987744, PMCID 3218670, DOI 10.1093/infdis/jir349, lire en ligne)
- Grzegorz Kudla, Leszek Lipinski, Fanny Caffin et Aleksandra Helwak, « High Guanine and Cytosine Content Increases mRNA Levels in Mammalian Cells », PLoS Biology, vol. 4, no 6, (ISSN 1544-9173, PMID 16700628, PMCID 1463026, DOI 10.1371/journal.pbio.0040180, lire en ligne, consulté le )
- (en) Thomas Schlake, Andreas Thess, Mariola Fotin-Mleczek et Karl-Josef Kallen, « Developing mRNA-vaccine technologies », RNA Biology, vol. 9, no 11, , p. 1319-1330 (PMID 23064118, PMCID 3597572, DOI 10.4161/rna.22269, lire en ligne)
- (en) Katalin Kariko, Hiromi Muramatsu, János Ludwig et Drew Weissman, « Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA », Nucleic Acids Research, vol. 39, no 21, , article no e142 (PMID 21890902, PMCID 3241667, DOI 10.1093/nar/gkr695, lire en ligne)
- (en) Mariola Fotin-Mleczek, Katharina M Duchardt, Christina Lorenz, Regina Pfeiffer, Sanja Ojkić-Zrna, Jochen Probst et Karl-Josef Kallen, « Messenger RNA-based Vaccines With Dual Activity Induce Balanced TLR-7 Dependent Adaptive Immune Responses and Provide Antitumor Activity », Journal of Immunology, vol. 34, no 1, , p. 1-15 (PMID 21150709, DOI 10.1097/CJI.0b013e3181f7dbe8, lire en ligne)
- (en) Andreas Thess, Stefanie Grund, Barbara L Mui, Michael J Hope, Patrick Baumhof, Mariola Fotin-Mleczek et Thomas Schlake, « Sequence-engineered mRNA Without Chemical Nucleoside Modifications Enables an Effective Protein Therapy in Large Animals », Molecular Therapy, vol. 23, no 9, , p. 1456-1464 (PMID 26050989, PMCID 4817881, DOI 10.1038/mt.2015.103, lire en ligne)
- (en) « RNA vaccines: an introduction », PHG Foundation, université de Cambridge (consulté le ).
- (en) Luigi Warren, Philip D. Manos, Tim Ahfeldt, Yuin-Han Loh, Hu Li, Frank Lau, Wataru Ebina, Pankaj Mandal, Zachary D. Smith, Alexander Meissner, George Q. Daley, Andrew S. Brack, James J. Collins, Chad Cowan, Thorsten M. Schlaeger et Derrick J. Rossi, « Highly efficient reprogramming to pluripotency and directed differentiation of human cells using synthetic modified mRNA », Cell Stem Cell, vol. 7, no 5, , p. 618-630 (PMID 20888316, PMCID 3656821, DOI 10.1016/j.stem.2010.08.012, lire en ligne)
- (en) Katalin Karikó, Michael Buckstein, Houping Ni et Drew Weissman, « Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA », Immunity, vol. 23, no 2, , p. 165-175 (PMID 16111635, DOI 10.1016/j.immuni.2005.06.008, lire en ligne)
- (en) Norbert Pardi et Drew Weissman, « Nucleoside Modified mRNA Vaccines for Infectious Diseases », RNA Vaccines, vol. 1499, , p. 109-121 (PMID 27987145, DOI 10.1007/978-1-4939-6481-9_6, lire en ligne)
- (en) Norbert Pardi, Michael J. Hogan et Drew Weissman, « Recent advances in mRNA vaccine technology », Current Opinion in Immunology, vol. 65, , p. 14-20 (PMID 32244193, DOI 10.1016/j.coi.2020.01.008, lire en ligne)
- (en) Gundel Hager, « Nonclinical Safety Testing of RNA Vaccines », RNA Vaccines, vol. 1499, , p. 253-272 (PMID 27987155, DOI 10.1007/978-1-4939-6481-9_16, lire en ligne)
- (en) Markus Baiersdörfer, Gábor Boros, Hiromi Muramatsu, Azita Mahiny, Irena Vlatkovic, Ugur Sahin et Katalin Karikó, « A Facile Method for the Removal of dsRNA Contaminant from In Vitro-Transcribed mRNA », Molecular Therapy Nucleic Acids, vol. 15, , p. 26-35 (PMID 30933724, PMCID 6444222, DOI 10.1016/j.omtn.2019.02.018, lire en ligne)
- (en) Christian Kannemeier, Aya Shibamiya, Fumie Nakazawa, Heidi Trusheim, Clemens Ruppert, Philipp Markart, Yutong Song, Eleni Tzima, Elisabeth Kennerknecht, Michael Niepmann, Marie-Luise von Bruehl, Daniel Sedding, Steffen Massberg, Andreas Günther, Bernd Engelmann et Klaus T. Preissner, « Extracellular RNA constitutes a natural procoagulant cofactor in blood coagulation », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 15, , p. 6388-6393 (PMID 17405864, PMCID 1851071, DOI 10.1073/pnas.0608647104, JSTOR 25427387, Bibcode 2007PNAS..104.6388K, lire en ligne)
- (en) Silvia Fischer, Tibo Gerriets, Carina Wessels, Maureen Walberer, Sawa Kostin, Erwin Stolz, Kirila Zheleva, Andreas Hocke, Stefan Hippenstiel et Klaus T Preissner, « Extracellular RNA mediates endothelial-cell permeability via vascular endothelial growth factor », Blood, vol. 110, no 7, , p. 2457-2465 (PMID 17576819, DOI 10.1182/blood-2006-08-040691, lire en ligne)
- (en) Norbert Pardi, Michael J. Hogan, Frederick W. Porter et Drew Weissman, « mRNA vaccines — a new era in vaccinology », Nature Reviews Drug Discovery, vol. 17, no 4, , p. 261–279 (ISSN 1474-1784, DOI 10.1038/nrd.2017.243, lire en ligne, consulté le )
- (en) « Safety and Immunogenicity Study of 2019-nCoV Vaccine (mRNA-1273) for Prophylaxis of SARS-CoV-2 Infection (COVID-19) », ClinicalTrials.gov, (consulté le ).
- (en) « Dose-Confirmation Study to Evaluate the Safety, Reactogenicity, and Immunogenicity of mRNA-1273 COVID-19 Vaccine in Adults Aged 18 Years and Older », ClinicalTrials.gov, (consulté le ).
- (en) « Moderna Announces Positive Interim Phase 1 Data for its mRNA Vaccine (mRNA-1273) Against Novel Coronavirus », Moderna Therapeutics, (consulté le ).
- https://www.businessinsider.fr/le-medecin-en-chef-de-moderna-avertit-que-le-vaccin-nempechera-pas-la-transmission-du-virus-185911
- (de) « Erste klinische Prüfung eines COVID-19-Impfstoffs in Deutschland genehmigt », Institut Paul Ehrlich (en), (consulté le ).
- (de) « Hintergrundinformationen zur Entwicklung von SARS-CoV-2-Impfstoffen anlässlich der Genehmigung der ersten klinischen Prüfung eines SARS-CoV-2-Impfstoffs in Deutschland » [PDF], Institut Paul Ehrlich (en), (consulté le ).
- (en) « Study to Describe the Safety, Tolerability, Immunogenicity, and Potential Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults », ClinicalTrials.gov, (consulté le ).
- https://www.futura-sciences.com/sante/actualites/coronavirus-covid-19-efficacite-vaccin-pfizer-finalement-95-84089/
- (en) « CureVac Receives Regulatory Approval from German and Belgian Authorities to Initiate Phase 1 Clinical Trial of its SARS-CoV-2 Vaccine Candidate », CureVac, (consulté le ).
- (en) CureVac AG, « COVID-19: A Phase 1, Partially Blind, Placebo-controlled, Dose Escalation, First-in-human, Clinical Trial to Evaluate the Safety, Reactogenicity and Immunogenicity After 1 and 2 Doses of the Investigational SARS-CoV-2 mRNA Vaccine CVnCoV Administered Intramuscularly in Healthy Adults », ClinicalTrials.gov (essai clinique), no NCT04449276, (lire en ligne, consulté le )
- « Covid : CureVac enclenche la dernière étape des essais pour son vaccin », sur Les Echos, (consulté le )
- AFP, « COVID-19: devancé par ses concurrents, CureVac mise sur un vaccin «plus facile» », sur Le Journal de Montréal (consulté le )
- (en) Ryan O'Hare, « First volunteer receives Imperial COVID-19 vaccine », Imperial College London, (consulté le ).
- (en) « Reference Projects », Polymun Scientific, (consulté le ).
- « Covid-19 : Premiers résultats décevants pour le candidat vaccin de CureVac sur lequel l’UE misait », 20 Minutes, (lire en ligne)
- « Le vaccin de CureVac obtient des résultats décevants », Le Temps, (ISSN 1423-3967, lire en ligne, consulté le )
- « Covid : pourquoi le vaccin de CureVac n'est-il pas aussi efficace que les autres vaccins à ARN messager ? », sur Sciences et Avenir, (consulté le )
- Zuzanna Szymanska et Ludwig Burger, « CureVac drops COVID-19 vaccine, pins hope on next-generation shots », Reuters, (lire en ligne, consulté le )
- (en) Benjamin Weide, Jean-Philippe Carralot, Anne Reese, Birgit Scheel, Thomas Kurt Eigentler, Ingmar Hoerr, Hans-Georg Rammensee, Claus Garbe et Steve Pascolo, « Results of the First Phase I/II Clinical Vaccination Trial With Direct Injection of mRNA », Journal of Immunotherapy, vol. 31, no 2, , p. 180-188 (PMID 18481387, DOI 10.1097/CJI.0b013e31815ce501, lire en ligne)
- (en) Benjamin Weide, Steve Pascolo, Birgit Scheel, Evelyna Derhovanessian, Annette Pflugfelder, Thomas K. Eigentler, Graham Pawelec, Ingmar Hoerr, Hans-Georg Rammensee et Claus Garbe, « Direct Injection of Protamine-Protected mRNA: Results of a Phase 1/2 Vaccination Trial in Metastatic Melanoma Patients », Journal of Immunotherapy, vol. 32, no 5, , p. 498-507 (PMID 19609242, DOI 10.1097/CJI.0b013e3181a00068, lire en ligne)
- (en) Francesco Berlanda Scorza et Norbert Pardi, « New Kids on the Block: RNA-Based Influenza Virus Vaccines », Vaccines, vol. 6, no 2, , p. 20 (PMID 29614788, PMCID 6027361, DOI 10.3390/vaccines6020020, lire en ligne)
- (en) « A “Universal” Influenza Vaccine through Synthetic, Dendritic Cell-Targeted, Self-Replicating RNA Vaccines », CORDIS, (consulté le ).
- (en) « UniVax's overall goal », UniVax (consulté le ).
- (en) « UniVax, a “Universal” Influenza Vaccine through Synthetic, Dendritic Cell-Targeted, Self-Replicating RNA Vaccines », sur UniVax (consulté le ).
- https://www.liberation.fr/sciences/biologie/grippe-un-vaccin-universel-grace-a-larn-messager-20221129_Y2LBPXTIYZF6DPGDJL44TW742M/
- DOI 10.1126/science.abm0271
- « "On aura bientôt des vaccins à ARN messager anti-cancer", affirme un chercheur », sur Franceinfo, (consulté le )
- « Un vaccin contre le cancer pourrait voir le jour d'ici à 2026 », sur LCI (consulté le )
- Un premier patient a reçu le vaccin contre le cancer de BioNTech
- « Cancer : un nouveau vaccin à ARNm élimine les tumeurs et prévient les récidives chez la souris », sur Trust My Science, (consulté le )
- https://now.tufts.edu/2022/08/15/new-targeted-cancer-vaccines-eliminate-tumors-and-prevent-recurrence-mice
- Jean-Daniel Lelièvre, « Les vaccins de demain », Revue Francophone des Laboratoires, vol. 2019, no 512, , p. 52-63 (PMID 32518603, PMCID 7270526, DOI 10.1016/S1773-035X(19)30258-8, lire en ligne)
- Marcus Dupont-Besnard, « Moderna démarre un essai clinique pour son vaccin ARNm contre le VIH », sur numerama.com, (consulté le ).
- Agence canadienne d'inspection des aliments Gouvernement du Canada, « Évaluation environnementale des produits sur ordonnance contenant des particules d'ARN de Merck Animal Health pour l'influenza porcine et d'autres agents pathogènes », sur www.inspection.gc.ca, (consulté le )
- David Grimm, « Podcast: A debunked dragon, progress toward a universal flu vaccine, and more », Science, (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.aad1679, lire en ligne, consulté le )
- .Skalka AM (2014), « "Retroviral DNA Transposition: Themes and Variations" », Microbiology Spectrum. 2 (5): 1101–23. doi:10.1128/microbiolspec.MDNA3-0005-2014,
Voir aussi
Bibliographie
- Ouvrages
- Fabrice Delaye (préf. Patrick Aebischer), La révolution de l'ARN messager : Vaccins et nouvelles thérapies, Paris, Éditions Odile Jacob, , 206 p. (ISBN 978-2-4150-0057-8, présentation en ligne).
- Articles
- Elie Dolgin, « La révolution des vaccins à ARN », Pour la science, no 522, , p. 22-28
- Bruno Pitard, « Les vaccins à ARN ouvrent une voie thérapeutique puissante », Pour la science, no 522, , p. 30-35
- Elie Dolgin, « Les vaccins à ARN changent la donne », Pour la science, hors-série no 113, , p. 18-25
Articles connexes
- Katalin Karikó
- ARN messager à nucléosides modifiés (en), mis au point par Katalin Karikó et Drew Weissman