Transfert adoptif de cellules
Le transfert adoptif de cellules consiste à transférer des cellules dans un hôte, afin de faire bénéficier ce dernier de leurs fonctions immunitaires[1]. Le transfert adoptif est actuellement une stratégie d'immunothérapie extrêmement prometteuse notamment dans les programmes de lutte contre le cancer[2]. En effet, l'efficacité du transfert adoptif de lymphocytes T a été montré dans certains cancers dont le mélanome métastatique, avec une régression tumorale observée chez 50 % des patients[2]. De fait, et plus que dans tout autre type d'immunothérapie, le transfert adoptif permet de traiter le patient à l'aide de son propre système immunitaire, en le renforçant seulement selon diverses possibilités.
Le transfert de cellules génétiquement modifiées avec un récepteur antigénique chimérique (CAR) pour le traitement du cancer a été parmi les premières techniques de thérapie génique humaine à démontrer une efficacité thérapeutique généralisée[3].
Historique
Les premiers essais concluants de transferts adoptifs ont été réalisés par l'équipe de Rosenberg dans les années 1980, avec des lymphocytes tumoraux récupérés chez des patients souffrant de mélanome. Ces cellules prélevées ont été mises en contact in vitro avec de l'IL-2 puis ré-injectées aux patients, mais si la méthode a donné de bons résultats dans le mélanome, ce ne fut pas le cas pour d'autres types de cancers[4]. En 2001, l'équipe de Rosenberg suggère que l'utilisation de clones de lymphocytes T spécifiques d'épitopes tumoraux (tels que Melan-A[5] ou MELOE-1[6]) pourrait améliorer considérablement l'activité des cellules T récupérées.
Procédé
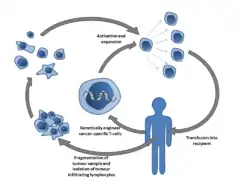
- Les cellules immunitaires du patient, en particulier les lymphocytes T, sont récupérées. Ces cellules peuvent être des cellules issues du sang et sont récupérées par centrifugation sur gradient de densité sur ficoll, par exemple ; bien souvent, ce sont des cellules immunitaires recueillies au sein du site tumoral : un prélèvement par biopsie réalisé sur le site tumoral permettra de recueillir un échantillon contenant des cellules tumorales et parmi ces dernières, des cellules immunitaires choisies, en particulier des lymphocytes T CD8+, avec une récupération par tri magnétique. En effet, ces lymphocytes forment une sous-population de choix en raison de leurs puissantes activités cytolytiques, associées à des capacités de reconnaissance et de ciblage précis de populations cellulaires tumorales (ce qui n'est pas le cas avec des cellules NK par exemple, ayant une activité cytolytique mais non spécifique)[7].
- Les cellules immunitaires recueillies, très souvent des lymphocytes T, sont ensuite manipulées dans des laboratoires spécifiques conçus pour la réalisation de transferts adoptifs. Plusieurs programmes peuvent être possibles dès lors : les cellules peuvent être tout simplement multipliées : l'ajout d'interleukine 2 dans le milieu de culture contenant les cellules T recueillies pourra par exemple permettre leur prolifération. Des projets plus complexes et plus ambitieux peuvent également être envisagés, toujours en cours de recherche au sein de différentes équipes. Par exemple, la présentation d'antigènes tumoraux puissamment immunogéniques aux cellules T recueillies peut permettre de générer des cellules T spécifiques d'un antigène tumoral. D'autres projets, comme la manipulation du génome du lymphocyte afin de pouvoir "éduquer" celui-ci à une reconnaissance plus aisée et plus rapide, permettant une action plus efficace, des cellules tumorales par le lymphocyte.
- Quel que soit le programme effectué précédemment, la population de lymphocytes T ré-éduqués, manipulés ou simplement ayant proliféré en laboratoire, sera ré-injectée au patient qui a fourni ces lymphocytes. Ces cellules immunitaires peuvent être directement placées dans le site tumoral pour faciliter leur action, par exemple.
Applications
Récepteur antigénique chimérique
La grande majorité des thérapies abordées à ce jour ont été utilisées pour traiter des cancers. Par exemple, le succès de la thérapie CAR-T anti-CD19 dans les essais cliniques de phase 1 et 2 pour les cancers tels que le lymphome, la leucémie et le neuroblastome semble se diriger vers l'autorisation de l'administration des aliments et drogues américaine (FDA)[3] - [8].
Le transfert adoptif de lymphocytes a été utilisé expérimentalement pour traiter les patients atteints de tumeurs solides avancées, y compris le mélanome, y compris récidivant et réfractaire, et le cancer du col de l'utérus, le cancer du poumon, le cancer du sein, le sarcome[9], y compris la leucémie lymphoblastique aiguë[10].
Maladie auto-immune
Le transfert de cellules T régulatrices a été utilisé pour traiter le diabète de type 1 et d'autres maladies auto-immunes[11]. Les thérapies avec des cellules-T CAR ont montré leur intérêt pour traiter la sclérose en plaques chez la souris avec une diminution des symptômes[3].
Notes et références
- Olivier Michielin, Serge Leyvraz, Julien Laurent, Jean-Philippe Cerottini, David Guggisberg, Nathalie Rufer, Daniel Speiser et Pedro Romero, « Nouveautés dans l’immunothérapie du cancer », Revue médicale suisse, vol. 4, no 158, , p. 1248-51 (ISSN 1660-9379, PMID 18616206, lire en ligne)
- Steven A. Rosenberg, Nicholas P. Restifo, James C. Yang et Richard A. Morgan, « Adoptive cell transfer: a clinical path to effective cancer immunotherapy », Nature reviews. Cancer, vol. 8, no 4, , p. 299–308 (ISSN 1474-175X, PMID 18354418, PMCID PMC2553205, DOI 10.1038/nrc2355, lire en ligne, consulté le )
- Olivia Wilkins, Allison M. Keeler et Terence R. Flotte, « CAR T-Cell Therapy: Progress and Prospects », Human Gene Therapy Methods, vol. 28, no 2, , p. 61–66 (ISSN 1946-6536, DOI 10.1089/hgtb.2016.153, lire en ligne, consulté le )
- Rosenberg, Steven A.; Restifo, Nicholas P. (April 3, 2015). "Adoptive cell transfer as personalize immunotherapy for human cancer". Science. 348 (6230): 62–68. doi:10.1126/science.aaa4967.
- Virginie Vignard, Brigitte Lemercier, Annick Lim et Marie-Christine Pandolfino, « Adoptive transfer of tumor-reactive Melan-A-specific CTL clones in melanoma patients is followed by increased frequencies of additional Melan-A-specific T cells », Journal of Immunology (Baltimore, Md.: 1950), vol. 175, no 7, , p. 4797–4805 (ISSN 0022-1767, PMID 16177129, lire en ligne, consulté le )
- Mathilde Bobinet, Virginie Vignard, Anne Rogel et Amir Khammari, « MELOE-1 antigen contains multiple HLA class II T cell epitopes recognized by Th1 CD4+ T cells from melanoma patients », PloS One, vol. 7, no 12, , e51716 (ISSN 1932-6203, PMID 23284752, PMCID PMC3527452, DOI 10.1371/journal.pone.0051716, lire en ligne, consulté le )
- (en) Carl H. June, « Principles of adoptive T cell cancer therapy », The Journal of Clinical Investigation, vol. 117, no 5, (ISSN 0021-9738, PMID 17476350, PMCID PMC1857246, DOI 10.1172/JCI31446, lire en ligne, consulté le )
- (en) Brower V., « The CAR T-Cell Race | The Scientist Magazine® », sur The Scientist, (consulté le )
- (en-US) http://helldesign.net, « Dramatic remissions in blood cancer in immunotherapy treatment trial | KurzweilAI », sur www.kurzweilai.net (consulté le )
- (en) Rebecca Gardner, David Wu, Sindhu Cherian et Min Fang, « Acquisition of a CD19-negative myeloid phenotype allows immune escape of MLL-rearranged B-ALL from CD19 CAR-T-cell therapy », Blood, vol. 127, no 20, , p. 2406–2410 (ISSN 0006-4971 et 1528-0020, PMID 26907630, PMCID PMC4874221, DOI 10.1182/blood-2015-08-665547, lire en ligne, consulté le )
- James L. Riley, Carl H. June et Bruce R. Blazar, « Human T regulatory cell therapy: take a billion or so and call me in the morning », Immunity, vol. 30, no 5, , p. 656–665 (ISSN 1097-4180, PMID 19464988, PMCID PMC2742482, DOI 10.1016/j.immuni.2009.04.006, lire en ligne, consulté le )