Immunologie des tumeurs
L’immunologie des tumeurs (appelée aussi immunologie anti-tumorale ou immuno-oncologie) et son but, l'immunothérapie des cancers, sont une branche de la biologie et de la médecine qui consiste à étudier les relations entre une tumeur et le système immunitaire de l'hôte, afin de concevoir des traitements anticancéreux capables d'exploiter la puissance potentielle d'une réaction immunitaire dirigée contre la tumeur. Ce domaine est au carrefour de divers domaines de la biologie nécessitant une compréhension particulière ainsi qu'une approche intégrée des connaissances : l'étude du micro-environnement tumoral, des différentes sous-populations de leucocytes présents dans une zone tumorale à un stade déterminé, des facteurs de transcription activés chez ces diverses cellules, des sous-types tumoraux pouvant influencer la réponse immune… sont autant de paramètres essentiels à décrire. La mise en évidence de nombreux acteurs moléculaires fondamentaux de régulation de la réponse immune durant ces 20 dernières années a révolutionné l'immunothérapie dans la lutte contre le cancer, avec le développement de nouvelles thérapies prometteuses, mais avec des applications dans d'autres domaines de l'immunologie[1].
L'immunothérapie contre le cancer est de plus en plus basée sur le développement de thérapies ciblées en fonction des types tumoraux ; les cellules cancéreuses expriment très souvent des macromolécules membranaires (protéines, dans la majorité des cas) détectables par divers agents du système immunitaire, nommées antigènes tumoraux (tels NY-ESO-1, MAGE-A, etc.). Les antigènes tumoraux permettent une discrimination efficace des cellules tumorales par le système immunitaire et laissent ainsi l'espoir d'une thérapie ciblée et n'occasionnant que très peu de dégâts dans les tissus sains alentour, consistant en une "forme active" de l'immunothérapie. L'immunothérapie dite "passive" a davantage pour objectif de stimuler une réponse immune antitumorale préexistante par l'utilisation d'anticorps monoclonaux ou de cytokines.
Immunologie des tumeurs
Par des méthodes d'anatomopathologie, il est possible de vérifier la présence de cellules immunitaires dans les tissus cancéreux. Il existe en effet un infiltrat tumoral, composé de macrophages et de lymphocytes. Il est décrit dans le cancer colorectal que la présence de nombreux lymphocytes T CD8+ est un facteur de bon pronostic[2] - [3].
Par ailleurs, il est établi que de nombreuses tumeurs sont capables d'inhiber l'action du système immunitaire, en limitant l'action des cellules cytotoxiques, lymphocytes NK et lymphocytes T, en inhibant directement certaines de leur fonctions de reconnaissance de cible, et en favorisant l'apparition de cellules suppressives. Par ailleurs, du fait de leur dérèglement génétique, l'immense majorité des cellules tumorales est résistante à l'apoptose (les tumeurs accumulent des mutations au cours de leur développement, dont des mutations sur les gènes proapoptotiques tels que p53, par exemple) ce qui limite l'action cytotoxique du système immunitaire.
Influence du micro-environnement tumoral sur l'immunité
Le micro-environnement tumoral, du fait de son hétérogénéité, possède des capacités immunosuppressives relativement étudiées. Ainsi, divers phénomènes relatifs à la progression tumorale, à savoir l'angiogenèse tumorale ou encore l'EMT, ont été décrits pour leurs liens avec les capacités immunosuppressives de la tumeur.
Ainsi, il a par exemple été montré chez la souris que le sunitinib, un agent anti-angiogénique permettant d'inhiber la signalisation des récepteurs du
VEGF, PDGF, SCF et FLT-3L (facteurs de croissance nécessaires à l'angiogenèse mais aussi au développement tumoral de façon plus globale), avait également comme effet de diminuer la concentration en lymphocytes T CD4+ régulateurs au sein du site tumoral[4], suggérant une influence importante des voies de l'angiogenèse sur la modulation de la réponse immune anti-tumorale[5].
D'autres champs de recherche sont également explorés : si la contribution des fibroblastes associés aux tumeurs (CAF : Cancer Associated Fibroblasts) dans le développement tumoral semble ne faire aucun doute[6], le rôle immunosuppresseur de ces fibroblastes au sein même du micro-environnement tumoral reste moins connu. L'identification des acteurs moléculaires spécifiques de ces fibroblastes pourrait à terme mener à l'identification de nouvelles cibles thérapeutiques.
En parallèle, de nombreux projets de recherche se concentrent sur l'étude de la biologie des cellules immunitaires infiltrant les tumeurs. Parmi elles, on retrouve notamment :
- Les macrophages : les monocytes sanguins sont capables d'infiltrer les tumeurs et d'évoluer en macrophages pouvant phagocyter des cellules tumorales et réaliser ensuite une présentation antigénique afin d'activer ou stimuler la réponse immunitaire adaptative. Il a été montré que les macrophages infiltrant les tumeurs (TIM : Tumor Infiltrating Macrophages) pouvaient évoluer en fonction du stade tumoral, du lieu de présence et en fonction de nombreux autres paramètres encore débattus. Ainsi, il existe plusieurs phénotypes de macrophages tumoraux nommés M1 et M2 (dont M2a, b, c) qui ont des fonctions pro-inflammatoires ou anti-inflammatoires, et ainsi, dans un contexte tumoral, pro ou anti-tumoral. Ainsi, une tumeur peut utiliser les macrophages par divers moyens pour créer un environnement favorable à son développement[7].
- Les lymphocytes T CD4+ régulateurs : ce type cellulaire est actuellement tout aussi exploré. Ces cellules ont la capacité d'inhiber ou au moins de participer à une régulation négative puissante du système immunitaire, à travers la sécrétion de TGF-β, d'IL-10 et de Fgl2. Les tumeurs, à travers divers moyens, peuvent activer les lymphocytes T régulateurs afin d'inhiber l'immunité innée et adaptative anti-tumorale.
Immunosurveillance
Théorie
La théorie de l'immunosurveillance énonce que tout au long de la vie, des cellules tumorales sont éliminées par le système immunitaire. l'interaction entre immunité et tumeur suivrait trois phases [8] - [9] :
- élimination : les tumeurs sont détruites ;
- équilibre : un équilibre dynamique permet que des cellules tumorales sont gardées sous contrôle sans être détruites ;
- échappement : Les cellules tumorales échappent au contrôle par le système immunitaire.
Controverse
Cette théorie ne fait pas l'unanimité chez les biologistes du cancer[10]. Un des arguments mis en avant est l'absence de pression de sélection en faveur d'un système immunitaire capable de lutter contre les tumeurs, puisque la plupart des cancers se constatent à un âge adulte, voire avancé, c'est-à-dire après la procréation[11].
Mise en évidence
Il existe cependant des indices expérimentaux chez la souris. Ainsi, en injectant du méthylcholanthrène, un puissant carcinogène dans des souris, il est possible d'induire des cancers. Mais si on utilise une dose faible, la plupart des souris ne développeront pas de cancer. Cependant, si on élimine les cellules T de ces souris avec un anticorps monoclonal, on constate que des tumeurs se révèlent cliniquement. Ceci est donc un argument en faveur de l'existence de tumeur cryptiques, tenues sous contrôle du système immunitaire, et qui prolifèrent brusquement lorsque la pression immunitaire se relâche[12].
Action immunologique des traitements du cancer
La plupart des traitements anti-cancéreux par rayonnement ionisant ou chimiothérapie sont considérés comme aplasiants et immunosuppresseurs. Cependant, certains médicaments comme le cyclophosphamide[13] et la gemcitabine [14] sont capables d'éliminer préférentiellement des cellules immunitaires inhibitrices, respectivement les lymphocytes T régulateurs et les cellules myéloïdes suppressives. Par ailleurs, d'autres traitements chimiothérapeutiques, tels les anthracyclines[15] ou le bortezomib[16] sont quant à eux capables d'induire une mort tumorale immunogène, c'est-à-dire que les cellules tumorales tuées par ces médicaments sont pris en charge par les cellules présentatrices d'antigène et induisent une réponse immunitaire.
Il convient de résoudre ces problématiques liées aux effets des traitements sur le système immunitaire, qui est actuellement considéré comme un facteur clé dans la lutte contre le cancer[17]. Par ailleurs, l'étude des traitements anti-cancéreux et de leurs effets sur le système immunitaire soulève diverses interrogations essentielles quant à leur perfectionnement[18]. De nombreuses études considèrent que l'avenir du traitement du cancer réside dans une synergie totale et maîtrisée entre deux types de traitements tels que la chimiothérapie (pour affaiblir les cellules tumorales) puis l'immunothérapie (qui détruira les cellules tumorales précédemment affaiblies).
Immunothérapie des tumeurs
On dénombre 4 grandes stratégies d'immunothérapie des cancers ; toutes ont fait leurs preuves en matière d'efficacité dans la réduction du volume tumoral, à travers de très nombreux essais cliniques, mais il convient désormais de cibler les patients en fonction des types d'immunothérapie les plus appropriés selon leur cancer ainsi que d'autres paramètres (médecine personnalisée) :
- Immunothérapie non spécifique : c'est une des méthodes d'immunothérapies les plus simples, mais aux résultats modérés. Il s'agit d'injecter des cytokines permettant d'améliorer la réponse immune anti-tumorale, voire de permettre la régression tumorale (Interleukine 2 et IFN-γ).
- Immunothérapie par anticorps monoclonaux : c'est actuellement l'une des stratégies aux résultats des plus encourageants : des anticorps monoclonaux, ciblant des points de contrôle et de régulation du système immunitaire, permettent de bloquer l'inhibition (par la tumeur) de l'immunité anti-tumorale. L'utilisation d'anticorps comme le Nivolumab ou le Pembrolizumab, dans le ciblage de la molécule PD-1 sont les molécules rencontrant le plus de succès.
- Immunothérapie spécifique « adoptive » : cette stratégie repose sur le prélèvement des cellules T autologues, donc issus du sang (ou du site tumoral) du patient cancéreux, afin de les reprogrammer génétiquement en laboratoire pour les rendre plus efficaces dans leurs fonctions effectrices anti-tumorales.
- Vaccination thérapeutique : cette méthode correspond à une stimulation du système immunitaire grâce à l'utilisation de lymphocytes T CD8+ programmés pour cibler directement des cellules porteuses d'antigènes tumoraux puissamment immunogéniques[19] - [20].
Immunothérapie par anticorps monoclonaux
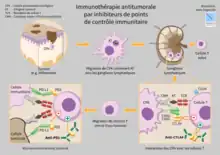
L'immunothérapie se concentre notamment autour de protéines de régulations du système immunitaire, nommées checkpoints du système immunitaire (immune checkpoints ou "points de contrôle du système immunitaire"). Parmi ces protéines, le CTLA-4, PD-1, ou encore TIGIT, qualifiées de rhéostats de la réponse immune[21] : ces molécules permettent entre autres le contrôle de la réponse immune adaptative du fait de leur expression par plusieurs sous-catégories de lymphocytes T (ainsi que d'autres cellules immunocompétentes). Ces molécules permettent une inactivation du système immunitaire et il a été montré que les tumeurs pouvaient, dans le cadre de leur stratégie de résistance et d'échappement tumoral face aux réactions immunes, inactiver la réponse immune anti-tumorale en « épuisant » les lymphocytes par une activation de leurs protéines d'inhibition que sont PD-1, CTLA-4 ou TIGIT (entre autres). Ces molécules sont la source d'un intérêt thérapeutique considérable dans l'espoir de développer des vaccins curatifs à partir d'anticorps monoclonaux inactivant ces protéines.
L'étude de ces divers facteurs de régulation puissante du système immunitaire reste malgré tout un vaste sujet de débat, quant à leur valeur pronostique et diagnostique dans un cadre clinique et de suivi des patients cancéreux. En effet, il a longtemps été considéré que la surexpression de la molécule PD-L1 dans les tumeurs n'était liée qu'à une mauvaise évolution du cancer, du fait de l'expression de cette protéine par les tumeurs. Seulement, l'expression de cette même protéine par diverses sous-populations de cellules du système immunitaire pourrait être un témoin d'une régulation correcte de la réponse immune anti-tumorale exacerbée et témoigner d'un parfait contrôle du système immunitaire sur le développement tumoral. De telles hypothèses restent en suspens et doivent être discutées et vérifiées afin d'adapter les futurs traitements et améliorer la réponse des patients aux divers médicaments en développement.
Il existe de nombreux essais d'immunothérapie des cancers, dont de nombreux traitements anti-cancéreux utilisant l'immunité chez la souris, et il n'est pas rare qu'ils soient couronnés de succès[22]. Mais en clinique humaine, à l'opposé, peu de stratégies sont effectivement des réussites. En effet, même si certaines études sur l'humain montrent des résultats encourageants[23], il reste à déterminer quels types de patients peuvent bénéficier du traitement et avec quelles doses (tous les patients traités ne répondent pas de la même manière au traitement, certains n'y répondent pas du tout). Par ailleurs, il convient également de travailler sur les effets secondaires : la sur-activation du système immunitaire par des traitements d'immunothérapie peut avoir de lourdes conséquences, notamment des récations auto-immunes ou inflammatoires puissantes. Dernièrement, on a obtenu des résultats assez bons pour un traitement du mélanome[24], et des cancers digestifs [25] ciblant les liaisons PD-L1 des tumeurs [26].
Influence du microbiote intestinal
Une étude[27] de 2018, montre l'influence du microbiote intestinal sur l'efficacité de l'immunothérapie. En particulier, l'équipe a mis en évidence chez la souris que la bactérie Bacteroides fragilis contribuait à l’efficacité de l'anti-CLTA-4. De même, chez des patients traités avec du nivolumab (un anticorps dirigé contre le récepteur PD-1), l'efficacité du traitement est corrélée avec le taux d'une bactérie : Akkermansia muciniphila. En transférant à des souris axéniques une même tumeur et le microbiote de patients ayant répondu favorablement ou défavorablement au traitement, l'étude montre une amélioration de l'état des premières contrairement à celles dotées du mauvais microbiote[28].
Vaccination
Des anticorps monoclonaux dirigés contre des antigènes de tumeur sont également de plus en plus expérimentés. C'est le cas par exemple pour le bevacizumab[29].
Transfert adoptif
Il existe aussi des stratégies de transfert adoptif de cellules immunitaires manipulées ex vivo[30].
Annexes
Articles connexes
- Paradoxe de Peto
- William Coley (en) (1862-1936), cancérologue connu pour ses toxines de Coley, médecin du Memorial Sloan-Kettering Cancer Center (avant cette dénomination) connu pour son traitement de certains types de cancer (sarcome) [31], considéré hors de France comme un des pères de l'immunothérapie.
- Facteur de nécrose tumorale (1975)
Liens externes
Notes et références
Références
- Jin, Ahmed, Okazaki. 2011. Role of PD-1 in regulating T-cell immunity. Curr. Top. Microbiol. Immunol. 350: 17-37
- Pages et al., « Effector memory T cells, early metastasis, and survival in colorectal cancer », New England Journal of Medicine, vol. 353, pages 2654-2666, 2005.
- Galon et al., Science, vol. 313, pages 1960-1964, 2006
- Hipp MM, et al. Blood 2008 ; 111 : 5610-20.
- http://www.jle.com/fr/VEGF/VEGF.SOM.29/13-16.pdf "Influence de l’angiogenèse et des traitements anti-angiogéniques sur la réponse immunitaire anti-tumorale et l’immunosuppression" - Pr. Eric Tartour, Paris, 2012
- http://curie.fr/actualites/comprendre-comment-cellule-tumorale-detourne-son-environnement-006647 Les différents types de fibroblastes associés aux tumeurs et leurs effets protumoraux ; Equipe du Pr. Fatima Mechta, Institut Curie - Paris
- http://www.cell.com/immunity/abstract/S1074-7613(14)00230-1
- Dunn et al., Immunity, vol. 21, pages 137-148, 2004.
- Dunn et al., Annual Reviews in Immunology, vol. 22, pages 329-360, 2004.
- Qin et al., Nature Immunology, vol. 5, pages 3-4, 2004.
- Blankenstein, Seminars in Cancer Biology, vol. 17, pages 267-74, 2007.
- Koebel et al., Nature, vol. 450, pages 930-937, 2008.
- Ghiringhelli et al., European Jouranl of Immunology, vol. 34, pages 336-344, 2004.
- Suzuki et al., Clinical Cancer Research, vol. 11, pages 6713-6721, 2005.
- Apetoh et al., Trends in Molecular Medicine, vol. 14, pages 141-151, 2008.
- Spisek et al., Blood, vol. 109, pages 4839-4845, 2007.
- http://www.ipubli.inserm.fr/handle/10608/5849 - Salem Chouaib, Faten El Hage, Houssem Benlalam et Fathia Mami-Chouaib (Institut Gustave Roussy, Villejuif) : "Immunothérapie du cancer : espoirs et réalités" (2006)
- https://www.ncbi.nlm.nih.gov/pubmed/27030078 - "Immunological off-target effects of imatinib", Laurence Zitvogel, Sylvie Rusakiewicz, Bertrand Routy, Maha Ayyoub & Guido Kroemer, Nature, 2016.
- « Faculté de Médecine Montpellier - Nîmes - Université de Montpellier », sur Faculté de Médecine Montpellier - Nîmes (consulté le ).
- http://www.fightcancerwithimmunotherapy.com/immunotherapyandcancer/typesofcancerimmunotherapy
- (en) Oncology meets immunology: the cancer-immunity cycle. https://www.ncbi.nlm.nih.gov/pubmed/23890059
- Par exemple Berraondo et al., Cancer Research, vol. 67, pages 8847-8855, 2007.
- (en) Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. https://www.ncbi.nlm.nih.gov/pubmed/22658128
- "Congrès de l'ASCO 2015, Mélanomes : de meilleurs résultats avec les immunothérapies "-
- "Juillet 2015, GastroScoop: L’immunothérapie des cancers digestifs avance !".
- (en) "Anti–PD-1/PD-L1 therapy of human cancer, 37 s/1 min 23 s.
- (en) Bertrand Routy et al., Gut microbiote influences efficacy of PD-1-based immunotherapy against epithelial tumors, Science, 359, 91, 2018.
- La Recherche n° 535, mai 2018.
- H. Hurwitz H, et al., New England Journal of Medicine, vol. 350, pages 2335–2342, 2004.
- Hunder, New England Journal of Medicine, vol. 358, pages 2698-2703, 2008.
- « Ces cancers qui régressent spontanément », sur Réalités Biomédicales, (consulté le ).