p53
Le p53 (ou TP53 pour « tumor protein 53 »), parfois surnommée « gardienne du génome », est un facteur de transcription découvert en 1979 qui se lie à l'ADN pour réguler de multiples fonctions cellulaires importantes comme la régulation du cycle cellulaire, l'autophagie ou l'apoptose (mort cellulaire programmée). Chez l'être humain, ce gène est situé sur le chromosome 17[2]. Le gène TP53 est inactivé dans près de 50% des cancers humains. Ce gène protège des cancers, mais en diminuant l'espérance de vie de l'organisme[3].
Historique
Il s'agit du gène (et de la protéine) le plus étudié, avec plus de 9000 publications à la date de 2017[4].
De 1979 à 1985
La protéine p53 a été découverte en 1979 de manière simultanée par 4 équipes de recherche. Trois de ces équipes s’intéressaient aux virus cancérigènes et ont caractérisé une protéine cellulaire de 53 000 daltons capable d’interagir avec des protéines exprimées par ces virus (Équipe de L. Crawford, A. Levine et P. May).
Parallèlement, l’équipe de L. Old caractérisait une protéine de même poids moléculaire en cherchant à identifier de nouveaux antigènes tumoraux. Ce n’est qu'en 1985 que l’on pourra montrer que la protéine mise en évidence par L. Old était la même que celle des trois autres équipes. Le nom définitif de p53 a été donné par L. Crawford en 1984. La nomenclature Tp53 proposé en 1998 n’est pas encore pleinement utilisée à l’heure actuelle.
En 1983 l’équipe de A. Levine a été la première à isoler le gène p53 de souris. L’année suivante, plusieurs équipes isolèrent le gène p53 humain. Ce que la communauté scientifique ignorait à cette époque c’est que l’ensemble de ces gènes isolés étaient mutés et possédaient des propriétés particulières.
1985-1989
Durant ces quatre années, l’étude des propriétés de ces gènes mutés a conduit la communauté scientifique à classer le gène p53 dans le groupe des oncogènes.
1989-2007
C’est en 1989 que deux équipes américaines (B. Vogelstein et J. Minna) découvrirent que le gène p53 était inactivé par mutation dans les cancers humains. En même temps, l’équipe de A. Levine découvrit que les gènes p53 isolés étaient mutés. Ces observations et la possibilité d’étudier une p53 non mutée ont permis de classer ce gène dans le groupe des gènes suppresseurs de tumeurs. À partir de 1989, le nombre de laboratoires travaillant sur p53 a augmenté de manière considérable passant d’une dizaine à des milliers avec de nombreux laboratoires cliniques s’intéressant aux mutations de p53 dans divers cancers humains.
Résumé de quelques faits marquants
- Découverte de mdm2, un inhibiteur de p53
- Découverte des propriétés apoptotiques de p53
- Découverte de la réponse p53 après lésions génotoxiques
- Cristallisation de la protéine p53
- Découverte de p63 et p73, des protéines apparentées à p53
2008-2017
Les progrès dans l'étude des génomes et des transcriptomes ont bouleversé nos connaissances sur l'organisation des gènes avec la mise en évidence que chaque gène Eucaryote pouvait coder de nombreuses protéines. En , il est établi que le gène TP53 est transcrit en 8 ARN messagers différents pouvant être traduits en 12 isoformes différentes. Chacune de ces isoformes semble avoir une propriété différente au sein de la cellule mais leur fonction exacte n'est pas encore entièrement élucidée.
Rôle antitumoral de p53
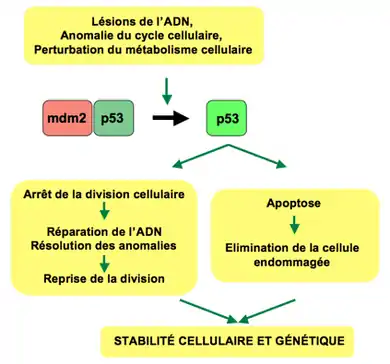
La fonction première de la protéine p53 est d’agir en tant que facteur de transcription. Elle fonctionne en se fixant de manière spécifique sur les régions régulatrices de gènes dont elle contrôle l’expression. Dans une cellule normale, en l’absence de tout stress, il n’y a que très peu de p53, car celle-ci n’est pas nécessaire au fonctionnement de la cellule. Cette absence de p53 est due à l'enzyme mdm2, une E3 ubiquitine ligase qui, en se fixant sur p53, induit sa destruction. Lorsque la cellule se trouve en situation de stress, l’association entre p53 et mdm2 est abolie ce qui conduit à une augmentation de la quantité de p53 dans la cellule. Cette première phase est nommée « phase d’activation ». De nombreux types de stress sont capables d’activer la p53 comme les lésions de l’ADN, les défauts de division ou de métabolisme cellulaire.
Dans un second temps, la p53 va subir de nombreuses modifications post traductionnelles qui vont permettre d’activer sa fonction de facteur de transcription. Cette phase est nommée « phase de modification ».
Dans un troisième temps, la p53 activera la transcription d’un grand nombre de gènes. Cette phase est nommée « phase de réponse ». L’ensemble de ce programme pourra conduire à deux résultats, soit l’arrêt du cycle cellulaire soit l’apoptose.
On considère p53 comme gardien de l'intégrité cellulaire. Il agit sur des inhibiteurs de Cdk, p21 par exemple. Cela permet d'inhiber Cdk4, qui permettra d'inhiber la phosphorylation de la pRB. Ce dernier reste donc actif, et la cellule est bloquée en phase G1.
L’arrêt du cycle cellulaire permet à la cellule de stimuler ses mécanismes de réparation, dont certains sont directement activés par p53. Lorsque la réparation est effectuée, le taux de p53 retourne à la normale et le cycle cellulaire reprend. Si les dommages subis par la cellule ne peuvent pas être réparés, la cellule entre en apoptose, ce qui conduit à son élimination. Ce mécanisme apoptotique est directement contrôlé par p53, en particulier par le biais de ses isoformes[5] - [6]. Un des rôles de p53 est d'activer, entre autres, l'expression du gène de Bax. La protéine Bax, en se dimérisant, va perforer la membrane mitochondriale pour permettre au cytochrome c d'en sortir. La sortie du cytochrome c de la mitochondrie vers le cytosol est un événement central dans le processus apoptotique intrinsèque. À l’heure actuelle, on ne sait pas pourquoi ni comment certaines cellules s'orientent vers un programme apoptotique plutôt qu'un arrêt du cycle cellulaire, et vice versa.
La protéine p53 est donc une molécule indispensable au maintien de l’intégrité de la cellule et de ses composantes. C’est pour cette raison qu’elle est généralement nommée « gardienne du génome »
Si l'on élimine artificiellement la p53, la cellule ne peut plus répondre à l’ensemble des stress et aucun arrêt du cycle cellulaire ou apoptose n’est observé. Quand p53 est inactif, par exemple lorsqu'il est muté, il n'est plus capable d'agir sur l'inhibiteur de Cdk : Cdk4 est donc actif. Il va phosphoryler la pRB, ce qui provoquera l'entrée en phase S de la cellule.
Structure de la protéine p53
Le facteur de transcription p53 est constitué de 6 différents domaines fonctionnels. Chaque domaine possède une fonction spécifique au sein de la protéine, fonction ayant été caractérisée par l'utilisation de protéines mutantes délétées d'un ou plusieurs de ces domaines fonctionnels. Ces fonctions ne sont cependant pas totalement indépendantes au sein de la protéine car chacune d'entre elles est affectée par l'activité des autres domaines de p53.
Liste des gènes cibles de p53
Gènes impliqués dans l'arrêt du cycle cellulaire ou la sénescence
- BHLHE40 : basic helix-loop-helix family, member e40 (DEC1 : differentially expressed in chondrocytes 1) → facteur de transcription, réprime la transcription de Id1
- BTG2 : B-cell translocation gène 2 (Tis21) → régule la transcription de gènes impliqués dans la transition G1/S du cycle cellulaire et active la déanylation de certains ARNm
- BTG3 : B-cell translocation gène 3 (ANA, Tob5) → régule la transcription de gènes impliqués dans la transition G1/S du cycle cellulaire et active la déanylation de certains ARNm
- CDKN1A : cyclin-dependent kinase inhibitor 1A (p21) → inhibe l'activité des kinases dépendantes des cyclines (CDK), inhibe la protéine PCNA, la réplication de l'ADN ainsi que l'entrée en mitose.
- SERPINE1 : serpin peptidase inhibitor, clade E, memeber1 (PAI-1 : plasminogen activator inhibitor type 1) → inhibiteur de l'urokinase (uPA)et de l'activateur tissulaire du plasminogène (tPA)
- ZNF385A : zinc finger protein 385A (Hzf : Hematopoietic zinc finger) → régulateur transcriptionnel, augmente l'activité de p53 sur les gènes d'arrêt du cycle cellulaire
- DcR2
- 14.3.3 sigma
- Reprimo
Gènes régulateurs du métabolisme cellulaire
- AMPKb1
- AMPKb2
- REDD1
- Tigar
- Sestrin1
- Sestrin2
- PHLDA3
- PTEN
- p53DINP1
Gènes impliqués dans l'apoptose
- Puma
- Noxa
- BAX : BCL2-associated X protein (Bax) → interagit avec la protéine mitochondriale VDAC, induit la dépolarisation de la mitochondrie et la sortie du cytochrome c
- FAS
- DR5
- CDIP
Gènes induisant un stress oxydatif
- NOS3
- PERP
- PIG3
- PIG6
Gènes de réparation de l'ADN
- PCNA
- GADD45A
- DDB2
- XPC
Modification du gène p53 dans les cancers
Altérations du gène p53 dans les cancers humains
Près de 50 % des cancers humains ont une p53 mutée qui a perdu ses capacités anti prolifératives et apoptotiques. Dans les cancers du col de l’utérus (toujours associées à un virus de type HPV), la situation est particulière. Une protéine virale (protéine E6) se fixe spécifiquement sur p53 et la détruit ce qui conduit à la même situation qu’une tumeur ayant une p53 mutée. Pour autant, les tumeurs HPV16 positives ont un meilleur pronostic, en effet la P53 inactivée par liaison avec E6 demeure malgré tout normale dans sa structure car ne subissant pas de transformation.
Pourquoi le gène p53 est-il fréquemment altéré dans les cancers humains
La protéine p53 est l'agent le plus important de la protection de la cellule contre la cancérisation. Les cellules chez qui le gène est intact seront donc moins enclines à la cancérisation. Ceci permet d'affirmer que "l'inactivation de p53 est un préalable indispensable à la cancérisation" bien que le phénomène se passe en réalité dans l'autre sens : si p53 est muté, la cellule devient bien plus à risque de transformation maligne. Ceci explique qu'on observe des mutations de p53 dans plus de la moitié des cancers humains.
De plus, les mutations de p53 sont dites dominantes négatives. Cela veut dire que les copies mutées dominent la copie fonctionnelle. En effet, pour que la protéine P53 soit active, il lui faut former un tétramère de 4P53 fonctionnelles. Pour un individu P53+/- (1allèle wild type et 1allèle muté), nous avons alors 1chance sur 2 d'avoir l'allèle P53 wild type. Soit 4 protéines (tétramère fonctionnel), cela nous fait (1/2)^4 d'avoir un tétramère formé de 4P53wildtype. On peut alors très vite comprendre pourquoi P53 est mis à mal même avec 1seule mutation dans un de ses allèles. C'est donc de la dominance négative en cas de mutation : 15tétramères non fonctionnels versus 1tétramère fonctionnel.
Comment le gène p53 est-il altéré ?
Les études d’épidémiologie moléculaire ont démontré de manière formelle que les altérations du gène p53 étaient dues à l’exposition à des carcinogènes dans les cas de cancers bronchiques (tabac), cancer de la peau (rayons UV) ou cancer du foie (alcool) dans les pays en voie de développement (exposition à l’aflatoxine B1), pour lesquelles les mécanismes de réparation du génome n'ont pas fonctionné.
Relation entre perte de la fonction de p53 et les propriétés de la tumeur
Le but de la thérapie anti cancéreuse est de tuer les cellules malignes en nuisant le moins possible aux cellules normales. L’apoptose est l’une des voies qui est induite par la radiothérapie ou la chimiothérapie. Malheureusement, ce programme apoptotique est contrôlé par la p53. On observe généralement que les tumeurs exprimant une p53 altérée ont une moins bonne réponse à la thérapie par rapport à une tumeur exprimant une p53 mutée. Néanmoins, il existe des cas particuliers chez lesquels on observe l'inverse. À l'heure actuelle, le statut du gène p53 n'est pas utilisé comme marqueur en routine clinique. Une thérapie antitumorale basée sur l'utilisation de P53 à partir d'une synthèse artificielle, parait presque impossible à cause de la complexité induite par une telle génération, en dehors du domaine génétique[7]. Il serait plus réaliste d'utiliser les cellules non mutées d'un patient comme source de production de la protéine, en simulant sa production, par exemple par la protéine P14[8]. Un essai thérapeutique, mené en 2002 sur des souris, et basé sur la production de protéines P53 a cependant été accompagné d'un vieillissement accéléré[9]. La régulation et l'activation de P53 est cependant un domaine très complexe[10] - [11] - [12].
Notes et références
Notes
Références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Isobe M, Emanuel B, Givol D, Oren M, Croce C, Localization of gene for human p53 tumour antigen to band 17p13. Nature, 1986;320:84–5.
- Jean-Claude Ameisen, « Entre Charybde et Scylla : le vieillissement prématuré est-il un prix à payer pour la protection contre les cancers ? », médecine/sciences, vol. 18, no 4, , p. 393–395 (ISSN 0767-0974 et 1958-5381, DOI 10.1051/medsci/2002184393, lire en ligne, consulté le )
- Gates AJ, Kellis M, Morselli Gysi D, Barabasi AL, Le projet « Génome humain » vingt ans après, Pour la Science, mai 2021, p48-53
- "Isoformes, protéine p53"
- Matthieu Lacroix, Laetitia Karine Linares et Laurent Le Cam, « [Role of the p53 tumor suppressor in metabolism] », Medecine Sciences: M/S, vol. 29, no 12, , p. 1125–1130 (ISSN 0767-0974, PMID 24356143, DOI 10.1051/medsci/20132912016, lire en ligne, consulté le )
- https://www.youtube.com/watch?v=9OvzIpQhXTw "Synthetic Synthesis of Proteins,5 min/13 min"]
- "You tube: Life in Miniature, 2013: Our Secret War Against Cancer"
- "Nature,2002:p53 mutant mice that display early ageing-associated phenotypes"
- "P53 regulation/Hdm2"
- "Youtube: Introduction to p53 and The Response to DNA Damage Part 1"
- "You Tube 2012:The regulation and activation of P53 functions protect from cancer"
- (en) p53 and tumor suppression, Terry Van Dyke, New Eng J Med, 2007;356:79-81
- (en) Surfing the p53 network, Vogelstein B, Lane D, Levine AJ (2000) . Nature 408: 307-310.
- (en) p53 pathway: positive and negative feedback loops,Harris S and Levine AJ (2005) Oncogene 24 : 2899–2908.
- (en) the p53 web site