Kinase dépendante des cyclines
Les kinases dépendantes des cyclines (en anglais, cyclin-dependent kinase ou CDK) sont une famille de protéines kinases qui jouent un rôle majeur dans la régulation du cycle cellulaire. Elles sont également impliquées dans la régulation de la transcription, le traitement des ARN messagers et la différenciation des cellules nerveuses[1]. Elles sont présentes chez tous les eucaryotes, et leur fonction dans le cycle cellulaire s’est fortement conservée au cours de l'évolution. À tel point que certaines levures peuvent survivre et proliférer normalement si leurs gènes codant les CDK ont été remplacés par leurs homologues humains[1] - [2]. Les protéines CDK sont relativement petites avec des poids moléculaire variant entre 34 et 40 KDa[1]. Par définition, une CDK se fixe à une protéine régulatrice du cycle cellulaire appelée cycline. Sans sa cycline cible, la protéine CDK a très peu d'activité kinase : c'est l'association de la CDK et de la cycline qui confère son activité au complexe. Les protéines CDK phosphorylent leurs substrats, en l'occurrence, les sérines et les thréonines, ce qui en fait des sérine-thréonine kinases[1]. La séquence consensus en acides aminés pour la phosphorylation d'une protéine par les CDK est [S/T*]PX[K/R], où S/T* est la sérine ou thréonine phosphorylée, P est une proline, X est n'importe quel acide aminé, K est une lysine et R est une arginine[1].
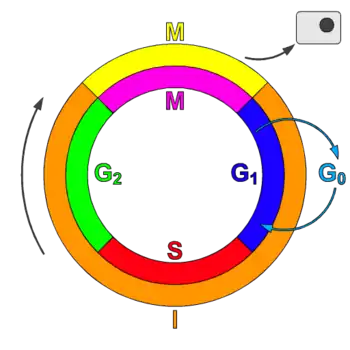
Types de CDK
Tableau 1 : CDK connues avec leurs cyclines partenaires et leurs fonctions chez l'être humain[3] avec la conséquence de leur délétion chez la souris[4].
| CDK | Cycline partenaire | Fonction | Phénotype de la délétion chez la souris |
|---|---|---|---|
| Cdk1 | Cycline B | Mitose | Aucun. ~E2.5. |
| Cdk2 | Cycline E | Transition G1/S | Taille réduite, prolifération des cellules progénitrices affectée. Viable mais les mâles et femelles sont tous deux stériles. |
| Cdk2 | Cycline A | Rôle en phase S et en phase G2 | |
| Cdk3 | Cycline C | Possiblement rôle en phase G1 | Pas de problèmes. Animaux viables et fertiles. |
| Cdk4 | Cycline D | Phase G1 | Taille réduite, diabète insulinodépendant. Viable, mais mâles et femelles stériles. |
| Cdk5 | p35 | Transcription | Problèmes neurologiques sévères. Mort juste après la naissance. |
| Cdk6 | Cycline D | phase G1 | |
| Cdk7 | Cycline H | Activatrice des CDK, transcription. | |
| Cdk8 | Cycline C | Transcription | Létal à l'état embryonnaire. |
| Cdk9 | Cycline T | Transcription | Létal à l'état embryonnaire. |
| Cdk11 | Cycline L | Inconnue | Défauts lors de la mitose. E3.5. |
| ? | Cycline F | Inconnue | Défauts dans les tissus extra-embryonnaires. E10.5. |
| ? | Cycline G | Inconnue |
CDK et cyclines lors du cycle cellulaire
La plupart des complexes cycline-CDK régulent la progression au cours du cycle cellulaire. Les cellules animales contiennent au moins 9 CDK, dont 4 (CDK1, 2, 3 et 4) sont impliquées directement dans le cycle cellulaire[1]. Dans les cellules de mammifères, CDK1 seule et ses partenaires les cyclines A2 et B1 peuvent orchestrer le cycle cellulaire[3]. CDK7 quant à elle est indirectement impliquée comme activatrice des autres[4]. Les complexes cycline-CDK phosphorylent des substrats appropriés pour une phase particulière du cycle celullaire. Les complexes cycline-CDK intervenant au début du cycle cellulaire aident à l'activation des complexes impliquées dans les phases plus tardives[1].
Tableau 2 : Cyclines et CDK selon la phase du cycle cellulaire
| Phase | Cycline | CDK |
|---|---|---|
| G0 | C | Cdk3 |
| G1 | D, E | Cdk4, Cdk2, Cdk6 |
| S | A, E | Cdk2 |
| G2 | A | Cdk2, Cdk1 |
| M | B | Cdk1 |
Tableau 3 : CDK qui contrôlent le cycle cellulaire dans les organismes modèles[1].
| Espèce | Nom | Nom originel | Taille (acides aminés) | Fonction |
|---|---|---|---|---|
| Saccharomyces cerevisiae | Cdk1 | Cdc28 | 298 | Tous les stades du cycle cellulaire |
| Schizosaccharomyces pombe | Cdk1 | Cdc2 | 297 | Tous les stades du cycle cellulaire |
| Drosophila melanogaster | Cdk1 | Cdc2 | 297 | Mitose |
| Cdk2 | Cdc2c | 314 | G1/S, S, peut-être M | |
| Cdk4 | Cdk4/6 | 317 | G1, promeut la croissance | |
| Xenopus laevis | Cdk1 | Cdc2 | 301 | M |
| Cdk2 | 297 | S, peut-être M | ||
| Homo sapiens | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | 298 | G1, S, peut-être M | ||
| Cdk4 | 301 | G1 | ||
| Cdk6 | 326 | G1 |
Regulation de l'activité des CDK
Le niveau des CDK reste relativement constant tout au long du cycle cellulaire, et la plupart des régulations sont post-traductionnelles. La connaissance de la structure des CDK provient principalement de structures obtenues chez Schizosaccharomyces pombe (Cdc2), Saccharomyces cerevisiae (CDC28) et certains vertébrés (CDC2 et CDK2). Les quatre principaux mécanismes de régulation des CDK sont la fixation aux cyclines, la phosphorylation activatrice, la phosphorylation répressive et la fixation de protéines répressives[5].
Fixation aux cyclines
Le site actif, ou site de fixation de l'ATP, de toutes les kinases est un sillon entre un petit lobe amino-terminal et un large lobe carboxy-terminal[1]. La structure de CDK2 chez l'être humain montre que les CDK ont un site de fixation à l'ATP modifié et qui peut être régulé par la fixation aux cyclines[1]. La phosphorylation par la "CDK activating-kinase" à la Thr 161 augmente l'activité du complexe. Sans cycline, une boucle flexible appelée boucle activatrice ou boucle T bloque le sillon, et la position de plusieurs acides aminés empêche la fixation de l'ATP[1]. En présence de cycline, deux hélices alpha changent de position pour permettre la fixation de l'ATP. L'une d'elles, l'hélice L12 placée juste avant la boucle T, devient un feuillet β et aide au réarrangement de la boucle T pour qu'elle ne bloque plus le sillon[1]. L'autre hélice α, appelée hélice PSTAIRE, aide au réarrangement des acides aminés dans le site actif[1].
Il y a une très grande spécificité entre une cycline et la CDK correspondante[3]. De plus, la cycline impliquée détermine la spécificité du complexe cycline-CDK avec son substrat[3]. Les cyclines peuvent directement se fixer à leurs substrats ou amener la CDK dans un compartiment cellulaire où se trouve le substrat. En ce qui concerne la phase S, la spécificité pour le substrat se fait par le biais d'un domaine hydrophobique (séquence MRAIL) qui a une forte affinité pour les protéines qui contiennent un motif hydrophobique RXL. Les cyclines B1 et B2 peuvent amener Cdk1 au noyau ou à l’appareil de Golgi[1].
Phosphorylation
L'activité kinase complète requiert une phosphorylation sur la thréonine adjacente au site actif. L'identité de la "CDK-activating kinase" (CAK) qui réalise cette modification ainsi que le timing suivant lequel elle la réalise varient selon les espèces[1]. Dans les cellules de mammifères la phosphorylation activatrice se déroule après la fixation à la cycline[1]. Chez la levure au contraire elle se déroule avant. L'activité des CAK n'est pas dépendante d'une régulation par des facteurs du cycle cellulaire et la fixation à la cycline est l'étape limitante pour l'activation des CDK[1].
Contrairement à la phosphorylation activatrice, la phosphorylation inhibitrice des CDK est essentielle pour la régulation du cycle cellulaire. Plusieurs kinases et phosphatases participent à cette régulation. Une de ces enzymes qui placent la phosphorylation sur la tyrosine est Wee1, qui est conservée chez tous les eucaryotes[1]. La levure S. pombe possède une deuxième kinase Mik1 qui peut phosphoryler la tyrosine[1]. Chez les vertébrés, une seconde kinase proche de Wee1 appelée Myt1 peut phosphoryler aussi bien la thréonine que la tyrosine[1]. Les phosphatases de la famille Cdc25 quant à elles sont capables de déphosphoryler aussi bien la thréonine que la tyrosine[1].
Inhibiteurs de CDK
Une protéine inhibitrice de CDK ("cyclin-dependent kinase inhibitor protein" [CKI]) est une protéine qui interagit avec un complexe cycline-CDK pour bloquer l'activité kinase, généralement durant la phase G1 ou en réponse à des signaux provenant de l'environnement ou dû à des dommages de l'ADN[1]. Dans les cellules animales il existe deux familles majeures de CKI : la famille INK4 et la famille CIP/KIP[1]. Les protéines de la famille INK4 sont strictement des inhibiteurs de CDK et se lient à des monomères de CDK. La structure du complexe CDK6-INK4 montre que la fixation d'INK4 entraine une torsion de la CDK ce qui empêche la fixation de la cycline et l'activité kinase. Les protéines de la famille CIP/KIP quant à elles peuvent se fixer aussi bien aux cyclines qu'aux CDK et peuvent être aussi bien inhibitrices qu'activatrices. Ainsi les protéines de la famille CIP/KIP peuvent activer le complexe entre la cycline D et CDK4 ou 6 en facilitant la formation du complexe[1].
Chez la levure et la drosophile, les CKIs sont des puissants inhibiteurs des CDK associées aux phases M et S mais n'inhibent pas celles associées à la phase G1. Durant la phase G1, de hauts niveaux de CKIs empêchent l'apparition d'évènements du cycle cellulaire non prévus mais pas le passage du checkpoint de la phase G1 à la phase S. Dès que le cycle cellulaire est amorcé, la phosphorylation des premières G1/S CDK conduit à la destruction des CKIs ce qui lève l'inhibition des futures transitions du cycle cellulaire.
Les CDK directement impliquées dans la régulation du cycle cellulaire s'associent avec des petites protéines (9 à 13 kDa) appelées Suk1 ou Cks[3]. Ces protéines sont nécessaires pour le bon fonctionnement des CDK mais leur rôle précis est inconnu[3]. Cks1 se fixe au lobe carboxyle de CDK et reconnaît les résidus phosphorylés. Ce processus pourrait aider le complexe cycline-CDK à interagir avec des substrats possédant de multiples résidus phosphorylés[3].
Cyclines virales
Certains virus peuvent coder des protéines possédant des séquences homologues aux cyclines. Par exemple la cycline K du virus du sarcome de Kaposi active CDK6. Les complexes cycline virale-CDK sont spécifiques pour d'autres substrats et soumis à des régulations différentes[6].
Activateurs de CDK5
Les protéines p35 et p39 activent CDK5. Malgré le fait que ces protéines ne présentent pas d'homologie de séquence avec les cyclines, la structure cristallographique de p35 montre que son repliement présente des similitudes avec les cyclines. Toutefois l'activation de CDK5 ne nécessite pas de phosphorylation sur la boucle[6].
RINGO/Speedy
Des protéines qui ne présentent pas d'homologie avec les cyclines peuvent être des activateurs directs des CDK[7]. Une des familles de ces activateurs est celle des protéines RINGO/Speedy qui ont été découvertes chez le xénope. Les 5 membres de la famille connus sont capables d'activer Cdk1 et Cdk2 mais le complexe RINGO/Speedy-Cdk2 reconnait différents substrats que le complexe cycline A-Cdk2[6].
Historique
Leland H. Hartwell, R. Timothy Hunt et Paul M. Nurse ont reçu en 2001 le prix Nobel de physiologie ou médecine pour la description complète des cyclines et des CDK qui sont essentielles pour la régulation du cycle cellulaire.
Importance médicale
Les CDK sont considérées comme des cibles potentielles pour le traitement de certains cancers. S'il est possible d'interrompre de manière spécifique le cycle cellulaire de cellules cancéreuse en interférant avec les CDK ceci provoquera la mort des cellules. Certains inhibiteurs de CDK comme le "Seliciclib" sont actuellement en essai clinique. Bien qu'étant originellement décrit comme un médicament anti-cancéreux potentiel, des tests ont montré que cette molécule pouvait aussi induire l'apoptose dans les neutrophiles qui sont les médiateurs de l'inflammation[8]. Elle pourrait donc être utilisée pour le traitement d'inflammations chroniques telles que l'arthrite ou la cystite.
Le flavopiridol est également un inhibiteur de CDK en phase de test clinique après avoir été identifié en 1992. Il agit en compétition avec l'ATP pour la fixation sur les CDK[9].
Néanmoins ces pistes requièrent une meilleure connaissance des CDK car l'inhibition de ces protéines pourrait avoir des conséquences potentiellement dramatiques. Même si les inhibiteurs de CDK sont prometteurs, il est encore important de déterminer comment réduire les effets secondaires et augmenter la spécificité des types cellulaires visés.
Le développement de molécules ciblant les CDK est compliqué car ces protéines ne sont pas seulement impliquées dans le cycle cellulaire mais aussi dans d'autres processus comme la transcription, la physiologie des neurones ou encore le métabolisme du glucose[10].
Tableau 4: Inhibiteurs de CDK[10]
| Molécule | CDK ciblées |
|---|---|
| Flavopiridol | 1, 2, 4, 6, 7, 9 |
| Olomoucine | 1, 2, 5 |
| Roscovitine | 1, 2, 5 |
| Purvalanol | 1, 2, 5 |
| Paullones | 1, 2, 5 |
| Butryolactone | 1, 2, 5 |
| Palbociclib | 4, 6 |
| Thio/oxoflavopiridols | 1 |
| Oxindoles | 2 |
| Aminothiazoles | 4 |
| Benzocarbazoles | 4 |
| Pyrimidines | 4 |
| Seliciclib | ? |
| Ribociclib | 4, 6 [11] - [12] |
Références
- (en) David O. Morgan, The Cell Cycle: Principles of Control, London, New Science Press, , 297 p. (ISBN 0-9539181-2-2, lire en ligne).
- (en) Melanie G. Lee et Paul Nurse, « Complementation used to clone a human homologue of the fission yeast cell cycle control gene cdc2 », Nature, vol. 327, no 6117, , p. 31–35 (ISSN 1476-4687, DOI 10.1038/327031a0, lire en ligne, consulté le ).
- Morgan, David O. (1997) "Cyclin-Dependent Kinase: Engines, Clocks, and Microprocessors." Annual Review of Cell and Developmental Biology. 13:261-291.
- (en) A. Satyanarayana et P. Kaldis, « Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms », Oncogene, vol. 28, no 33, , p. 2925–2939 (ISSN 1476-5594, DOI 10.1038/onc.2009.170, lire en ligne, consulté le ).
- (en) David O. Morgan, « Principles of CDK regulation », Nature, vol. 374, no 6518, , p. 131–134 (ISSN 1476-4687, DOI 10.1038/374131a0, lire en ligne, consulté le ).
- (en) « CDK activation by non-cyclin proteins », Current Opinion in Cell Biology, vol. 18, no 2, , p. 192–198 (ISSN 0955-0674, DOI 10.1016/j.ceb.2006.01.001).
- Silvana Mourón, Guillermo de Cárcer, Esther Seco et Gonzalo Fernández-Miranda, « RINGO C is required to sustain the spindle-assembly checkpoint », Journal of Cell Science, vol. 123, no 15, , p. 2586–2595 (ISSN 0021-9533, DOI 10.1242/jcs.059964, lire en ligne, consulté le ).
- (en) Adriano G. Rossi, Deborah A. Sawatzky, Annemieke Walker et Carol Ward, « Cyclin-dependent kinase inhibitors enhance the resolution of inflammation by promoting inflammatory cell apoptosis », Nature Medicine, vol. 12, no 9, , p. 1056–1064 (ISSN 1546-170X, DOI 10.1038/nm1468).
- (en) Adrian M. Senderowicz, « Flavopiridol: the First Cyclin-Dependent Kinase Inhibitor in Human Clinical Trials », Investigational New Drugs, vol. 17, no 3, , p. 313–320 (ISSN 1573-0646, DOI 10.1023/A:1006353008903, lire en ligne, consulté le ).
- (en) « Complexities in the development of cyclin-dependent kinase inhibitor drugs », Trends in Molecular Medicine, vol. 8, no 4, , S32–S37 (ISSN 1471-4914, DOI 10.1016/S1471-4914(02)02308-0, lire en ligne, consulté le ).
- Pr_Jean-Yves_Piergaclass="abbr_"_title="Professeur"_>Pr_Hervé_Bonnefoi2016">Pr Jean-Yves Pierga et Pr Hervé Bonnefoi, « Nouvelles molécules associées à l’hormonothérapie: vers un changement de stratégie dans le cancer du sein? »
 , (consulté le ).
, (consulté le ). - (en-GB) « ESMO 2016 Press Release: Ribociclib Improves Progression-free Survival in Advanced Breast Cancer », sur www.esmo.org, (consulté le ).