Seliciclib
Le seliciclib (ou roscovitine ou CYC202) est un médicament candidat expérimental de la famille des inhibiteurs pharmacologiques des kinases dépendantes des cyclines (CDK) qui inhibent préférentiellement plusieurs cibles enzymatiques, notamment CDK2, CDK7 et CDK9, qui modifient la phase ou l'état de croissance dans le cycle cellulaire des cellules. Il a été découvert et élaboré en étudiant les propriétés d'une substance naturelle trouvée dans les œufs de l'étoile de mer glaciaire (Marthasterias glacialis), par le laboratoire français ManRos Therapeutics[2], situé dans la ville de Roscoff d'après laquelle le découvreur, Laurent Meijer, baptisa la molécule : roscovitine[3]. Le seliciclib est développé et testé par le laboratoire Cyclacel Pharmaceuticals Inc en Écosse. Il a été testé en Essai clinique, multicentré, randomisé, en double aveugle, contrôlé par placebo.
| Seliciclib | |
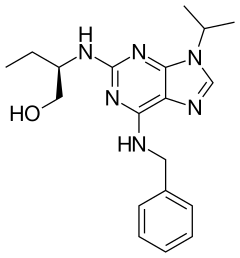
| |
| Identification | |
|---|---|
| Nom UICPA | (2R)-2-{[6-(Benzylamino)-9-(propan-2-yl)-9H-purin-2-yl]amino}butan-1-ol |
| Synonymes |
Roscovitine, CYC202 |
| PubChem | 160355 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H26N6O C=19 |
| Masse molaire[1] | 126,246 ± 0,003 3 g/mol H 20,76 %, N 66,57 %, O 12,67 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le but de cette étude était d'évaluer l'innocuité de doses croissantes de roscovitine administrées par voie orale pendant 4 cycles de 4 jours consécutifs (traitement "on") séparés par une période sans traitement de 3 jours (traitement "off") chez des sujets adultes atteints de mucoviscidose atteints de fibrose kystique, porteuse de 2 mucoviscidoses causant des mutations avec au moins une mutation F508del-CFTR et infectée de façon chronique par la bactérie Pseudomonas aeruginosa.
Cette étude a porté dans un premier temps sur 36 patients atteints de mucoviscidose : 24 traités et 12 témoins[4].
Le seliciclib fait l'objet de recherches pour le traitement cancer bronchique non à petites cellules (CBNPC), de la maladie de Cushing, de la leucémie, du Sida, de la maladie de Parkinson, de l'infection à herpès simplex, de la mucoviscidose[5] et des mécanismes des troubles inflammatoires chroniques.
Le seliciclib est un analogue à la purine 2,6,9-substituée. Sa structure en complexe avec la kinase CDK2 a été déterminée en 1996[6]. Le seliciclib inhibe les kinases CDK2/E, CDK2/A, CDK7 et CDK9[7].
En 2011, 16 études cliniques ont démontré une activité anti-tumorale du médicament et un taux de survie accru sur un panel de 388 malades du cancer du poumon en traitement[8].
Usages
Le seliciclib s'est avéré produire l'apoptose dans les cellules cancéreuses traitées du cancer du poumon non à petites cellules (CBNPC) et d'autres cancers. Il a déjà fait l'objet d'essais cliniques de phase IIa, chez 240 patients atteints de CPNPC, en dose combinée avec les traitements de première et de deuxième ligne existants[7] - [9]. Dans l'essai en cours APPRAISE en 2006, le médicament de recherche fait l'objet d'un essai clinique de phase IIb en monothérapie pour le CPNPC chez les patients de troisième ligne[10]. Les effets secondaires rapportés dans les essais de phase I du seliciclib pour le CBNPC étaient « nausées, vomissements, élévations transitoires de la créatinine sérique et des paramètres de la fonction hépatique et hypokaliémie transitoire »[9].
Le seliciclib fait également l'objet d'essais cliniques pour les lymphomes à cellules B, y compris le myélome multiple. Il a été démontré que la roscovitnie inhibe la transcription dépendante de l'ARN polymérase II et la régulation négative de la protéine MCL1[11] - [12].
Dans le système nerveux, il a été démontré que le seliciclib supprime l'activation microgliale[13] et fournit une certaine neuroprotection dans des modèles animaux d'ischémie cérébrale[14] - [15]. De plus, il augmente l'activité antitumorale du témozolomide dans le traitement du glioblastome multiforme et est considéré comme une option thérapeutique possible pour le gliome[16].
Le seliciclib est également un agent antiviral possible. Il provoque la mort des cellules infectées par le VIH[17] - [18] - [19] et empêche la réplication du virus de l'herpès simplex[20] - [21].
Il a été démontré in vitro que le seliciclib provoque l'apoptose dans les granulocytes neutrophiles[22]. Si ce mécanisme s'avère sûr, fiable et efficace in vivo, le médicament pourrait améliorer le traitement des maladies inflammatoires chroniques telles que la mucoviscidose et l'arthrite. Ceux-ci sont généralement traités avec des glucocorticoïdes qui ont souvent des effets secondaires graves.
Il a été démontré que le seliciclib provoque une activation parthogénétique des œufs. Cependant, il crée des seconds corps polaires anormaux et donc de possibles zygotes aneuploïdes. L'activation des œufs implique généralement des oscillations du calcium, mais cela ne se produit pas avec le seliciclib. Il provoque l'activation de l'œuf en inhibant les protéines kinases, ce qui entraîne l'inactivation du facteur de promotion de la maturation (MPF)[23].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « L'étoile de mer contre la mucoviscidose », Ça m'intéresse, no 462, , p. 43 (lire en ligne)
- « La roscovitine, une molécule aux multiples fonctions », sur Recherche et technologie Flash (consulté le ).
- (en) Laurent Meijer, CHU de Brest, « A Phase II, Dose Ranging, Multicenter, Double-blind, Placebo Controlled Study to Evaluate Safety and Effects of (R)-Roscovitine in Adults Subjects With Cystic Fibrosis, Carrying 2 Cystic Fibrosis Causing Mutations With at Least One F508del-CFTR Mutation and Chronically Infected With Pseudomonas Aeruginosa, a Study Involving 36 CF Patients (24 Treated, 12 Controls). ROSCO-CF. », sur clinicaltrials.gov, (consulté le ).
- (en) Sabrina Noel, Christelle Faveau, Caroline Norez, Christian Rogier, Yvette Mettey et Frédéric Becq, « Discovery of pyrrolo[2,3-b]pyrazines derivatives as submicromolar affinity activators of wild type, G551D, and F508del cystic fibrosis transmembrane conductance regulator chloride channels », Journal of Pharmacology and Experimental Therapeutics, vol. 319, no 1, , p. 349–359 (PMID 16829626, DOI 10.1124/jpet.106.104521).
- (en) Walter Filgueira De Azevedo, Sophie Leclerc, Laurent Meijer, Libor Havlicek, Miroslav Strnad et Sung-Hou Kim, « Inhibition of cyclin-dependent kinases by purine analogues : crystal structure of human cdk2 complexed with roscovitine », European Journal of Biochemistry, vol. 243, nos 1–2, , p. 518–526 (PMID 9030780, DOI 10.1111/j.1432-1033.1997.0518a.x).
- (en) « Cyclacel Begins A Phase IIb Randomized Trial Of Seliciclib For Previously Treated Non-Small Cell Lung Cancer », sur Cyclacel Pharmaceuticals, Inc. (consulté le ).
- (en) « A novel, orally available, CDK (cyclin‐dependent kinase) inhibitor with efficacy in lung cancer & development potential in breast cancer sub‐groups » [PDF], sur cyclacel.com, (consulté le ).
- « Cyclacel Reports Interim Seliciclib Phase IIa Data at 2005 ASCO »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Business Wire,
- (en) « Cyclacel Pharmaceuticals Reports Second Quarter 2006 Financial Results »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Business Wire, .
- (en) « Seliciclib (CYC202, R-Roscovitine) induces cell death in multiple myeloma cells by inhibition of RNA polymerase II-dependent transcription and down-regulation of Mcl-1 », Cancer Research, vol. 65, no 12, , p. 5399–5407 (PMID 15958589, DOI 10.1158/0008-5472.CAN-05-0233).
- (en) Noopur Raje, Shaji Kumar, Teru Hideshima et Aldo Roccaro, « Seliciclib (CYC202 or R-roscovitine), a small-molecule cyclin-dependent kinase inhibitor, mediates activity via down-regulation of Mcl-1 in multiple myeloma », Blood, vol. 106, no 3, , p. 1042–1047 (PMID 15827128, PMCID 1895150, DOI 10.1182/blood-2005-01-0320).
- (en) Tomov, Surchev, Wiedenmann et Döbrössy, « Roscovitine, an experimental CDK5 inhibitor, causes delayed suppression of microglial, but not astroglial recruitment around intracerebral dopaminergic grafts », Experimental Neurology, vol. 318, , p. 135–144 (PMID 31028828, DOI 10.1016/j.expneurol.2019.04.013, lire en ligne)
- (en) Menn, Bach, Blevins et Campbell, « Delayed Treatment with Systemic (S)-Roscovitine Provides Neuroprotection and Inhibits In Vivo CDK5 Activity Increase in Animal Stroke Models », PLOS ONE, vol. 5, no 8, , e12117 (ISSN 1932-6203, PMID 20711428, PMCID 2920814, DOI 10.1371/journal.pone.0012117, Bibcode 2010PLoSO...512117M)
- (en) Rousselet, Létondor, Menn et Courbebaisse, « Sustained (S)-roscovitine delivery promotes neuroprotection associated with functional recovery and decrease in brain edema in a randomized blind focal cerebral ischemia study », Journal of Cerebral Blood Flow & Metabolism, vol. 38, no 6, , p. 1070–1084 (ISSN 0271-678X, PMID 28569655, PMCID 5998998, DOI 10.1177/0271678X17712163)
- (en) Pandey, Ranjan, Narne et Babu, « Roscovitine effectively enhances antitumor activity of temozolomide in vitro and in vivo mediated by increased autophagy and Caspase-3 dependent apoptosis », Scientific Reports, vol. 9, no 1, , p. 5012 (ISSN 2045-2322, PMID 30899038, PMCID 6428853, DOI 10.1038/s41598-019-41380-1, Bibcode 2019NatSR...9.5012P)
- (en) « A novel approach to develop anti-HIV drugs: adapting non-nucleoside anticancer chemotherapeutics », Antiviral Research, vol. 61, no 1, , p. 1–18 (PMID 14670589, DOI 10.1016/j.antiviral.2003.09.004).
- (en) « Potential use of pharmacological cyclin-dependent kinase inhibitors as anti-HIV therapeutics », Curr Pharm Des, vol. 12, no 16, , p. 1949–61 (PMID 16787240, DOI 10.2174/138161206777442083).
- (en) « Antiviral activity of CYC202 in HIV-1-infected cells », J. Biol. Chem., vol. 280, no 4, , p. 3029–42 (PMID 15531588, DOI 10.1074/jbc.M406435200).
- (en) « Roscovitine, a specific inhibitor of cellular cyclin-dependent kinases, inhibits herpes simplex virus DNA synthesis in the presence of viral early proteins », J. Virol., vol. 74, no 5, , p. 2107–20 (PMID 10666240, PMCID 111691, DOI 10.1128/JVI.74.5.2107-2120.2000).
- (en) « Roscovitine inhibits activation of promoters in herpes simplex virus type 1 genomes independently of promoter-specific factors », J. Virol., vol. 78, no 17, , p. 9352–9365 (PMID 15308730, PMCID 506918, DOI 10.1128/JVI.78.17.9352-9365.2004).
- (en) « Cyclin-dependent kinase inhibitors enhance the resolution of inflammation by promoting inflammatory cell apoptosis », Nature Medicine, vol. 12, no 9, , p. 1056–1064 (PMID 16951685, DOI 10.1038/nm1468)
- (en) « The cyclin-dependent protein kinases and the control of cell division », FASEB J, vol. 8, no 14, , p. 1114–1121 (PMID 7958616, DOI 10.1096/fasebj.8.14.7958616).