Herpès
L'herpès est une maladie virale, contagieuse (sexuellement transmissible si l'herpès est HSV2 ou par simple contact buccal si HSV1), et responsable d'affection de la peau, des muqueuses et parfois du système nerveux, caractérisée par des crises d'éruption vésiculeuse de boutons groupés. Ces crises d'une quinzaine de jours sont plus ou moins espacées dans le temps ; elles sont déclenchées par de nombreux facteurs, dont une baisse de l'immunité, souvent par un stress, et parfois par l'exposition au soleil[1] - [2]. La maladie est jugée bénigne chez les sujets en bonne santé[3], mais peut se révéler très sérieuse chez l'immunodéprimé, le nouveau-né ou la femme enceinte.
.jpg.webp)
La flèche indique le bouquet de vésicules, ici sur la lèvre inférieure.
| Causes | Human alphaherpesvirus 1 (en) ou Human alphaherpesvirus 2 (d) |
|---|---|
| Transmission | Transmission par contact (d), transmission aéroportée (d) et transmission placentaire (d) |
| Incubation min | 4 j |
| Incubation max | 12 j |
| Symptômes | Exanthème, fièvre légère (d), phlyctène et adénopathie |
| Médicament | Vidarabine (en), benzocaïne, foscarnet, trifluridine (en), penciclovir (en), valaciclovir, aciclovir, docosanol, acedoben sodium (d) et famciclovir |
|---|---|
| Spécialité | Infectiologie et dermatologie |
| CISP-2 | S71 |
|---|---|
| CIM-10 | A60, B00, G05.1, P35.2 |
| CIM-9 | 054.0, 054.1, 054.2, 054.3, 771.2 |
| DiseasesDB | 5841 33021 |
| eMedicine | 218580 |
| MeSH | D006561 |
![]() Mise en garde médicale
Mise en garde médicale
L'herpès, parfois vécu péniblement, n'est jamais totalement guéri. Il impose donc au porteur de prendre des précautions, y compris hors des périodes de crises où il reste potentiellement contagieux.
Étymologie
Le nom est dérivé du mot grec ἕρπειν (herpein « ramper »), en référence à la propagation des lésions cutanées, impliquant généralement des cloques, observées dans les poussées d'herpès simplex 1 et 2, et de Zona[4].
Vocabulaire spécifique
- La primo-infection herpétique est la toute première infection d'un patient (symptômes muqueux ou cutanés, ou forme asymptomatique), par le virus HSV-1 ou HSV-2. Cette notion est importante car la primo-infection est source d'une excrétion plus importante et plus longue de virions contaminants pour l'entourage du patient et pour lui-même (import par exemple d'un virus produit sur la peau vers l'œil d'une même personne, par elle-même)[5].
- L'infection initiale non primaire est le tout premier « contact infectant symptomatique ou asymptomatique avec le virus HSV-1 ou HSV-2, chez un sujet préalablement infecté par l’autre type viral »[5].
- Les récurrences sont des réactivations virales qui surviennent épisodiquement chez un patient antérieurement infecté par le même type viral[5].
- L'excrétion virale asymptomatique désigne la situation dans laquelle l'organisme produit des virions de HSV-1 ou HSV-2 sans qu'il y ait de symptômes ou lésions visibles (par le patient, ses proches ou son médecin)[5].
- Les réactivations sont des épisodes de réplication du virus (entrecoupés de temps de latence) ; les récurrences peuvent être asymptomatiques ou « cliniques » (symptomatiques)[5].
- La crise herpétique désigne généralement le moment des manifestations visibles de l'infection.
Virus
- Le virus de l'herpès, Herpes simplex virus (HSV), appartient au groupe des alphaherpesviridae et plus précisément à la famille Herpesviridae, qui comprend aussi les virus de la varicelle et du zona, le cytomégalovirus HHV-5 et le virus d'Epstein-Barr.
- Comme tous les Herpesviridae, c'est un virus à ADN double brin classé dans le Groupe I.
- Il en existe deux types :
- le HSV-1, responsable de 95 % des herpès orofaciaux et de bon nombre d'herpès neuroméningés et ophtalmiques. Il est aussi responsable de 20 à 40 % des herpès génitaux par contamination oro-génitale ;
- le HSV-2 responsable principalement de l’herpès génital, et de 5 % des herpès orofaciaux.
- Les HSV sont dermoneurotropes (c'est-à-dire qu'ils ciblent la peau et les tissus nerveux), tout comme le virus proche de la varicelle. Malgré la réponse immunitaire générée par la primo-infection, ils persisteront la vie entière, dans le ganglion de Gasser (pour les manifestations orofaciales), et dans les ganglions sacrés (pour les manifestations anales, génitales et fessières).
Épidémiologie
L'humain est le seul réservoir connu du virus de l'herpès, dont la transmission semble strictement inter-humaine (pour les deux types viraux connus)[6].
L'herpès reste sous-diagnostiqué car souvent asymptomatique. Il est de plus souvent confondu avec une mycose ou une irritation et, la crise ne durant parfois que quelques jours, les patients n'arrivent pas toujours à obtenir un rendez-vous assez tôt avec un médecin.
Les évaluations de prévalence varient significativement selon les pays ou les époques. Ainsi :
- en France une étude Herpimax 2002 a porté sur 4 412 personnes (échantillons collectés en 1996 dans le cadre du programme SU.VI.MAX). Elle a conclu à une séroprévalence moyenne dans la population de 67 % pour le HSV-1 et de 17,2 % pour le HSV-2[7]. Un tiers de la population adulte vivant en France présenterait des symptômes de l'herpès, mais à peine un quart de ces personnes ont vu leur diagnostic confirmé par un médecin[8] ;
- en Australie une étude (2006) a échantillonné 4 000 personnes (en 1999-2000 dans le cadre du programme AusDiab), concluant à une séroprévalence moyenne de 75,7 % pour le HSV-1 et de 12,1 % pour le HSV-2[9] ;
- aux États-Unis une étude (2006) a porté sur 11 508 personnes (échantillons collectés de 1999 à 2004 dans la cohorte NHANES du National Center for Health Statistics. Elle concluait à une séroprévalence moyenne dans la population de 57,7 % pour le HSV-1 et de 17,0 % pour le HSV-2[10].
En mars 2010, les Centers for National Disease notaient une prévalence du HSV-2 restant élevée (16,2 %) plus particulièrement chez les Afro-Américains (39,2 % de prévalence) et les femmes noires (48,0 % de prévalence)[11].
Physiopathologie
Les virus HSV-1 et -2 sont connus depuis longtemps. Ils restent parfois asymptomatiques toute une vie en restant sous forme dormante dans les ganglions nerveux. Ils peuvent aussi brutalement ou répétitivement se manifester sous des formes génitale et faciale, qui se propagent facilement entre sujets ayant des contacts intimes.
La virulence de la primo-infection dépend aussi du type d’herpès ainsi que de sa souche mais aussi de l’âge de l’hôte et de son statut immunitaire. Ainsi la primo-infection est plus spécialement asymptomatique chez le jeune enfant[12]. Normalement, la primo-infection est asymptomatique et est un élément crucial dans la limitation de la réplication du virus ce qui permet généralement l’évitement des symptômes. Cependant, quelques individus peuvent expérimenter une infection primaire avec des vésicules d’herpès gingivo-stomatique[13]. Généralement, l’infection par l’herpès génital, qui peut elle aussi être asymptomatique, peut présenter des lésions génitales ulcérantes accompagnées ou non de symptômes généralisés tels que fièvre et maux de tête[14] - [15]. Une infection herpétique peut mener à un herpès cornéen.
Les infections herpétiques se propagent rarement vers d’autres organes. Généralement, seuls les patients immunodéprimés ou les femmes enceintes peuvent présenter des complications plus graves telles que par exemple une méningite[16] - [17]. Dans les cas de l'herpès 1 ou communément appelé herpès labial, les manifestations sont fréquentes sur le pourtour de la bouche ou autour des narines, mais également à l'intérieur de la bouche, au fond de la gorge, sur les gencives, sur les joues ou sur le front, voire les yeux. Pour l'herpès génital (HSV-2), les manifestations se situent principalement près des organes génitaux. Cependant, il est possible de voir une infection au HSV-1 sur les organes génitaux et une infection HSV-2 dans la région faciale. De plus, la persistance du virus est définitive, on reste porteur du virus dans les ganglions sensitifs jusqu’à sa mort.
La pénétration du virus dans l'organisme se produit à l'occasion d'un contact avec un sujet infecté (même en l'absence de manifestations cutanées visibles) : les virus pénètrent l'hôte quand ils sont déposés sur une brèche cutanéo-muqueuse. Ils se multiplient dans les cellules épithéliales où ils sont responsables d'une dégénérescence cellulaire avec ballonisation aspécifique. Ces mécanismes peuvent être à l'origine des manifestations de primo-infection herpétique. Ils rejoignent ensuite le ganglion nerveux correspondant à la zone infectée, par voie centripète, en « remontant » le long des nerfs sensitifs, selon un mécanisme dit « transport rétrograde axoplasmique »[18] (destiné au transport de protéines ou d'autres molécules dans le neurone[19] et parfois impliqué dans la dégénérescence nerveuse quand des neurotoxiques (plomb par exemple) rempruntent cette voie[20]). Le virus peut circuler rapidement (et dans les deux sens) dans les neurones[21] et passent facilement d'un neurone à un autre[22]. Cependant, les types 1 et 2 du virus Herpes simplex ne se fixent pas au neurone de la même manière[23].
Les récurrences herpétiques se produisent lorsque, en réponse à un stress physique ou psychique variable, les virus regagnent la peau pour s'y développer à nouveau. Ces épisodes sont plus ou moins fréquents d'un individu à l'autre, et d'intensité variable, mais fixes dans leur topographie.
Lors de la primo-infection, le système immunitaire entre en lutte contre le virus, inhibant en partie la réplication du HSV dans le corps humain. Cette première ligne de défense est non spécifique. Elle est en grande partie orchestrée par les macrophages dans les premières heures de l’infection. Le HSV induit la production de INF-α/β et de TNF chez les macrophages. Ces cytokines jouent un rôle d'activateur sur les macrophages eux-mêmes et sur leur production d'espèces réactives de l'oxygène (ERO), qui ont tous deux comme résultat de freiner la prolifération du virus dans les cellules avoisinantes[24]. Cependant, les virus HSV (1 et 2) contournent la défense de l’hôte en inhibant la présentation de l’antigène de surface des cellules hôte infectées. Le virus inhibe l'exposition du CMH1 et donc secondairement l'action des T cytotoxiques. Les virus HSV (1 et 2) s'expriment rapidement après l’invasion de l’hôte, par une protéine ICP47 qui inhibe le transporteur de l'antigène[25], ainsi l'anticorps ne peut pas exécuter son action de reconnaissance.
Manifestations cliniques
La primo-infection est parfaitement asymptomatique dans un cas sur deux (et dans la plupart des primo-infection d'herpès génital, pour les deux types d'herpès)[5]. Dans l'autre moitié des cas, les manifestations consistent souvent en un bouquet de vésicules translucides devenant rapidement jaunâtres et croûteuses avec des sensations de picotements, de brûlures ou de démangeaisons[26]. Des infections de la peau (visage, doigts, fesses) peuvent apparaitre alors qu'aucune atteinte de la muqueuse ne se manifeste[27] - [28]. Certaines lésions sont atypiques et sous-diagnostiquées car confondues avec d’autres dermatoses génitales[29] - [30].
On croyait autrefois que HSV-1 ne causait d'infection que sur la partie supérieure du corps (orofaciale notamment) et que le HSV-2 n'attaquait que la partie inférieure du corps. Cette idée est abandonnée : « HSV-1 et HSV-2 peuvent infecter toute région cutanéo-muqueuse »[5].
Les patients symptomatiques et asymptomatiques ont des taux d'excrétion virale identiques. On ignore encore pourquoi la réactivation du virus tend à être asymptomatique chez certains individus et symptomatiques chez d'autres.
Pour les sujets symptomatiques, le nombre d'occurrences, c’est-à-dire de crises, varie selon les individus et dépend de trois facteurs :
- La force du système immunitaire, qui dépend notamment du stress (menstruations, exposition à des climats extrêmes, à des maladies…) ;
- L'âge après la primo-infection : la gravité et la fréquence des récidives tendent à diminuer avec le temps ;
- Le type d'infection : le HSV-1 est principalement responsable de l'herpès labial, et le HSV-2 de l'herpès génital. Selon l'emplacement des lésions, on classe la fréquence des occurrences dans l'ordre suivant :
- HSV-2 génital : répétitif la première année. Le nombre moyen d'occurrences dans l'année qui suit une primo-infection est de quatre. 20 % des patients ont plus de 10 occurrences par an. Certains patients n'ont eu aucune occurrence[31],
- HSV-1 labial : de une à six fois par an selon les individus,
- HSV-1 génital : le nombre moyen d'occurrences dans l'année qui suit une primo-infection est faible. 40 % des patients n'ont eu aucune occurrence, 50 % une à deux, et 10 % autant d'occurrences que les infections HSV-2 génitale[32],
- HSV-2 labial : particulièrement rare.
Herpès labial

C'est le classique « bouton de fièvre », essentiellement transmis par contact buccal.
La forme la plus connue est la forme labiale (feu sauvage, dans le registre populaire). Elle évolue via plusieurs stades :
- Signes préliminaires : démangeaisons, sensation d'existence d'un léger œdème, rougeurs… ;
- Apparition de papules : la lèvre gonfle plus ou moins localement, parfois durant quelques jours, puis rougit ;
- Mûrissage des papules : les papules deviennent des cloques puis des vésicules transparentes contenant un liquide clair. Les vésicules finissent ensuite par éclater, libérant ainsi le liquide (riche en virus et donc très contaminant) ;
- Dessèchement : après leur éclatement, les vésicules laissent place à des plaies souvent douloureuses (brûlures) puis sèchent assez rapidement pour former des croûtes qui disparaissent en quelques jours.
Un accès d'herpès labial dure de 8 à 15 jours. L'affection est contagieuse en tout temps, mais plus encore quand les lésions sont encore présentes (y compris sous forme de croûtes, qu'il ne faut pas toucher, et qui peuvent saigner légèrement sans que cela ne soit visible).
Encéphalite herpétique
C'est avec l'herpès néonatal la forme la plus grave de l'herpès. Cette encéphalite aiguë nécrosante focale, presque toujours due au HSV-1 (hors infection néonatale), peut survenir à tout âge. Sans traitement rapide la mortalité dépasse 70 % des cas et le risque de séquelles est élevé chez les survivants[5]. Rarement (20 cas décrits en France de 1966 à 1998) il s'agit d'une complication de l'herpès chez la femme enceinte.
Elle nécessite donc un diagnostic et un traitement urgents[5].
Hépatite herpétique
C'est l'une des complications possibles (mais rares) de l'herpès de la femme enceinte[5].
Elle est généralement anictérique (sans jaunisse) mais caractérisée par une insuffisance hépato-cellulaire majeure.
Elle doit être évoquée face à toute hépatopathie de la femme enceinte (après diagnostique différentiel ayant éliminé - surtout au troisième trimestre de grossesse - une stéatose hépatique aiguë gravidique et/ou une cholestase gravidique[33].
Le cas particulier de l'herpès néonatal
C'est avec l'encéphalite herpétique la forme la plus grave de l'herpès. Sans traitement rapide la mortalité est élevée et des séquelles graves sont inévitables chez les survivants[5] ;
Il nécessite un diagnostic et un traitement urgents[5].
Chez l'enfant jusqu'à un an
Selon les pédiatres et les publications de la Croix verte allemande (de) (DGK), une infection par le virus de l'herpès est particulièrement dangereuse pour les bébés de moins de six semaines[34] - [35]. Les nouveau-nés dont la mère est déjà infectée par le virus herpès simplex reçoivent les anticorps maternels spécifiques de la classe des immunoglobulines G (IgG) par le placenta dès la 34e semaine de grossesse. Cette protection naturelle peut protéger contre une infection herpétique ou au moins en réduire la gravité[35].
Plus généralement, il est conseillé d'être vigilant contre les infections d'herpès tout au long de la première année de vie[36].
Moyens diagnostiques
Ils sont essentiellement utilisés en cas d'herpès génital, d'herpès de la femme enceinte ou d'herpès du nouveau-né.
Les examens de laboratoire se basent sur deux types de prélèvements : échantillon de lésion (vésicules herpétiques), ou prise de sang.
Pour l'herpès oro-facial, l'examen clinique visuel est en général suffisant.
Prélèvements de lésions
Les lésions prélevées par un écouvillonnage pouvant être analysées par différentes techniques :
- Culture virale
C'est le moyen de référence mais elle doit être pratiquée par un laboratoire spécialisé, ce qui nécessite parfois le transport du prélèvement qui doit se faire dans les plus brefs délais et être maintenu réfrigéré ou congelé si le délai de transport dépasse 36 heures.
La sensibilité est comprise entre 60 et 100 % elle diminue en fonction de la zone prélevée et du temps écoulé entre l'apparition des vésicules et le prélèvement.
Un bon prélèvement doit être fait dans une vésicule fraîche au contenu non troublé, moins de 48h après son apparition.
C'est une technique rapide sa sensibilité est de 80 à 90 % et sa spécificité de 85 à 95 %
C'est une technique très rapide mais elle nécessite la lecture au microscope à fluorescence par un personnel spécialisé et averti. La sensibilité est de 75 à 100 % et la spécificité de 95 %.
- Par PCR
Les délais sont plus longs (24 à 48 heures) et nécessitent un transport dans un laboratoire spécialisé.
C'est une technique très sensible et spécifique utilisable même sur un prélèvement de mauvaise qualité ou mal conservé.
Toutefois son coût élevé empêche son utilisation en routine.
- Par cytodiagnostic de Tzanck
L'intérêt de cette ancienne technique est limité aux situations où une autre technique ne peut être utilisée. Elle est peu sensible (60 %) et peu spécifique car elle ne permet pas de distinguer l'herpès de la varicelle et du zona.
Sérologies
La sérologie herpétique est principalement indiquée si l’examen direct est négatif et en l’absence de lésions, ou pour établir le diagnostic du HSV-1 ou du HSV-2.
On distingue deux types de sérologies :
- la sérologie non spécifique de type, qui détecte les anticorps communs à HSV-1 et HSV-2.
Elle présente d’excellentes spécificité et sensibilité. Elle révèle la présence d’anticorps IgG ou IgM dirigés contre l’un ou l’autre des deux virus, mais ne permet pas de spécifier le type de virus en cause ; - la sérologie spécifique de type permet de distinguer les anticorps anti-HSV-1 et anti-HSV-2. Les trousses commercialisées présentent, selon la population étudiée, une sensibilité et une spécificité d’environ 90 à 100 %. Elle n’est pas inscrite à la nomenclature des actes de biologie médicale.
La sérologie spécifique de HSV-1 ne permet pas d’établir un diagnostic d’infection génitale ancienne à HSV-1. En revanche, une séropositivité pour HSV-2 permet généralement d’établir le diagnostic d’herpès génital à HSV-2[37].
Une réaction sérologique peut être négative alors que le sujet est atteint d'herpès car 1 à 3 mois sont nécessaires à la séroconversion.
Traitement
Deux formes de traitements existent à ce jour, à base de crèmes à appliquer, de médicaments antiviraux. Les traitements sont d’autant plus efficaces qu’ils sont administrés très précocement dès l’apparition des tout premiers signes. Plus le traitement antiviral sera pris tôt, plus les manifestations cliniques seront limitées en intensité et en durée. Les antiviraux empêchent le virus de se reproduire et n’agissent que dans les cellules infectées par le virus.
Précautions de base
Des précautions d’hygiène sont indispensables pour limiter le risque de contamination, et doivent être respectées tant par les malades que par l'entourage, même en l'absence de crise visible. Ces précautions aident également à limiter le risque d'auto-inoculation, qui peut amener le virus dans des zones très sensibles (herpès génital ou oculaire, aux conséquences graves).
Ces mesures peuvent sembler lourdes au quotidien : elles restent pourtant le seul moyen d'éviter la maladie, qui peut dans certains cas avoir des conséquences dramatiques (aucun vaccin ou médicament n'éradiquant le virus). En effet, le simple bouton de fièvre peut évoluer vers des formes plus graves, par simple progression du virus, ou auto-contamination d'autres zones du corps. Beaucoup de gens ignorent ces précautions ou ne veulent pas les mettre en pratique, ce qui explique que le virus soit si répandu.
Certaines personnes sont plus à risque que d'autres : immunodéprimé, nouveau-né, femme enceinte, porteurs d'une dermatite atopique.
Toute personne atteinte, même si la maladie se limite pour le moment à de simples boutons de fièvre, est contaminée et doit prendre les précautions suivantes pour protéger son entourage :
- se laver soigneusement et régulièrement les mains, surtout après tout contact avec la lésion (même sans gratter) ; le faire avec encore plus d'attention si on va toucher de la nourriture ou de la vaisselle, une autre personne ou ses affaires personnelles (particulièrement des affaires d'hygiène) bien que le virus ne conserve son pouvoir infectant que 2 heures sur un support sec[38] ;
- éviter d'utiliser les objets ayant été en contact direct avec la salive ou la bouche d'une personne infectée (brosse à dent notamment) ;
- éviter les contacts sexuels oro-génitaux pour ne pas transmettre un herpès labial au niveau génital ;
- individualiser le linge de toilette ;
- ne pas se toucher les yeux (un geste machinal rapide suffit pour la transmission), et bien sûr, ne pas humecter ses lentilles de contact avec sa salive (risque très direct de contamination) ;
- ne pas gratter les lésions, et plus généralement, ne jamais toucher la zone infectée ;
- si le geste est machinal, prendre l'habitude de ne plus toucher les lésions, et se nettoyer les mains (ongles compris) chaque fois qu'on le fait ;
- maintenir les parties atteintes aussi propres et sèches que possible, et ne pas les serrer sous des vêtements trop près du corps ;
- éviter tout contact avec un nouveau-né (son système immunitaire est encore fragile) ;
- en cas de bouton de fièvre (même débutant ou presque terminé), éviter d'embrasser, y compris sur les joues, et ce jusqu'à ce que les lésions soient complètement sèches.
Traitements médicamenteux
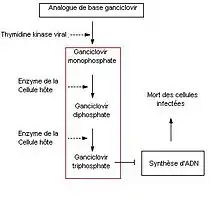
Les traitements actuels ne guérissent pas la maladie mais réduisent la charge virale en période de crise. Les médicaments utilisés sont des antiviraux dont quelques exemples sont l'aciclovir, et sa prodrogue le Valaciclovir, le famciclovir et le cidofovir.
Le Valaciclovir (Zelitrex, Valtrex ou autre générique) pris en comprimé dans les 30 minutes suivant l'apparition des premiers picotements, permet d'éviter l'apparition de toute lésion de l'herpès labial[39] - [40] - [41] - [42].
Le mécanisme d'action : les antiviraux sont des analogues de base qui sont incorporés par les cellules infectées par les virus. La thymidine kinase des virus est moins spécifique que la thymidine kinase des cellules humaines et permet donc de phosphoryler des analogues de bases. Par la suite, ces analogues de bases entrent en compétition avec les bases phosphatées de la cellule et une fois incorporés, les analogues de bases inhibent l'ADN polymérase. Exemple en absence d'infection, l'aciclovir n'est pas transformé en aciclovir monophosphate car il y a absence de TK virale et donc les étapes ultérieures ne sont pas possibles. Cependant, certains HSV sont résistants aux traitements contre les antiviraux. L'une des causes de résistance est la mutation du gène de la thymidine kinase chez l'HSV[43].
D'autres molécules à action anti-virale sont en cours de développement, comme le pritelivir.
Autres
Le traitement par fréquences sur micro-courants de l’herpès labial consiste à appliquer une électrode à la nuque et une autre sur la lèvre. Les fréquences utilisées viseront les différentes mutations du virus, elles sont appliquées par couple : 230Hz/430Hz, 236Hz/435Hz et 687Hz et 573Hz. Le traitement nécessite habituellement 2 séances de 2 heures. Il est observé que les lésions disparaissent à la fin du traitement ou dans les 24 heures suivantes[44] - .
Vaccin
Aucun vaccin n'existe actuellement contre l'herpès, malgré de nombreux essais.
Recherches
Traitements alternatifs
- La glycyrrhizine, acide glycyrrhizique, principe actif de la réglisse, agirait contre le virus de l'herpès chez la souris[45].
- L'émodine aurait un effet anti-HSV chez la souris[46]. L’émodine peut être extraite de diverses plantes dont la rhubarbe ornementale (Rheum palmatum) ou la renouée du Japon (Fallopia japonica ou Polygonum cuspidatum).
- Le xylomannane, un polysaccharide sulfaté issu d'algues rouges comme Nothogenia fastigiata, aurait un effet sur la réplication de l'HSV-1 et l'HSV-2[47]. De plus, cette molécule est capable de diminuer l’adsorption du virus sur ses cellules hôtes. Son activité semblerait également plus efficace que l'héparine[48].
- Le galactofucane sulfaté, extrait d'un grand nombre d'algues brunes (notamment présent chez Undaria pinnatifida, le « wakamé » communément consommé en Asie), présenterait potentiellement une activité anti-herpétique. En effet, une étude épidémiologique menée sur différentes communautés à travers le monde a révélé une importante différence de séroprévalence du virus HSV-2, notamment entre des femmes d'origine afro-américaine et japonaise, chez lesquelles celui-ci était respectivement de 50 % et 7 %[49] - [50]. Malgré l'absence de résultats cliniques à ce jour, le lien entre l'ingestion régulière de macroalgues marines contenant ces polysaccharides sulfatés et le faible taux de prévalence de ce virus chez les populations japonaises, a été fortement suspecté. Des résultats obtenus lors de précédentes études ont montré que des fractions aqueuses de Undaria pinnatifida ainsi que des extraits de galactofucanes sulfatés, partiellement purifiés, avaient une activité anti-herpétique in vitro sur toutes les souches virales testées, activité par ailleurs plus forte contre les souches HSV-2 en comparaison avec les souches HSV-1[51] - [52]. Le mode d'action de ces extraits a été identifié comme étant une inhibition de l'adsorption du virus sur la membrane de la cellule hôte. En comparaison, les souches traitées à l'acyclovir, molécule largement utilisée actuellement comme anti-herpétique, s’avéraient pour un grand nombre d'entre elles être résistantes à ce traitement.
Lien entre maladie d'Alzheimer et herpès
Dans les années 90, la microbiologiste Ruth Itzhaki[53] de l'université de Manchester est l’une des premières à établir un lien entre herpès et maladie d'Alzheimer. Dans une étude de 1997, elle découvre que chez les "malades d’Alzheimer porteurs de la mutation génétique de l’ApoE4[54]", le virus HSV-1 est "présent dans leur cerveau dans 60% des cas"[55].
Dans une étude menée en 2018 elle confirme ce lien entre certains virus de l'Herpès et la maladie d'Alzheimer[56].
En 2022 des chercheurs britanniques et américains publient dans la revue Journal of Alzheimer’s Disease[57], leur hypothèse selon laquelle "le virus de la varicelle-zona (VZV) et le virus de l’herpès simplex (HSV), pourraient être impliqués dans le déclenchement des premiers stades de la maladie"[58].
Notes et références
- Balasubramaniam, R; Kuperstein, AS; Stoopler, ET (April 2014). "Update on oral herpes virus infections". Dental clinics of North America. 58 (2): 265–80. doi:10.1016/j.cden.2013.12.001. .
- Elad S, Zadik Y, Hewson I, et al. (August 2010). "A systematic review of viral infections associated with oral involvement in cancer patients: a spotlight on Herpesviridea". Support Care Cancer. 18 (8): 993–1006. doi:10.1007/s00520-010-0900-3. .
- Prescrire, « Le bouton de fièvre Fiches Infos-Patients Prescrire », sur www.prescrire.org, (consulté le ).
- TSL Beswick, « The Origin and the Use of the Word Herpes », Med Hist, vol. 6, no 3, , p. 214–232 (PMID 13868599, PMCID 1034725, DOI 10.1017/S002572730002737X)
- Haute Autorité de santé HAS (2016) Un argumentaire de la HAS sur le diagnostic des infections liées aux virus de l'herpès et de la varicelle, validé par le Collège de la Haute Autorité de santé en mai 2016
- Conférence de consensus : Prise en charge de l'herpès cutanéo-muqueux chez le sujet immunocompétent (manifestations oculaires exclues) mercredi 7 novembre 2001 Espace Landowski - Boulogne ANAES
- (en) Malkin JE, Morand P, Denis Malvy, Ly TD, Chanzy B, de Labareyre C, El Hasnaoui A, Hercberg S, « Seroprevalence of HSV-1 and HSV-2 infection in the general French population », Sex Transm Infect, vol. 78, no 3, , p. 201-3. (PMID 12238654, PMCID PMC1744464, lire en ligne [html])
- Sondage effectué en 2005 par téléphone auprès de plus de 10 000 Français par l'Institut IPSOS pour l'Association Herpès
- (en) Cunningham AL, Taylor R, Taylor J, Marks C, Shaw J, Mindel A. « Prevalence of infection with herpes simplex virus types 1 and 2 in Australia: a nationwide population based survey » Sex Transm Infect. 2006;82(2):164-8.
- (en)Trends in Herpes Simplex Virus Type 1 and Type 2 Seroprevalence in the United States
- (en)CDC Analysis of National Herpes Prevalence
- (en) Cesario TC, Poland JD, Wulff H, Chin TD, Wenner HA. « Six years experience with herpes simplex virus in a children's home » Am J Epidemiol. 1969;90(5):416-22.
- (en) McMillan JA, Weiner LB, Higgins AM, Lamparella VJ. « Pharyngitis associated with herpes simplex virus in college students » Pediatr Infect Dis J. 1993;12:280–4.
- (en) Corey, L. Herpes simplex virus. In: Mandell GL, Bennett JE and Dolin R, editors Principles and practice of infectious diseases. Fifth. Vol. 125. Churchill Livingstone; 2000. p. 1564–1580.
- (en) Prober CG, Hensleigh PA, Boucher FD, Yasukawa LL, Au DS, Arvin AM. « Use of routine viral cultures at delivery to identify neonates exposed to herpes simplex virus » N Engl J Med. 1988;318:887–91.
- (en) Flewett TH, Parker RG, Philip WM. « Acute hepatitis due to Herpes simplex virus in an adult » J Clin Pathol. 1969;22:60–6.
- (en) Hillard P, Seeds J, Cefalo R. « Disseminated herpes simplex in pregnancy: two cases and a review » Obstet Gynecol Surv. 1982;37:449–53.
- Kristensson K, Lycke E, Röyttä M, Svennerholm B & Vahlne A (1986) Neuritic transport of herpes simplex virus in rat sensory neurons in vitro. Effects of substances interacting with microtubular function and axonal flow [nocodazole, taxol and erythro-9-3-(2-hydroxynonyl) adenine]. Journal of General Virology, 67(9), 2023-2028.
- Kristensson K & Olsson Y (1971) Retrograde axonal transport of protein. Brain research, 29(2), 363-365.
- Yamamoto T, Iwasaki Y & Konno H (1984) Retrograde axoplasmic transport of Adriamycin An experimental form of motor neuron disease?. Neurology, 34(10), 1299-1299.
- Smith G.A, Gross S.P & Enquist L.W (2001) Herpesviruses use bidirectional fast-axonal transport to spread in sensory neurons. Proceedings of the National Academy of Sciences, 98(6), 3466-3470.
- Martin, X., & Dolivo, M. (1983). Neuronal and transneuronal tracing in the trigeminal system of the rat using the herpes virus suis. Brain research, 273(2), 253-276.
- Vahlne, A., Svennerholm, B., Sandberg, M., Hamberger, A., & Lycke, E. (1980). Differences in attachment between herpes simplex type 1 and type 2 viruses to neurons and glial cells. Infection and immunity, 28(3), 675-680.
- (en) Svend Ellermann-Eriksen « Macrophages and cytokines in the early defence against herpes simplex virus » Virol J. 2005 Aug 3;2:59
- Richard-A. Goldsby, Thomas-J. Kindt, Barbara-A. Osborne Immunologie : Le cours de Janis Kuby avec questions de révision p. 428
- Guillaume J.-C., Lebrun-Vignès B., « Herpès », sur http://www.therapeutique-dermatologique.org/, (consulté le )
- Société française de microbiologie (2015) Référentiel en microbiologie médicale. Paris: SFM
- Agence nationale d'accréditation et d'évaluation en santé, Société française de dermatologie (2001) Prise en charge de l’herpès cutanéo-muqueux chez le sujet immunocompétent (manifestations oculaires exclues). Conférence de consensus. Paris : ANAES| URL:http://www.has-sante.fr/portail/upload/docs/application/pdf/herpes_long.pdf
- Société des obstétriciens et gynécologues du Canada (2008). Directive clinique sur la prise en charge du virus de l’herpès simplex pendant la grossesse. J. Obstet. Gynaecol. Can. ;30(6):520 - 6
- Patel R, Alderson S, Geretti A, Nilsen A, Foley E, Lautenschlager S , et al. (2011) European guideline for the management of genital herpes, 2010. Int J STD AIDS ;22(1):1 - 10
- ANAES, 2001
- (en) Wald A, Zeh J, Selke S, Ashley RL, Corey L. « Virologic characteristics of subclinical and symptomatic genital herpes infections » N Engl J Med. 1995;333(12):770-5.
- Lecat M. (2002) Herpès cutanèo-muqueux chez l'immunocompétent et grossesse. Ann Dermatol Venereol;129(4 Pt 2):523-32
- (de-CH) « Herpes: Wie gefährlich ist er für Babys und Kinder? », sur www.windeln.ch (consulté le )
- (de) « Wie gefährlich ist Herpes fürs Baby? », sur Zava - DrEd (consulté le )
- « Schwer kranker Säugling: Hirnentzündung nach Herpes-Infektion », Spiegel Online, (lire en ligne, consulté le )
- Jean-Elie Malkin « Quelle place pour la sérologie herpétique dans l’herpès génital ? » La Presse Médicale 2008;37(9):1251-60.
- Alimentation et l'herpès - herpes una buena alimentación
- M. Kusumoto, K. Ueno, A. Oda et K. Takeda, « Effect of fluvoxamine on the pharmacokinetics of mexiletine in healthy Japanese men », Clinical Pharmacology and Therapeutics, vol. 69, no 3, , p. 104–107 (ISSN 0009-9236, PMID 11240973, DOI 10.1067/mcp.2001.113182, lire en ligne, consulté le )
- Leonid Benjamin Trost, Wilma Fowler Bergfeld et Ellen Calogeras, « The diagnosis and treatment of iron deficiency and its potential relationship to hair loss », Journal of the American Academy of Dermatology, vol. 54, no 5, , p. 824–844 (ISSN 1097-6787, PMID 16635664, DOI 10.1016/j.jaad.2005.11.1104, lire en ligne, consulté le )
- (en-US) « STD Facts - Genital Herpes », sur www.cdc.gov, (consulté le )
- (en) « Valacyclovir: MedlinePlus Drug Information », sur medlineplus.gov (consulté le )
- (en) Kening Wang, Gowtham Mahalingam, Susan E. Hoover, Erik K. Mont, Steven M. Holland, Jeffrey I. Cohen, and Stephen E. Straus « Diverse Herpes Simplex Virus Type 1 Thymidine Kinase Mutants in Individual Human Neurons and Ganglia » J Virol. 2007;81(13):6817–26.
- Carolyn R. McMakin, Frequency-specific microcurrent in pain management, Churchill Livingstone Elsevier, (ISBN 978-0-443-06976-5 et 0-443-06976-X, OCLC 502393267, lire en ligne)
- (en) Sekizawa T, Yanagi K, Itoyama Y. « Glycyrrhizin increases survival of mice with herpes simplex encephalitis » Acta Virol. 2001 Feb;45(1):51-4.
- (en) Xiong HR, Luo J, Hou W, Xiao H, Yang ZQ. « The effect of Emodin; an anthraquinone derivative extracted from the roots of Rheum tanguticum; against Herpes Simplex Virus in vitro and in vivo » J Ethnopharmacol. 2011 Jan 27;133(2):718-23. Epub 2010 Nov 2.
- (en) Damonte E, Neyts J, Pujol CA, Snoeck R, Andrei G, Ikeda S, Witvrouw M, Reymen D, Haines H, Matulewicz MC. et al., « Antiviral activity of a sulphated polysaccharide from the red seaweed Nothogenia fastigiata », Biochem Pharmacol, vol. 47, no 12, , p. 2187-92. (PMID 8031312)
- (en) Ghosh T, Pujol CA, Damonte EB, Sinha S, Ray B, « Sulfated xylomannans from the red seaweed Sebdenia polydactyla: structural features, chemical modification and antiviral activity », Antivir Chem Chemother, vol. 19, no 6, , p. 235-42. (PMID 19641232)
- (en) Cooper R, Dragar C, Elliot K, Fitton JH, Godwin J, Thompson K, « GFS, a preparation of Tasmanian Undaria pinnatifida is associated with healing and inhibition of reactivation of Herpes », BMC Complement Altern Med, no 2, , p. 11 (PMID 12443533, PMCID PMC139995, DOI 10.1186/1472-6882-2-11, lire en ligne [html])
- (en) Nahmias AJ, « Sero-epidemiological and -sociological patterns of Herpes simplex virus infection in the world », Scandinavian journal of infectious diseases,
- (en) Thompson KD, « Anti-viral activity of Tasmanian seaweed extracts against clinical strains of Herpes simplex virus (HSV) », Abstract. 18th Annual Clinical Virology Symposium,
- (en) Thompson KD, « The mode of action of two Tasmanian seaweed extracts against Herpes simplex virus (HSV) », Abstract. 27th International Herpes virus workshop conference,
- (en) « Ruth Itzhaki », sur The Conversation (consulté le )
- (en) « Professor Ruth Itzhaki speaks on her research into the potential links between Alzheimer's and herpes », sur Professor Ruth Itzhaki speaks on her research into the potential links between Alzheimer's and herpes (consulté le )
- https://www.fondation-alzheimer.org/herpes-et-si-la-maladie-dalzheimer-etait-dorigine-virale/
- (en) Ruth Itzhaki et Richard Lathe, « Herpes Viruses and Senile Dementia : First Population Evidence for a Causal Link », Journal of Alzheimer's Disease, vol. 64, no 2,
- https://pubmed.ncbi.nlm.nih.gov/35754275/
- https://www.femmeactuelle.fr/sante/news-sante/maladie-dalzheimer-ces-deux-virus-pourraient-declencher-son-apparition-2139113
Annexes
Article connexe
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :