Peptide de pénétration cellulaire
Un peptide de pénétration cellulaire (CPP) est un peptide court pouvant traverser la membrane plasmique d'une cellule pour atteindre le cytoplasme de cette dernière. Lorsqu'ils sont liés à un tel peptide, de manière covalente ou non, une protéine de fusion, un acide nucléique ou une nanoparticule peuvent ainsi franchir la membrane plasmique et pénétrer dans la cellule[1] - [2] - [3]. Ceci permet par exemple d'introduire des cytostatiques, des antiviraux, des produits de contraste, voire des boîtes quantiques dans des cellules vivantes[4]. Cette propriété a été découverte en 1988 en observant que la protéine Tat (en) du VIH est absorbée par différents types de cellules en culture cellulaire[5]. D'autres exemples de telles protéines ont par la suite été observés[6]. L'intérêt de tels peptides est notamment de permettre l'absorption cellulaire de protéines polycationiques telles que des anticorps anti-ADN[7] ou des histones[8], ce qui est sinon impossible.
Les peptides de pénétration cellulaire présentent généralement deux types de séquences : il peut s'agit d'un peptide polycationique avec une séquence riche en résidus d'acides aminés chargés positivement comme la lysine ou l'arginine, ou bien d'un peptide amphiphile avec une séquence faisant alterner des résidus polaires électriquement chargés et des résidus apolaires hydrophobes. Un troisième type est dit hydrophobe et ne contient que des résidus apolaires électriquement peu chargés ou hydrophobes qui sont déterminants pour l'absorption cellulaire[9] - [10].
On a par ailleurs observé que les papillomavirus, comme le papillomavirus humain, utilisent des peptides de pénétration cellulaire pour franchir le système endomembranaire une fois parvenus à l'intérieur de la cellule, ce qui leur permet d'atteindre le noyau[11].
Mécanismes de pénétration cellulaire
Les peptides de pénétration cellulaire présentent des tailles, des séquences et des charges électrique variables, mais tous ont la particularité de traverser la membrane plasmique des cellules et de faciliter le transfert de diverses molécules dans le cytoplasme ou dans des organites. Il n'y a pas de consensus sur le mécanisme de la translocation membranaire de ces peptides, qui sont un domaine de recherches actives[12] - [13]. Les théories à ce sujet peuvent être classées en trois principaux types de mécanismes : l'entrée par pénétration directe à travers la membrane, l'entrée par endocytose, et la translocation à travers une structure temporaire.
Le fait que les peptide de pénétration cellulaire puissent permettre à une grande diversité de molécules de franchir la membrane plasmique les rend aptes à de nombreuses applications en médecine, comme systèmes d'administration de médicaments pour traiter diverses maladies, y compris des cancers, pour administrer des antiviraux, ou encore pour faire entrer des produits de contraste à l'intérieur des cellules pour le marquage de leurs structures internes ; de tels produits de contraste sont par exemple la protéine fluorescente verte, les produits de contraste pour IRM, ou encore des boîtes quantiques[4].
Pénétration directe à travers la membrane plasmique
La majorité des études les plus anciennes suggéraient que la translocation des peptides de pénétration cellulaire polycationiques à travers les membranes biologiques était le fait d'un processus cellulaire qui ne requiert pas d'énergie. On pensait que la translocation pouvait se produire à 4 °C en impliquant très certainement une interaction électrostatique directe avec les phospholipides, chargés négativement. Plusieurs modèles ont été proposés pour expliquer les mécanisme biophysique à l'œuvre dans un tel processus ne requérant pas d'apport énergétique. Bien que les peptides de pénétration cellulaire induisent des effets directs sur les propriétés biophysiques des membranes biologiques, l'observation d'éléments de fixation lors de l'utilisation de protéines marquées par fluorescence a conduit à revoir les mécanismes alors proposés[14]. Ces études suggérèrent que le mode de translocation repose davantage sur l'endocytose.
La pénétration directe a été proposée pour la protéine Tat (en). La première étape dans ce modèle est une interaction entre la membrane et la protéine de fusion Tat non repliée, ce qui a pour effet de rompre suffisamment la membrane pour laisser passer la protéine de fusion, qui se replierait ensuite une fois internalisée à l'aide d'un système chaperon. Ce mécanisme n'a pas fait consensus, et d'autres mécanismes ont été proposés, impliquant une endocytose à l'aide de clathrine[15] - [16].
Bien d'autres mécanismes d'absorption cellulaire de tels peptides ont été proposés, notamment la formation transitoire de pores[17] - [18] - [19] - [20] - [21]. Ces mécanismes font intervenir des interactions fortes entre les peptides de pénétration cellulaire d'une part et les groupes phosphate des deux feuillets de la bicouche lipidique d'autre part, l'insertion de chaînes latérales d'arginine qui entraînent la nucléation d'un pore transitoire dans la membrane, et enfin la translocation du peptide par diffusion sur la surface du pore. Ces mécanismes expliquent comment la coopération entre peptides, la charge électrique fortement positive et notamment les groupes guanidinium, contribuent à l'absorption.
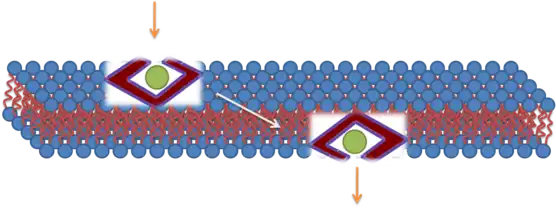 Représentation schématique d'une translocation transmembranaire par pénétration directe.
Représentation schématique d'une translocation transmembranaire par pénétration directe.
Pénétration par endocytose
L'endocytose est le processus d'ingestion cellulaire d'une particule par lequel la membrane plasmique se replie en formant une invagination qui se referme en formant une vésicule dans laquelle est enfermée la particule à internaliser. La plupart des études sont menées par fluorescence ou à l'aide d'inhibiteurs d'endocytose. La préparation de ces échantillons est cependant susceptible d'altérer les informations relatives à l'endocytose. On a pu montrer que l'internalisation d'analogues du transportane ou de la pénétratine, riches en arginine comme la protéine Tat, est un processus distinct de la translocation[22] et qui consomme de l'énergie[23]. Il est amorcée par des polyarginines interagissant avec le sulfate d'héparane de protéoglycanes[24]. La protéine Tat est internalisée par une forme d'endocytose appelée macropinocytose[25] - [26].
S'il a été montré que des mécanismes d'endocytose interviennent dans l'internalisation des peptides de pénétration cellulaire, on a également proposé que différents mécanismes puissent intervenir en même temps, comme le suggère le comportement de la pénétratine et du transportane, qui fait intervenir simultanément des mécanismes d'endocytose et de pénétration directe par translocation[27] - [28].
Translocation par formation d'une structure transitoire
Ce mécanisme repose sur la formation de micelles inversées dans les membranes plasmiques à traverser. Les micelles inversées sont des agrégats de tensioactifs colloïdaux dans lesquels les groupes polaires sont orientés vers l'intérieur et les groupes lipophiles sont orientés vers l'extérieur au contact du solvant. Selon ce modèle, un dimère de pénétratine se lie à des phospholipides chargés négativement, ce qui conduit à la formation d'une micelle inversée au sein de la bicouche lipidique. Cette micelle permet à la pénétratine de baigner dans un milieu hydrophile pendant qu'elle franchit le milieu lipidique de la membrane[29] - [30] - [31]. Ce mécanisme demeure néanmoins débattu car la distribution de la pénétratine de part et d'autre de la membrane n'est pas symétrique, ce qui engendre un champ électrique susceptible d'entraîner un phénomène d'électroporation lorsque la concentration de pénétratine à l'extérieur de la membrane atteint un seuil critique.
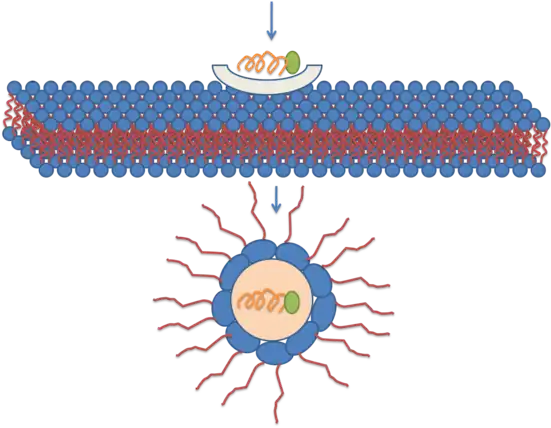 Représentation schématique d'une translocation transmembranaire par micelle inversée.
Représentation schématique d'une translocation transmembranaire par micelle inversée.
Notes et références
- (en) Francesca Milletti, « Cell-penetrating peptides: classes, origin, and current landscape », Drug Discovery Today, vol. 17, nos 15-16, 2012-08-xx, p. 850–860 (DOI 10.1016/j.drudis.2012.03.002, lire en ligne, consulté le )
- (en) Erez Koren et Vladimir P. Torchilin, « Cell-penetrating peptides: breaking through to the other side », Trends in Molecular Medicine, vol. 18, no 7, 2012-07-xx, p. 385–393 (DOI 10.1016/j.molmed.2012.04.012, lire en ligne, consulté le )
- (en) Ewerton Cristhian Lima de Oliveira, Kauê Santana, Luiz Josino et Anderson Henrique Lima e Lima, « Predicting cell-penetrating peptides using machine learning algorithms and navigating in their chemical space », Scientific Reports, vol. 11, no 1, 2021-12-xx, p. 7628 (ISSN 2045-2322, PMID 33828175, PMCID PMC8027643, DOI 10.1038/s41598-021-87134-w, lire en ligne, consulté le )
- (en) Kelly M. Stewart, Kristin L. Horton et Shana O. Kelley, « Cell-penetrating Peptides as Delivery Vehicles for Biology and Medicine », Organic & Biomolecular Chemistry, vol. 6, no 13, , p. 2242-2255 (PMID 18563254, DOI 10.1039/b719950c, lire en ligne)
- (en) Kylie M. Wagstaff et David A. Jans, « Protein Transduction: Cell Penetrating Peptides and Their Therapeutic Applications », Current Medicinal Chemistry, vol. 13, no 12, , p. 1371-1387 (PMID 16719783, DOI 10.2174/092986706776872871, lire en ligne)
- (en) Masahiro Okuyama, Heike Laman, Sarah R. Kingsbury, Cristina Visintin, Elisabetta Leo, Kathryn Leigh Eward, Kai Stoeber, Chris Boshoff, Gareth H. Williams et David L. Selwood, « Small-molecule mimics of an α-helix for efficient transport of proteins into cells », Nature Methods, vol. 4, no 2, , p. 153-159 (PMID 17220893, DOI 10.1038/nmeth997, lire en ligne)
- (en) Alexandre Avrameas, Thérèse Ternynck, Faridabano Nato, Gérard Buttin et Stratis Avrameas, « Polyreactive anti-DNA monoclonal antibodies and a derived peptide as vectors for the intracytoplasmic and intranuclear translocation of macromolecules », Proceedings of the National Academy of Sciences of the United States of America, vol. 95, no 10, , p. 5601-5606 (PMID 9576929, PMCID 20424, DOI 10.1073/pnas.95.10.5601, JSTOR 45132, Bibcode 1998PNAS...95.5601A, lire en ligne)
- (en) Elana Hariton-Gazal, Joseph Rosenbluh, Adolf Graessmann, Chaim Gilon et Abraham Loyter, « Direct translocation of histone molecules across cell membranes », Journal of Cell Science, vol. 116, no 22, , p. 4577-4586 (PMID 14576351, DOI 10.1242/jcs.00757, lire en ligne)
- (en) Francesca Milletti, « Cell-penetrating peptides: classes, origin, and current landscape », Drug Discovery Today, vol. 17, nos 15-16, , p. 850-860 (PMID 22465171, DOI 10.1016/j.drudis.2012.03.002, lire en ligne)
- (en) Sofie Stalmans, Evelien Wynendaele, Nathalie Bracke, Bert Gevaert, Matthias D’Hondt, Kathelijne Peremans, Christian Burvenich et Bart De Spiegeleer, « Chemical-Functional Diversity in Cell-Penetrating Peptides », PLoS One, vol. 8, no 8, , article no e71752 (PMID 23951237, PMCID 3739727, DOI 10.1371/journal.pone.0071752, Bibcode 2013PLoSO...871752S, lire en ligne)
- (en) Pengwei Zhang, Gabriel Monteiro da Silva, Catherine Deatherage, Christopher Burd et Daniel DiMaio, « Cell-Penetrating Peptide Mediates Intracellular Membrane Passage of Human Papillomavirus L2 Protein to Trigger Retrograde Trafficking », Cell, vol. 174, no 6, , p. 1465-1476 (PMID 30122350, PMCID 6128760, DOI 10.1016/j.cell.2018.07.031, lire en ligne)
- (en) Joanna B. Opalinska et Alan M. Gewirtz, « Nucleic-acid therapeutics: basic principles and recent applications », Nature Reviews Drug Discoveries, vol. 1, no 7, , p. 503-514 (PMID 12120257, DOI 10.1038/nrd837, lire en ligne)
- (en) Fritz Eckstein, « The versatility of oligonucleotides as potential therapeutics », Expert Opinion on Biological Therapy, vol. 7, no 7, , p. 1021-1034 (PMID 17665991, DOI 10.1517/14712598.7.7.1021, lire en ligne)
- (en) Dan Luo et W. Mark Saltzman, « Synthetic DNA delivery systems », Nature Biotechnology, vol. 18, no 1, , p. 33-37 (PMID 10625387, DOI 10.1038/71889, lire en ligne)
- (en) Eric Vivès, Priscille Brodin et Bernard Lebleu, « A Truncated HIV-1 Tat Protein Basic Domain Rapidly Translocates through the Plasma Membrane and Accumulates in the Cell Nucleus », Journal of Biological Chemistry, vol. 272, no 25, , p. 16010-16017 (PMID 9188504, DOI 10.1074/jbc.272.25.16010, lire en ligne)
- (en) Olivier Zelphati et Francis C. Szoka Jr, « Intracellular Distribution and Mechanism of Delivery of Oligonucleotides Mediated by Cationic Lipids », Pharmaceutical Research, vol. 13, no 9, , p. 1367-1372 (PMID 8893276, DOI 10.1023/a:1016026101195, lire en ligne)
- (en) Henry D. Herce et Angel E. Garcia, « Molecular dynamics simulations suggest a mechanism for translocation of the HIV-1 TAT peptide across lipid membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 52, , p. 20805-20810 (PMID 18093956, PMCID 2409222, DOI 10.1073/pnas.0706574105, Bibcode 2007PNAS..10420805H, lire en ligne)
- (en) Henry D. Herce et Angel E. Garcia, « Cell Penetrating Peptides: How Do They Do It? », Journal of Biological Physics, vol. 33, nos 5-6, , p. 345-356 (PMID 19669523, PMCID 2565759, DOI 10.1007/s10867-008-9074-3, lire en ligne)
- (en) Yuan Hu, Sudipta Kumar Sinha et Sandeep Patel, « Investigating Hydrophilic Pores in Model Lipid Bilayers Using Molecular Simulations: Correlating Bilayer Properties with Pore-Formation Thermodynamics », Langmuir, vol. 31, no 24, , p. 6615-6631 (PMID 25614183, PMCID 4934177, DOI 10.1021/la504049q, lire en ligne)
- (en) Yuan Hu, Xiaorong Liu, Sudipta Kumar Sinha et Sandeep Patel, « Translocation Thermodynamics of Linear and Cyclic Nonaarginine into Model DPPC Bilayer via Coarse-Grained Molecular Dynamics Simulation: Implications of Pore Formation and Nonadditivity », The Journal of Physical Chemistry B, vol. 118, no 10, , p. 2670-2682 (PMID 24506488, PMCID 3983342, DOI 10.1021/jp412600e, lire en ligne)
- (en) Yuan Hua et Sandeep Patel, « Thermodynamics of cell-penetrating HIV1 TAT peptide insertion into PC/PS/CHOL model bilayers through transmembrane pores: the roles of cholesterol and anionic lipids », Soft Matter, vol. 12, no 32, , p. 6716-6727 (PMID 27435187, DOI 10.1039/c5sm01696g, Bibcode 2016SMat...12.6716H, lire en ligne)
- (en) Maria Lindgren, Xavier Gallet, Ursel Soomets, Mattias Hällbrink, Ebba Bråkenhielm, Margus Pooga, Robert Brasseur et Ülo Langel, « Translocation Properties of Novel Cell Penetrating Transportan and Penetratin Analogues », Bioconjugate Chemistry, vol. 11, no 5, , p. 619-626 (PMID 10995204, DOI 10.1021/bc990156s, lire en ligne)
- (en) Maria Lindgren, Mattias Hällbrink, Alain Prochiantz, Ülo Langel, Maria Lindgren, Mattias Hällbrink, Alain Prochiantz et Ülo Langel, « Cell-penetrating peptides », Trends in Pharmacological Sciences, vol. 21, no 3, , p. 99-103 (PMID 10689363, DOI 10.1016/s0165-6147(00)01447-4, lire en ligne)
- (en) Stephen M. Fuchs et Ronald T. Raines, « Pathway for Polyarginine Entry into Mammalian Cells », Biochemistry, vol. 43, no 9, , p. 2438–2444 (PMID 14992581, PMCID 2819928, DOI 10.1021/bi035933x, lire en ligne)
- (en) Alan D. Frankel et Carl O. Pabo, « Cellular uptake of the tat protein from human immunodeficiency virus », Call, vol. 55, no 6, , p. 1189-1193 (PMID 2849510, DOI 10.1016/0092-8674(88)90263-2, lire en ligne)
- (en) Mathias Lundberg et Magnus Johansson, « Is VP22 nuclear homing an artifact? », Nature Biotechnology, vol. 19, no 8, , p. 713-714 (PMID 11479552, DOI 10.1038/90741, lire en ligne)
- (en) Mathias Lundberg, Sara Wikström et Magnus Johansson, « Cell surface adherence and endocytosis of protein transduction domains », Molecular Therapy, vol. 8, no 1, , p. 143-150 (PMID 12842437, DOI 10.1016/s1525-0016(03)00135-7, lire en ligne)
- (en) J. Howl, I. D. Nicholl et S. Jones, « The many futures for cell-penetrating peptides: how soon is now? », Biochemical Society Transaction, vol. 35, no 4, , p. 767-769 (PMID 17635144, DOI 10.1042/BST0350767, lire en ligne)
- (en) Thomas Plénat, Sébastien Deshayes, Sylvie Boichot, Pierre Emmanuel Milhiet, Richard B. Cole, Frédéric Heitz et Christian Le Grimellec, « Interaction of Primary Amphipathic Cell-Penetrating Peptides with Phospholipid-Supported Monolayers », Langmuir, vol. 20, no 21, , p. 9255-9261 (PMID 15461515, DOI 10.1021/la048622b, lire en ligne)
- (en) Sébastien Deshayes, Sabine Gerbal-Chaloin, May C. Morris, Gudrun Aldrian-Herrada, Pierre Charnet, Gilles Divita et Frédéric Heitz, « On the mechanism of non-endosomial peptide-mediated cellular delivery of nucleic acids », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 1667, no 2, , p. 141-147 (PMID 15581849, DOI 10.1016/j.bbamem.2004.09.010, lire en ligne)
- (en) Sébastien Deshayes, Annie Heitz, May C. Morris, Pierre Charnet, Gilles Divita et Frédéric Heitz, « Insight into the Mechanism of Internalization of the Cell-Penetrating Carrier Peptide Pep-1 through Conformational Analysis », Biochemistry, vol. 43, no 6, , p. 1449-1457 (PMID 14769021, DOI 10.1021/bi035682s, lire en ligne)