Aquaporine
Les aquaporines (AQP) sont une classe de protéines membranaires qui forment des « pores » perméables aux molécules d'eau dans les membranes biologiques.
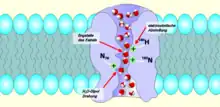
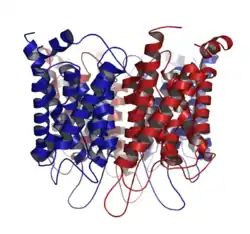
Les aquaporines permettent le passage de l'eau de part et d'autre de la membrane tout en empêchant les ions de pénétrer dans la cellule. En 2009, environ 500 aquaporines ont été découvertes aussi bien dans le règne végétal qu'animal, dont 13[1] chez l'humain.
Découverte
La premiere protéine canal pour l'eau appelée de suite l'aquaporine 1 (AQP1) a été découverte en 1985 au Département de Biologie Cellulaire et moléculaire de l'Université de Médecine et Pharmacie de Cluj-Napoca en Roumanie par une équipe dirigée par le Pr Gheorghe Benga. Observées pour la premiere fois dans la Membrane (biologie) de l'Hématie humaine. Peter Agre en 1992 en injectant l'ARNm de la protéine dans un œuf de xénope alors qu'il étudiait les globules rouges et leurs parois. Il a reçu le Prix Nobel de chimie pour ses travaux en 2003.
On supposait l'existence d'une structure de ce type car la pénétration osmotique de l'eau au travers des membranes lipidiques ne pouvait expliquer l'importance des échanges et flux observés au niveau cellulaire, des organes (reins par exemple capables de traiter l'équivalent de plusieurs centaines de litres d'eau par jour) et organismes.
Description
Ce sont des protéines de 250 à 300 acides aminés et 25 à 35 kilo Dalton. Elles sont constituées de 6 hélices alpha s'insérant dans la bicouche lipidique constituante de la membrane. Ces 6 hélices sont reliées par des boucles d'acides aminés dont 3 particulièrement importantes se trouvent au milieu des boucles B et E : NPA (N pour asparagine, P pour proline et A pour alanine).
C'est face à ce motif NPA que la cassure des ions H+ peut se faire : les deux boucles interagissent pour former une septième hélice créant un étranglement de 0,3 nm de diamètre dans le canal qui constitue le pore.
Les aquaporines sont des homotétramères indépendants, c'est-à-dire qu'elles sont composées de 4 monomères capables de transporter les molécules d'H2O individuellement. On pourrait les comparer à un sablier qui ferait passer une à une les molécules.
Mécanisme de fonctionnement
L'eau liquide est constituée de molécules d'eau significativement liées les unes aux autres par des liaisons chimiques entre atomes d'oxygène et d'hydrogène (« liaison hydrogène »).
Selon les modélisations informatiques, ces molécules, lorsqu'elles entrent dans l'entonnoir du pore (canal hydrique) formé au sein de chaque monomère, sont progressivement alignées alors que le pore se rétrécit (le pore a une forme de sablier). Les forces électrostatiques faibles résultant de la configuration interne du pore positionnent alors chaque molécule d'eau dans une même position : atome d'oxygène en premier. Arrivée au centre du canal chaque molécule d'eau est individuellement happée par l'attraction chimique de certains acides aminés qui tapissent l'intérieur du pore. Elle est ensuite retournée sur elle-même (par interaction avec deux asparagines présentes à l'entrée de l'étranglement). Ce retournement brutal de la molécule casse pour un instant la liaison hydrogène, isole la molécule du flux cohérent de la file des molécules d'eau, et la pousse vers la sortie du pore (cette fois les atomes d’hydrogène positionnés vers la sortie). Seuls les molécules d'eau et certains solutés passent ce type de "porte". Les ions hydrogène (ions hydronium en solution aqueuse parfois appelés protons) qui constituent la réserve énergétique de la cellule sont eux repoussés[2] bien que plus petits et solubles dans l'eau ; ces pores sont totalement étanches aux protons, permettant aux cellules de conserver leur potentiel électrochimique.
Des profils réalisés à l'aide de rayon-X montrent que les aquaporines possèdent deux entrées coniques. Cette forme de sablier pourrait être le résultat d'un processus de sélection naturelle qui a entrainé une optimisation de la permittivité hydrodynamique. Il a en effet été montré que des entrées coniques avec un angle d'ouverture bien choisi permet une large augmentation de la permittivité hydrodynamique d'un canal [3].
Fonctions
Les aquaporines expliquent la plus ou moins grande perméabilité des membranes cellulaires biologiques à l'eau. Elles permettent aux cellules des organes d'absorber, conserver ou excréter l’eau et jouent un rôle majeur dans le contrôle de l'hydratation des organismes vivants et dans la circulation de l'eau entre différents organes ou différentes parties d’une cellule. Elles permettent à l’eau d'entrer et/ou sortir d'une cellule, sans laisser passer d'autres molécules (toxiques à maintenir à l'extérieur des cellules, ou au contraire essentielles aux cellules et à maintenir dans celles-ci).
Leur fonctionnement est contrôlé par des hormones (vasopressine chez les mammifères) et peut être inhibé par certains toxiques (mercure par exemple).
Elles sont essentielles à l'activité d'organes tel que le rein (dont les cellules comportent 3 sortes d'aquaporines différentes).
Elles sont impliquées dans des fonctions biologiques tels que les pleurs.
Un défaut génétique dans l'expression de ces protéines a été associé avec certaines maladies humaines[4] - [5].
Par exemple une mutation de l'AQP2 est responsable au niveau du rein d'une déshydratation sévère. Cette AQP2, si elle est présente en surnombre, est également responsable d'œdème (⇒ insuffisance cardiaque).
L'AQP0, quant à elle est responsable de la cataracte si elle est mutée.
L'AQP4 est presque spécifique du parenchyme cérébrale. C'est la seule qui permet l'entrée d'eau dans le tissu cérébral qui a une composition très stable. En effet, si l'eau entrait en excès dans le cerveau, l'osmolalité baisserait et les neurones capteraient plus d'eau et donc gonfleraient et entreraient en souffrance car situés dans une boite cranienne inextensible.
Quelques aquaporines
| Protéine | Activité identifiée | Espèces exclues | Inhibition par les sels de mercure | Localisation principale |
|---|---|---|---|---|
| AQP0 | Canal hydrique | Œil | ||
| AQP1 | Canal hydrique (polyols à 3C) | Ions, urée, polyols à 4C | oui (sur Cys189) | Érythrocytes (groupe sanguin 015 Colton), rein, œil, cerveau (plexus choroïde), cœur, poumon[6], etc |
| AQP2 | Canal hydrique | Urée | oui | Rein (tube collecteur) |
| AQP3 | Canal hydrique (glycérol, urée) | acides aminés, ions, sucres | oui | Érythrocytes (groupe sanguin 029 GIL), rein, appareil gastro-intestinal, poumon, vessie |
| AQP4 | Canal hydrique | Ions, urée, glycérol | non | Cerveau, œil, rein, poumon, intestin |
| AQP5 | Canal hydrique | Glandes lacrymales et salivaires | ||
| alpha-TIP | Canal hydrique | ions | Vacuoles des graines |
Biomimétisme
Le biomimétisme cherche à copier la nature et notamment des systèmes énergiquement efficaces. Divers systèmes de purification de l'eau sont inspirées des systèmes biologiques. La sélectivité à l'eau remarquables des aquaporines (en dépit du fait que la physique simple voudrait qu'à mesure que le diamètre d'un tuyau ou d'un canal diminue, le débit par section transversale diminue en raison du rapport surface / volume plus élevé), intéresse les chercheurs. En mai 2022, des chercheurs japonais (Itoh et al.) ont réussi à construire des nanocanaux fluorés constituées de fluorocarbures pouvant s'auto-assembler par polymérisation supramoléculaire à partir de nanoanneaux d'oligoamide fluorés dont les diamètres intérieurs sont compris entre 0,9 à 1,9 nanomètres. L'électronégativité intense de ces nanotupes perturbe la formation d'amas d'eau et force les molécules d'eau à individuellement traverser les canaux, encore plus vite dans les petits que dans les grands. Les essais montrent que les ions chlorure, grappe à la puissante barrière électrostatique constituée par la surface intérieure fluorée électrostatiquement négative, ce nanocanal devrait, selon les auteurs, montrer une réflectance du sel presque parfaite pour le dessalement (les atomes de chlore y sont fortement repoussés et ne percolent quasiment pas via ces canaux)
Ces canaux, grâce à une surface intérieure superhydrophobe présentent un flux de perméation à l'eau supérieur de deux ordres de grandeur à celui d'une aquaporine ou d'un nanotube de carbone[7] - [8].
Notes et références
- Pierre Laszlo, « Les aquaporines » dans La Science au présent 2009. Ed. Encyclopaedia Universalis, 2009.
- De Groot B. L., Grubmüller, The dynamics and energetics of water permeation and proton exclusion in aquaporins. Current Opinion in Structural Biology. 2005, Vol.15, p. 176-183.
- Simon Gravelle, Laurent Joly, François Detcheverry, Christophe Ybert, Cécile Cottin-Bizonne and Lydéric Bocquet, « Optimizing water permeability through the hourglass shape of aquaporins », PNAS, vol. 110, no 41, , p. 16367–16372 (PMID 24067650, DOI 10.1073/pnas.1306447110)
- Agre, P. ; Kozono, D. Aquaporin water channels: molecular mechanisms for human diseases. FEBS Letters, 2003, Vol 555, p. 72–78.
- Schrier, R.W. Aquaporin-related disorders of water homeostasis. Drug News & Perspectives. 2007, Vol. 20, p.447–453.
- Kreda, S. M., Gynn, M. C., Fenstermacher, D. A., Boucher, R. C., & Gabriel, S. E. (2001). Expression and localization of epithelial aquaporins in the adult human lung. American journal of respiratory cell and molecular biology, 24(3), 224-234.
- YUEXIAO SHEN (2022) Beating natural proteins at filtering water |SCIENCE |12 mai 2022 | Vol 376, n°6594 pp. 698-699 | DOI: 10.1126/science.abo2953 https://www.science.org/doi/10.1126/science.abo2953
- Itoh et al. (2022) Ultrafast water permeation through nanochannels with a densely fluorous interior surface ; Sciencer • 12 May 2022 • Vol 376, Issue 6594 • pp. 738-743 • DOI: 10.1126/science.abd0966
Voir aussi
Vidéographie
- Passage trans membranaire d'une molécule d'eau, via la protéine aquaporine, Animation produite par le NIH ("Center for Macromolecular Modeling and Bioinformatics")