Fluoxétine
Le chlorhydrate de fluoxétine (Prozac, Sarafem) est un psychotrope de type inhibiteur sélectif de la recapture de la sérotonine (ISRS) utilisé comme antidépresseur dans le traitement de la dépression de type sévère (c’est-à-dire caractérisé et plus haut stade de la maladie ; le risque de suicide y est très important en particulier chez les jeunes de 18 à 25 ans), des troubles obsessionnels compulsifs, de la boulimie nerveuse, des troubles dysphoriques prémenstruels, et de nombreux autres états.
| Fluoxétine | ||
| ||
 | ||
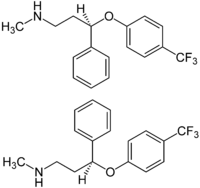
| Structure de l'énantiomère R de la fluoxétine (en haut) et de la S-fluoxétine (au milieu) | ||
| Identification | ||
|---|---|---|
| Nom UICPA | (RS)-N-méthyl-3-phényl-3-[4-(trifluorométhyl)phénoxy]-propan-1-amine | |
| No CAS | (racémique) [S(–)] [R(+)] |
|
| No ECHA | 100.125.370 | |
| Code ATC | N06 | |
| PubChem | 3386 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C17H18F3NO [Isomères] |
|
| Masse molaire[1] | 309,326 1 ± 0,015 4 g/mol C 66,01 %, H 5,87 %, F 18,43 %, N 4,53 %, O 5,17 %, |
|
| pKa | 10,5 | |
| Propriétés physiques | ||
| Solubilité | 14 g·l-1 | |
| Données pharmacocinétiques | ||
| Biodisponibilité | 72 % (orale) | |
| Métabolisme | Hépatique (< 30 %) | |
| Demi-vie d’élim. | 1 - 3 j (prise unique) 4 - 6 j (au long cours) |
|
| Excrétion | ||
| Considérations thérapeutiques | ||
| Classe thérapeutique | Antidépresseur ISRS | |
| Voie d’administration | Orale | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| (chlorhydrate de) fluoxétine | |
| Informations générales | |
|---|---|
| Princeps |
|
| Classe | psychoanaleptiques antidépresseurs inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), ATC code N06AB03 |
| Forme | comprimés, comprimés dispersibles sécables, gélules à 10 et 20 mg, solution buvable à 20 mg/5 ml |
| Administration | per os |
| Laboratoire | AA pharma, Acino Pharma, Accord healthcare, Actavis, Almus, Alter Apotex, Arrow, Auro pharma, Axapharm, Biogaran, Bouchara Recordati, Cimex, Cristers, Dominion pharmacal, Dr Reddys laboratories, Eli Lilly, European Generics (EG), Evolugen, G-Gam, GNR, Helvepharm, Impexeco, Intas pharmaceuticals, Irex, Ira, Isomed, Jamp pharma, Mepha Pharma, Merck, Mint pharmaceuticals, Mylan (ULC), PHR Lab, Qualimed, Ranbaxy, Ratiopharm, RPG, Sandoz, Sanis health, Sivem pharmaceuticals (ULC), SMB, Teva, Zentiva, Zydus |
| Identification | |
| No CAS | |
| No ECHA | 100.125.370 |
| Code ATC | N06AB03 |
| DrugBank | 00472 |
La fluoxétine fut découverte par Eli Lilly en 1974[2] qui la commercialisa sous le nom Prozac en 1986[3]. Depuis l'automne 2001, le chlorhydrate de fluoxétine n'est plus protégé par son brevet et est produit par de nombreux autres laboratoires. Il a été prescrit à plus de 34 millions de personnes dans le monde de 2001 à 2009[4].
Aux États-Unis, Eli Lilly commercialise aussi la fluoxétine sous le nom Sarafem pour le traitement du trouble dysphorique prémenstruel (TDPM). Le Sarafem a été approuvé par la FDA en novembre 1999. Le brevet du Prozac expirant en 2001 et dans le but de compenser la baisse de la part de marché[5] du Prozac, Eli Lilly demande alors que la fluoxétine soit commercialisée sous le nom commercial Sarafem au lieu de Prozac[6] - [7]. La molécule, qui était majoritairement à destination du traitement de la dépression, devient une molécule à destination du trouble dysphorique prémenstruel.
Description

La fluoxétine est un dérivé de la diphénhydramine, un antihistaminique avéré pour empêcher la recapture de la sérotonine.
La fluoxétine interagit avec certaines substances dont les inhibiteurs de monoamine oxydase (IMAO).
Elle est principalement utilisée dans les dépressions marquées par un manque d'énergie du fait de son effet stimulant, mais aussi dans d'autres conditions comme l'anxiété ou la panique.
Son élimination est lente, sa demi-vie est de quatre jours. Le foie métabolise la fluoxétine en norfluoxétine, qui est également un inhibiteur sélectif de la recapture de la sérotonine et dont la demi-vie est encore plus longue, de 8,6 à 9,3 jours. Certains professionnels considèrent que la durée de sa demi-vie est liée à son efficacité thérapeutique mais aucune étude fiable n'a été faite sur ce point.
Dans le cas où il existe des dysfonctions sexuelles (désir sexuel hypoactif, anorgasmie, trouble de l'excitation…) antérieures à l'apparition d'un état dépressif, une utilisation de la fluoxétine devra impérativement être évitée[8].
En médecine vétérinaire, elle peut être prescrite pour traiter les troubles du comportement liés à l'anxiété[9].
Smithkline Beecham (devenu GSK) indique que la longue demi-vie de la fluoxétine (4-6 jours) et de ses métabolites actifs norfluoxétine (4-16 jours) signifie que le médicament actif reste dans le corps jusqu'à 3 mois (5 fois la demi-vie)[10].
Législation
La fluoxétine est en annexe 1 des drogues au Canada, où elle n'est donc délivrée que sur prescription. Cette molécule est aussi délivrée sous prescription en France, en Belgique, en Suisse, et en Espagne.
Efficacité
L'efficacité du traitement est variable selon les sujets et la justesse du diagnostic psychiatrique établi au préalable. Les résultats obtenus auprès des différentes études réalisées récemment au niveau international sont variables et nécessitent des recherches ultérieures[11]. De plus, il existe un effet dose-dépendant.
| molécule ou récepteur | Fluoxétine (Ki en nM) | Norfluoxétine (Ki en nM) | affinité (indique le taux de stimulation des récepteurs) |
|---|---|---|---|
| SERT (transporteur de sérotonine) | 1 | 19 | très élevée pour les 2 |
| NET (transporteur de noradrénaline) | 660 | 2700 | assez élevée et moyenne pour norfluoxétine |
| DAT (transporteur de la dopamine) | 4180 | 420 | très faible/assez forte |
| 5-HT2A | 200 | 300 | très élevée pour les 2 |
| 5-HT2B | 5000 | 5100 | très faible pour les 2 |
| 5-HT2C | 72.6 | 91.2 | très élevée pour les 2 |
| α1 | 3000 | 3900 | faible pour les 2 |
| M1 | 870 | 1200 | moyenne pour les 2 |
| M2 | 2700 | 4600 | faible/très faible |
| M3 | 1000 | 760 | moyenne pour les 2 |
| M4 | 2900 | 2600 | faible pour les 2 |
| M5 | 2700 | 2200 | faible pour les 2 |
| H1 | 3250 | 10000 | très faible/ quasi nulle |
Profil d'affinité des deux molécules actives
Les données mettent en évidence que le prozac n'est pas un simple ISRS. Il élève également les niveaux de dopamine et noradrénaline de façon conséquente ce qui explique son effet stimulant et certains effets secondaires à type d'agressivité et des changements de comportements. Il possède aussi un effet cholinergique qui apporte essentiellement des effets négatifs et n'est en théorie pas souhaitable avec les ISRS.
Effets secondaires
Ils sont donnés par la commission de la transparence de la Haute Autorité de santé le [12].
Troubles généraux
Réactions allergiques (tels que prurit, rash, urticaire, réaction anaphylactoïde, vascularite, maladie sérique, œdème de Quincke), tremblements, syndrome sérotoninergique, photosensibilité, et très rarement érythème polymorphe pouvant évoluer en syndrome de Stevens-Johnson ou en érythrodermie bulleuse avec épidermolyse (syndrome de Lyell).
Appareil digestif
Troubles gastro-intestinaux (tels que diarrhée, nausées, vomissements, dyspepsie, dysphagie, dysgueusie), bouche sèche. Rares anomalies des fonctions hépatiques. Très rares cas d’hépatite idiosyncrasique.
Système nerveux
Céphalées, troubles du sommeil (rêves anormaux, insomnie, somnolence...), sensations vertigineuses, anorexie, fatigue, euphorie, mouvements anormaux transitoires (tics, ataxie, tremblements, myoclonies), convulsions et rarement agitation psychomotrice/akathisie. Très rares cas de syndromes sérotoninergiques.
Troubles psychiatriques
Hallucinations, réaction maniaque, confusion, agitation, anxiété et symptômes associés (telle que la nervosité), troubles de la concentration et du cours de la pensée (telle que la dépersonnalisation), attaques de panique, peut accroitre les pensées et comportement suicidaires et les gestes autodestructeurs ou de mal à autrui.
Appareil urogénital
- Rétention urinaire, pollakiurie.
- Troubles sexuels (éjaculation retardée ou anéjaculation, anorgasmie), priapisme, galactorrhée.
Troubles divers
Alopécie, bâillements, trouble de la vision (telles que vision trouble, mydriases), sudation excessive, vasodilatation, arthralgie, myalgie, hypotension orthostatique, ecchymoses.
Système respiratoire
Pharyngite, dyspnée. De rares atteintes pulmonaires (avec des lésions inflammatoires histologiques non spécifiques et/ou une fibrose dont des processus inflammatoires de différents types histologiques et/ou une fibrose) ont été rapportées. La dyspnée peut être le seul symptôme avant-coureur.
Densité osseuse
Une perte osseuse a été observée au-delà d'une année de traitement chez la souris rendant les sujets sensibles aux fractures[13].
Controverse
Vers la fin des années 1990, une polémique s'est développée, la firme Eli Lilly avait notamment fait d'énormes bénéfices avec le succès du Prozac.
Il lui est notamment reproché d'augmenter les risques de passage à l'acte suicidaire (risque présent chez tous les anti-dépresseurs puisqu'ils restaurent rapidement une certaine forme d'énergie avant de soigner la tristesse pathologique) surtout quand il est utilisé sur des enfants ou des adolescents[14].
En décembre 2004, le British Medical Journal (BMJ) publia des documents officiels d'Eli Lilly datant des années 1980 et suggérant un lien entre la fluoxétine, le suicide et la psychose. La publication professionnelle internationale affirmait également que la firme avait dissimulé ces informations, point sur lequel le BMJ a dû se rétracter[15].
Dégradabilié, biodégradabilité
La Fluoxétine fait partie des molécules qu'on retrouve dans les eaux usées. Peu de données sur la dégradabilité (dont par photodégradation[16]) ou la biodégradabilité de la fluoxétine sont disponibles[17]. On cherche à mieux comprendre à quelles conditions elle peut (notamment dans une eau à basse ou moyenne pression devant être épurée pour une réutilisation) être dégradée par électro-oxydation (en) ou par un processus d'oxydation avancé UV (AOP).
Devenir environnemental
La fluoxétine qui est consommée par les êtres humains est métabolisée en norfluoxétine (en) par les isoenzymes cytochrome P450. La voie principale d’excrétion de la fluoxétine et de la norfluoxétine étant l’urine et jusqu’à 11 % du médicament est excrété en tant que fluoxétine non métabolisée[18].
Dans les eaux de surface
Quelques études ont été faites pour déterminer la concentration de fluoxétine dans les eaux de surface de plusieurs pays. La concentration de fluoxétine est de 21,4 ± 31,2 ng·L-1 dans la rivière Henares-Jarama-Tajo en Espagne[19]. Une concentration de 12 ng/L de fluoxétine a été mesurée dans l’eau de surface aux États-Unis[20]. À titre comparatif, en Norvège, une concentration de 0 à 3 ng/L a été mesurée dans les effluents des hôpitaux. Cela peut confirmer que les hôpitaux ne sont pas les sources majeures de fluoxétine dans les eaux de surface[21]. Finalement une concentration de 99 ng/L a été mesurée dans les effluents des usines de traitements des eaux au Canada[22].
Méthodes d'analyse
Il faut d’abord faire l’échantillonnage d’une façon adéquate puisqu’il ne faut pas détériorer l’échantillon. Ensuite une pré-concentration est faite par une extraction en phase solide (SPE). Les concentrations retrouvées dans l’eau de surface sont en quantité trace alors il est nécessaire de concentrer l’échantillon pour pouvoir détecter la fluoxétine avec un instrument analytique. Finalement l’analyse s’effectue par chromatographie liquide couplé par spectrométrie de masse en tandem (LC-MS/MS).
L’extraction de la fluoxétine est effectuée avec de l’eau de qualité HPLC et de l’eau environnementale. Des bouteilles ambrées préalablement rincées avec de l’eau ultra-pure sont utilisées pour la collection des échantillons. L’eau environnementale est filtrée au travers d’une membrane de nylon 0,45 μm. L’entreposage des échantillons se fait à −20 °C, ainsi l’activité biologique est réduite de façon considérable. Il y a deux types de sorbants utilisés pour cette analyse : HLB et MIP. Le sorbant HLB est un copolymère macroporeux fait avec un ratio balancé de deux monomères, le divinylbenzène lipophylique et la N-vinylpyrrolidone hydrophobique. Le MIP est un polymère avec une empreinte moléculaire (Molecular Imprinted Polymer). Dans le cas présent, l’empreinte est faite pour l’analyse des drogues pharmaceutiques.
Sorbant HLB
Pour le sorbant HLB, la méthode est la suivante : il faut prendre 100 ml d’échantillon aqueux qu’on va doper avec 0,5 μg·l-1 de fluoxétine pur. L’échantillon est passé au travers de la cartouche SPE au pH naturel du cours d’eau (qui est d’environ 8,3 pour une rivière) à un taux de 5 ml/min. La cartouche est préalablement conditionnée avec 5 ml de méthanol et d’eau de qualité HPLC. Après avoir passé l’échantillon au travers de la cartouche, elle est rincée avec 5 ml d’eau de qualité HPLC. La cartouche est ensuite séchée sous vide pendant 15 minutes. L’élution se fait par la suite avec 2 × 4 ml de méthanol et les extraits sont évaporés avec un léger jet d’azote. 0,5 ml d’un mélange d’acétonitrile/eau (10: 90 v/v) avec 100 ng·ml-1 d’étalon interne est ajouté à l’extrait évaporé. L’étalon interne est le fluoxétine-d5[4].
Sorbant MIP
Pour ce qui est du sorbant MIP; 25-200 ml de l’échantillon aqueux à son pH naturel est passé au travers de la cartouche MIP à un taux d’environ 1 mL/min. Les cartouches sont pré-conditionnées avec 1 ml de méthanol suivi de 1 ml d’eau de qualité HPLC. Une fois l’échantillon passé au travers de la cartouche, elle est rincée avec 2 × 1 ml d’eau de qualité HPLC et séchée sous vide pendant 10 minutes. Pour la prochaine étape de lavage, 1 ml d’acétonitrile est passé dans la cartouche et elle est séchée sous vide pour 10 minutes. Le solvant d’élution est 4 × 1 ml de méthanol (10 % d’acide acétique). Finalement les extraits sont évaporés et reconstitués comme dans la méthode HLB[4].
Chromatographie liquide à ultra performance (UPLC)
Une fois les échantillons préparés, ils sont analysés par UPLC-MS/MS avec une colonne C18. Les gradients utilisés pour l’analyse avec l’acétonitrile (A) et une solution d’acide formique 0,1 % sont :
- 10 % de A pendant 0,5 minute ;
- 30 % de A à 2,5 minutes ;
- 80 % de A à 5 minutes ;
- 100 % de A à 5,5 minutes ;
- 10 % de A à 6,5 minutes.
C’est donc une analyse rapide puisque c’est un instrument UPLC qui est utilisé. Le débit est de 400 μL/min et la colonne est maintenue à 30 °C. Avec le sorbant MIP et HLB, il est possible d’obtenir une limite de détection de la méthode (MDL) de 0,5 ng·l-1[4].
Spectrométrie de masse
Pour ce qui est du spectromètre de masse en tandem, les composés sont ionisés par électronébuliseur en mode positive. Le voltage du capillaire est de 3,00 kV et les températures de la source et de la désolvatation sont de 120 et 350 °C respectivement. Les limites de détections instrumentales sont de moins d'1 pg. Des pourcentages de recouvrements de 75 ± 1 % pour MIP et 92 ± 12 % pour HLB sont obtenus. Un recouvrement plus précis est donc obtenu avec le sorbant MIP[4].
Écotoxicologie
Le fait qu’il y ait de la fluoxétine dans l’environnement est préoccupant puisque les conséquences d’une exposition prolongée à des quantités traces sont inconnues. Bien que les médicaments actifs aient des durées de demi-vie courtes à cause de processus biotiques ou non-biotiques, leur infusion continue dans l’environnement cause des expositions multi-générationnelles aux organismes marins[23]. Il se pourrait qu’il y ait des changements biologiques continus pour ces organismes et que nous ne soyons pas en mesure de les apercevoir. Par conséquent, il pourrait survenir des impacts irréversibles qui pourrait être attribués à un changement naturel ou à une adaptation[24].
Les valeurs de EC50 après 24 heures d’incubation pour Tetrahymena thermophila (protozoaire) sont de 30,5 (±0,7) mg.l-1 et de 3,2 (±0,1) mg.l-1 pour (–)-(R)-fluoxétine et (+)-(S)-fluoxétine respectivement alors l’isomère (+)-(S)-fluoxétine est beaucoup plus toxique pour cette espèce[23]. Pour Daphnia magna (crustacé zooplanctonique), les deux énantiomères sont pratiquement aussi toxiques. Pour le taux de pâturage de ce crustacé zooplanctonique, la concentration minimale où il y a eu un effet observable est de 195 μg·l-1 pour l’isomère (S) pour une durée de 21 jours. La concentration où il y a eu un effet observable sur la croissance de Pimephales promelas (poisson) est de 53 μg·l-1 pour un mélange racémique de fluoxétine pour une période de sept jours[25]. De plus, ce médicament a des propriétés anti-microbiotiques et pourrait inhiber des pompes cellulaires[26]. Les conséquences potentielles de ce pharmaceutique sur la santé des humains sont inconnues. Il est important de noter que malgré une certaine utilité des bioessais, ils ne sont pas représentatifs de ce qui se passe réellement dans les eaux de surface. Ils sont très souvent limités à quelques jours ou quelques semaines alors qu’en vérité, les organismes passent une vie complète avec ces contaminants.
Divers
La fluoxétine fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[27].
Dès 1997, Lilly avait une campagne publicitaire annonçant que lorsque le patient est sous traitement Prozac (fluoxétine), le traitement est facile à arrêter et entraine rarement des symptômes de discontinuation[10].
La fluoxétine est testée pour ses propriétés antivirales, notamment dans les infections à entérovirus[28] et dans l'hépatite C[29].
Usage vétérinaire
La fluoxetine aide à la thérapie comportementale chez le chien, en particulier dans le traitement du trouble de l’anxiété de séparation se manifestant par des comportements inappropriés. En Belgique la spécialité s'appelle Reconcile[30].
Recherche sur son usage dans la maladie d'Alzheimer
Un autre potentiel traitement très prometteur de la maladie d'Alzheimer est la fluoxétine, qui n'est actuellement pas préconisée ni commercialisée pour cet usage. De nombreux patients atteints de maladie d'Alzheimer sont sous fluoxétine pour le traitement d'un des symptômes secondaires, à savoir la dépression ou les troubles de l'humeur[31]. Cependant, il semble d'après plusieurs recherches menées sur ces patients que ce médicament travaille directement vers la réduction de la maladie par la neurogenèse dans l'hippocampe adulte agissant sur les cellules souches neurales[32] et la régulation des astrocytes (principales cellules gliales) dans le cerveau[33].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David T. Wong, Jong S. Horng, Frank P. Bymaster, Kenneth L. Hauser et Bryan B. Molloy, « A selective inhibitor of serotonin uptake: Lilly 110140, 3-(p-Trifluoromethylphenoxy)-n-methyl-3-phenylpropylamine », Life Sciences, vol. 15, no 3, , p. 471–9 (PMID 4549929, DOI 10.1016/0024-3205(74)90345-2)
- Jeff Swiatek, « Prozac's profitable run coming to an end for Lilly », The Indianapolis Star, (lire en ligne)
- (en) Demeestere, K., Petrović, M., Gros, M., Dewulf, J. « Trace analysis of antidepressants in environmental waters by molecularly imprinted polymer-based solid-phase extraction followed by ultra-performance liquid chromatography coupled to triple quadrupole mass spectrometry » Anal Bioanal Chem. 2010;396:825-837
- (en) Janet C. Currie, Women and Health Protection (Organization), The Marketization of Depression: Prescribing SSRI Antidepressants to Women, Women and Health Protection, , 27 p. (ISBN 0973870109, lire en ligne)« New disorders are often used to “reposition” an SSRI as it loses market share.(...)In June 1999, when Prozac’s patent was about to expire, its manufacturer, Eli Lilly, organized a roundtable of experts in the US to get PMDD approved – in order to extend Prozac’s patent life under the name Serafem. According to Caplan, the creation of Serafem extended Lilly’s patent on Prozac by seven years, thereby adding millions of dollars in profit. 78 Although the two drugs were the same, Serafem was sold at a higher price than Prozac. »
- (en) « Pharma Overview », sur pubs.acs.org/cen Chemical and engineering news, (consulté le )
- (rédaction), « Façonner des maladies: l'empire du marketing », Rev Prescrire., vol. 27, no 283, , p. 381-382 (lire en ligne)
- Sutherland JE, Sutherland SJ, Hoehns JD, « Achieving the best outcome in treatment of depression », Journal of Family Practice, vol. 52, no 3, , p. 201–09 (PMID 12620174, lire en ligne)
- (en) Fitzgerald KT, Bronstein AC, « Selective serotonin reuptake inhibitor exposure », Top Companion Anim Med, vol. 28, no 1, , p. 13-7. (PMID 23796482, DOI 10.1053/j.tcam.2013.03.003)
- (en) « Smithkline Beecham v Lilly -prozac advertisement », code of practice review, no 20, , p. 65-68 (lire en ligne)« active medicine might remain in the body for up to 3 months (5 times the half-life)(...) "true leadership has to be earned" "reducing the risk of discontinuation syndrome" prozac is rarely associated with unpleasant antidepressant discontinuation symptoms. Prozac's long half-life may protect against such symptoms. so Prozac makes it easy for you and your patients on stopping treatment or if therapy is interrupted". »
- (en) Glartlehner G. et al. « Comparative benefits and harms of second-generation antidepressants: background paper for the American College of Physicians » Ann Intern Med. 2008;149(10):734-50.
- « Avis de la Commission de la transparence » [PDF], sur www.has-sante.fr, HAS, (consulté le ).
- (en-US) « Antidepressant makes bones weaker by slowing down new growth », New Scientist, 10 semptember 2016, p. 14 (lire en ligne, consulté le )
- [PDF] « Le bon usage des antidépresseurs chez l’enfant et l’adolescent »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) Guide de l'agence française de sécurité sanitaire des produits de santé
- « Le Prozac n'a pas déprimé les salariés de Lilly France » Stratégies, 10 février 2005
- (en) Fent K, Weston AA, Daniel Caminada « Ecotoxicology of human pharmaceuticals » Aquatic Toxicology, 2006;76:122–159
- (en) Fent K, Weston AA, Daniel Caminada « Ecotoxicology of human pharmaceuticals » Aquatic Toxicology, 2006 ;76:122–159
- (en) Morando, MB, Medeiros LR, McDonald MD. « Fluoxetine treatment affects nitrogen waste excretion and osmoregulation in a marine teleost fish » Aquatic Toxicology 2009;93:253
- (en) Fernández C, González-Doncel M, Carbonell JPG. « Occurrence of pharmaceutically active compounds in surface waters of the henares-jarama-tajo river system (Madrid, Spain) and a potential risk characterization » Science of the Total Environment 2010;408:543–551
- (en) Kolpin DW, Furlong ET, Meyer MT, Thurman EM, Zaugg SD, Barber LB, Buxton HT. « Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999–2000: a national reconnaissance » Environ. Sci. Technol. 2002;36:1202–1211.
- (en) Langford KH, Thomas KV. « Determination of pharmaceutical compounds in hospital effluents and their contribution to wastewater treatment works » Environ Int. 2009;35(5):769. DOI 10.1016/j.envint.2009.02.007
- (en) Metcalfe CD, Miao XS, Koenig BG, Struger J. « Distribution of acidic and neutral drugs in surface waters near sewage treatment plants in the lower Great Lakes, Canada » Environ Toxicol Chem. 2003;22(12):2881–2889.
- (en) De Andrès F, Castañeda G, Rios A. « Use of Toxicity Assays for Enantiomeric Discrimination of Pharmaceutical Substances » Chirality 2009;21:751-758. DOI 10.1002/chir.20675
- (en) Daughton CG. & Ternes TA. « Pharmaceuticals and personal care products in the environment: agents of subtle change? » Environ Health Perspect. 1999;107:907–938
- Stanley, J. K.; Ramirez, A. J.; Chambliss, K.; Brooks, B. W., Enantiospecific sublethal effects of the antidepressant fluoxetine to a model aquatic vertebrate and invertebrate, Chemosphere, 2007, 69 page 9–16
- Bellido, M.;, Criado, M., Rodrıguez, G., Antimicrobial activity of psychotropic drugs: selective serotonin reuptake inhibitors, Int J Antimicrob Agents, 2000, 14, 177–180
- (en) WHO Model List of Essential Medicines, 18th list, avril 2013
- Enagnon Kazali Alidjinou, Famara Sané, Antoine Bertin et Delphine Caloone, « Persistent infection of human pancreatic cells with Coxsackievirus B4 is cured by fluoxetine », Antiviral Research, vol. 116, , p. 51–54 (ISSN 1872-9096, PMID 25655448, DOI 10.1016/j.antiviral.2015.01.010, lire en ligne, consulté le )
- Kung-Chia Young, Chyi-Huey Bai, Hui-Chen Su et Pei-Ju Tsai, « Fluoxetine a novel anti-hepatitis C virus agent via ROS-, JNK-, and PPARβ/γ-dependent pathways », Antiviral Research, vol. 110, , p. 158–167 (ISSN 1872-9096, PMID 25151487, DOI 10.1016/j.antiviral.2014.08.002, lire en ligne, consulté le )
- Antidépresseurs, sur le site cbip-vet.be - consulté le 11 novembre 2012
- (en) Yi Xie, Pei-Pei Liu, Ya-Jun Lian et Hong-Bo Liu, « The effect of selective serotonin reuptake inhibitors on cognitive function in patients with Alzheimer’s disease and vascular dementia: focusing on fluoxetine with long follow-up periods », Signal Transduction and Targeted Therapy, vol. 4, no 1, , p. 1–3 (ISSN 2059-3635, DOI 10.1038/s41392-019-0064-7, lire en ligne, consulté le )
- (en) Keun-A Chang, Jeong a Kim, Saeromi Kim et Yuyoung Joo, « Therapeutic potentials of neural stem cells treated with fluoxetine in Alzheimer’s disease », Neurochemistry International, honoring Nobel Laureate Dr. Marshall Nirenberg on Decoding Brain Memory, vol. 61, no 6, , p. 885–891 (ISSN 0197-0186, DOI 10.1016/j.neuint.2012.03.017, lire en ligne, consulté le )
- (en) Jinping Qiao, Junhui Wang, Hongxing Wang et Yanbo Zhang, « Regulation of astrocyte pathology by fluoxetine prevents the deterioration of Alzheimer phenotypes in an APP/PS1 mouse model », Glia, vol. 64, no 2, , p. 240–254 (ISSN 1098-1136, DOI 10.1002/glia.22926, lire en ligne, consulté le )
Bibliographie
- David Healy, Let Them Eat Prozac (New York University Press, 2004)
Voir aussi
Articles connexes
Liens externes
- (en) Lilly's Prozac® advertising website
- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Fluoxétine
- Page spécifique sur le Répertoire Commenté des Médicaments, par le Centre belge d'information pharmacothérapeutique
- (de) Page spécifique dans la base de données sur les produits vétérinaires (Veterinärprodukte, Futtermittel & Zusatzstoffe, Suisse)
- Page spécifique sur le Vidal.fr