Amidure de lithium
L'amidure de lithium est un composé chimique de formule LiNH2. Il se présente comme un solide blanc cristallisé dans le système tétragonal. Il peut être utilisé en chimie organique dans les condensations de Claisen, dans l'alkylation des nitriles et des cétones et dans la synthèse d'alcènes et d'alcools. Il est produit industriellement en chauffant du lithium ou de l'hydrure de lithium LiH dans un flux d'ammoniac NH3. Il se forme également lentement lorsque le lithium est dissous dans l'ammoniac liquide. Comme pour les autres amidures de métaux alcalins et alcalino-terreux, cette réaction est considérablement accélérée par la présence de chlorure de fer(II) FeCl2[3].
| Amidure de lithium | |||
| |||
| __ Li+ __ N3− __ H+ | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.029.062 | ||
| No CE | 231-968-4 | ||
| No RTECS | OJ5590000 | ||
| PubChem | 24532 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | H2LiN |
||
| Masse molaire[1] | 22,964 ± 0,002 g/mol H 8,78 %, Li 30,23 %, N 60,99 %, |
||
| Propriétés physiques | |||
| T° fusion | 373 °C[2] | ||
| T° ébullition | 430 °C[2] à 1 atm | ||
| Masse volumique | 1,17 g·cm-3[2] | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| NFPA 704[2] | |||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
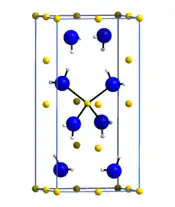
Ce composé est généralement très sensible à l'hydrolyse. Sa structure cristalline appartient au groupe d'espace I4 (no 82). Il attaque faiblement le verre[4]. Chauffé dans le vide, il dégage de l'ammoniac au-dessus de 300 °C. Sa dismutation en imidure de lithium Li2NH et ammoniac n'a lieu qu'à 400 °C et sa décomposition n'intervient qu'au-dessus de 750 à 800 °C en libérant de l'azote N2, de l'hydrogène H2 et de l'ammoniac[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Lithium amide, 95% », sur Alfa Aesar (consulté le ).
- (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e édition, Walter de Gruyter, Berlin 2007, p. 666. (ISBN 978-3-11-017770-1)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e édition révisée, vol. I, Ferdinand Enke, Stuttgart 1975, p. 448. (ISBN 3-432-02328-6)

