Peroxyde de lithium
Le peroxyde de lithium est le composé chimique de formule Li2O2. C'est un solide qui se décompose vers 195 °C en oxyde de lithium Li2O et dioxygène O2 :
- 2 Li2O2 → 2 Li2O + O2
| Peroxyde de lithium | |||
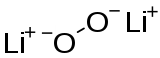
| |||
| Structure du peroxyde de lithium | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.031.585 | ||
| No CE | 234-758-0 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre beige | ||
| Propriétés chimiques | |||
| Formule | Li2O2 [Isomères] |
||
| Masse molaire[1] | 45,881 ± 0,005 g/mol Li 30,26 %, O 69,74 %, |
||
| Propriétés physiques | |||
| T° fusion | décomposition à 340 °C | ||
| Solubilité | réaction exothermique avec de l'eau |
||
| Masse volumique | 2,36 g·cm-3 | ||
| Précautions | |||
| Directive 67/548/EEC | |||
 C  O |
|||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Préparation
On le prépare industriellement en faisant réagir de l'hydroxyde de lithium LiOH et du peroxyde d'hydrogène H2O2 puis en déshydratant l'hydroperoxyde intermédiaire :
- LiOH•H2O + H2O2 → LiOOH•H2O + H2O
- 2 LiOOH•H2O → Li2O2 + H2O2 + 2 H2O
Utilisation
Le peroxyde de lithium absorbe le dioxyde de carbone mais il reste cher. Son avantage est qu'il est léger, il est donc utilisé dans les applications où le poids est un facteur important, typiquement dans l'astronautique, d'autant qu'il libère du dioxygène lorsqu'il fixe le dioxyde de carbone :
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2
Précautions d'emploi
Le peroxyde de lithium réagit avec l'eau, les agents réducteurs, les matières organiques, les oxydes métalliques et les sels.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.