Bromure de phénylmagnésium
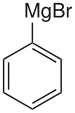
Le bromure de phénylmagnésium est un composé chimique de formule C6H5MgBr. Cet halogénure organomagnésien, analogue bromé du chlorure de phénylmagnésium, est un réactif de Grignard dérivé du benzène disponible dans le commerce, généralement dissous dans l'éther diéthylique ou dans le THF. Il est utilisé en synthèse organique pour introduire le synthon phényle « Ph– ».
| Bromure de phénylmagnésium | |||
 Structure du bromure de phénylmagnésium |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | bromo(phényl)magnésium | ||
| Synonymes |
bromophénylmagnésium |
||
| No CAS | |||
| No ECHA | 100.002.607 | ||
| No CE | 202-867-2 | ||
| PubChem | 66852 | ||
| ChEBI | 51238 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H5BrMg |
||
| Masse molaire[1] | 181,313 ± 0,007 g/mol C 39,75 %, H 2,78 %, Br 44,07 %, Mg 13,41 %, |
||
| Précautions | |||
| SGH[2] | |||
   Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le bromure de phénylmagnésium peut être préparé au laboratoire en versant du bromobenzène C6H5Br sur du magnésium métallique, généralement sous forme de copeaux, dans de l'éther diéthylique (C2H5)2O anhydre. Dès que la réaction s'amorce, l'éther se colore en gris-violet et la solution s'échauffe jusqu'à ébullition au fur et à mesure que l'on verse du bromobenzène. La présence persistante d'oxyde de magnésium MgO tend à inhiber fortement la réaction, ce qu'on évite en ajoutant d'emblée quelques cristaux de diiode I2.
Le bromure de phénylmagnésium obtenu n'est pas purifié mais, comme le sont généralement les réactifs de Grignard, est utilisé en solution. On utilise des solvants aprotiques — car les alcools et l'eau contiennent des protons acides qui réagissent avec le soluté pour donner du benzène C6H6 — et complexants, tels que le tétrahydrofurane (THF) afin de solvater l'atome de magnésium. Les solvants carbonylés tels que l'acétone CH3COCH3 et l'acétate d'éthyle CH3COOCH2CH3 sont incompatibles avec ce soluté.
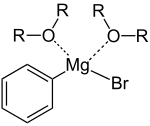
La structure du bromure de phénylmagnésium en solution est plus complexe que ne le laisse penser la formule C6H5MgBr, car l'atome de magnésium forme un adduit avec deux atomes d'oxygène de deux molécules de solvant, éther diéthylique (C2H5)2O ou THF (CH2)4O par exemple. L'atome de magnésium est ainsi à géométrie tétraédrique et sa configuration électronique respecte la règle de l'octet. La longueur de la liaison Mg–O est de 201 pm et 206 pm, celle de la liaison Mg–C vaut 220 pm et celle de la liaison Mg–Br vaut 244 pm[3].
Le bromure de phénylmagnésium est un nucléophile fort en même temps d'une base forte. Il est capable d'absorber des protons même relativement acides. Il forme généralement des composés d'addition avec les carbonyles tels que les cétones et les aldéhydes. Il réagit avec le dioxyde de carbone CO2 pour donner de l'acide benzoïque C6H5COOH.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Galen D. Stucky et R. E. Rundle, « The Structure of Phenylmagnesium Bromide Dietherate and the Nature of Grignard Reagents », Journal of the American Chemical Society, vol. 85, no 7, , p. 1002-1003 (lire en ligne) DOI 10.1021/ja00890a039