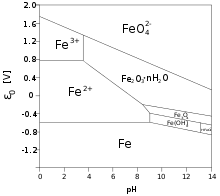
Diagramme de Pourbaix
Un diagramme de Pourbaix, ou diagramme potentiel-pH (ou E-pH), indique sur un plan E/pH les domaines d'existence ou de prédominance des différentes formes (ions, complexe, précipité, métal) d'un élément chimique. Ces diagrammes reposent essentiellement sur l'équation de Nernst et permettent de comprendre comment les propriétés d'oxydoréduction d'un couple peuvent être modifiées par un changement d'acidité du milieu. Ils peuvent faire apparaître le domaine de stabilité de l'eau. Ils furent initialement développés par Marcel Pourbaix en 1938.
Conventions
Pour tracer les courbes présentes sur les diagrammes, on considère que :
- Activité et concentration sont égales pour les espèces en solution ;
- La température est prise égale à 25 °C.
Au niveau de la courbe, on a alors les propriétés suivantes :
- sur la courbe, la concentration totale dissoute pour un élément donné est fixée. On peut donc trouver sur un diagramme un réseau de courbes, chaque courbe correspondant à une concentration donnée. Dans le domaine de la corrosion, on considère généralement par convention qu'un métal M se corrode si [Mn+] > 1 × 10−6 mol L−1. On ne trouve alors qu'une série de courbes correspondant à une concentration dissoute égale à 1 × 10−6 mol L−1 ;
- toujours au niveau de la courbe, il y a égalité des concentrations des espèces oxydée et réduite.
Structure des diagrammes de Pourbaix

Les diagrammes de Pourbaix se présentent avec en abscisse le pH (généralement de –1 à 15) et en ordonnée le potentiel de la solution considérée. Ce potentiel est le plus souvent donné par rapport à l'électrode normale à hydrogène.
Les domaines du haut du diagramme sont ceux des formes les plus oxydées de l'élément. Sur l'exemple de l'arsenic, les différentes formes de As(V) sont au-dessus de celles de As(III) elles-mêmes au-dessus de As(0).
À gauche apparaissent les domaines de prédominance des formes les plus acides comme H3AsO4 pour As(V) et H3AsO3 pour As(III). Puis, de la gauche vers la droite, apparaissent les formes de moins en moins acides H2AsO4−, HAsO42− et AsO43−.
Il est parfois judicieux de faire apparaître le domaine de stabilité du solvant, qui se traduit par deux droites de pente négative :
- la droite E = –0,06 pH (pour le couple de réduction de l'eau H+/H2 ;
- la droite E = 1,23-0,06 pH pour le couple d'oxydation de l'eau O2/H2O.
Au-dessus de ce domaine, les espèces présentes sont susceptibles d'oxyder l'eau, et en dessous elles sont susceptibles de la réduire.
Diagramme des oxydes
Certains diagrammes de Pourbaix peuvent faire apparaître les oxydes d'un métal et non ses ions et ses hydroxydes. Les hydroxydes sont en effet parfois notés comme des hydrates d'oxydes (par exemple, l'hydroxyde de cuivre(II) Cu(OH)2 peut être noté CuO, H2O.
Limites
- Les diagrammes de Pourbaix sont construits à partir de données thermodynamiques : ils n'apportent donc aucune donnée quant à la vitesse des réactions de transformation qu'ils peuvent indiquer. Par exemple, lorsqu'on utilise le diagramme de Pourbaix d'un métal pour prévoir sa stabilité dans différents milieux, même si on se situe dans un domaine où le métal est censé se corroder, cela ne nous indique rien sur la vitesse de cette corrosion. Elle peut en fait être très lente.
- Les diagrammes de Pourbaix dépendent fortement de la concentration en élément chimique et légèrement de la température.
- La grande majorité des diagrammes de Pourbaix disponibles dans la littérature ne tiennent compte que de la formation d'ions simples ou d'oxydes. On se rappellera donc, lorsqu'on souhaite les utiliser pour prévoir la durabilité d'un métal, qu'ils ne tiennent donc pas compte de l'éventuel présence de complexants dans l'environnant.
Généralisation
Les diagrammes potentiel-pH sont des cas particuliers de diagramme potentiel-pL (L pour ligand) pour lesquels la grandeur en abscisse n'est pas –log[H+] mais –log[ligand]. De tels diagrammes donnent (comme les diagramme potentiel-pH) les zones de stabilité des différents complexes ou d'existence des différents précipités qu'un métal forme avec un ligand.
Voir aussi
Bibliographie
- M. Pourbaix, Atlas d'équilibres électrochimiques, Gauthier-Villars, paris, 1963.