Hypobromite
L'ion hypobromite est une espèce chimique de formule BrO−. Cet oxyanion, dans lequel le brome est à l'état d'oxydation +1, est la base conjuguée de l'acide hypobromeux HBrO. C'est un analogue structurel de l'ion hypochlorite ClO− possédant des propriétés semblables à ce dernier, notamment antiseptiques et parasiticides, aussi bien en milieu industriel que dans l'organisme humain au sein de certains leucocytes du système immunitaire.
| Hypobromite | |
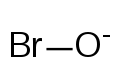  Structure de l'ion hypobromite |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 5460626 |
| ChEBI | 29250 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | BrO− |
| Masse molaire[1] | 95,903 ± 0,001 g/mol Br 83,32 %, O 16,68 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir des sels d'hypobromite en traitant du brome Br2 avec une solution aqueuse alcaline, par exemple d'hydroxyde de sodium NaOH ou d'hydroxyde de potassium KOH. À 20 °C, la réaction est rapide :
Dans cette réaction, le brome Br2 (état d'oxydation 0) se dismute en bromure Br− (état d'oxydation -1) et en hypobromite BrO− (état d'oxydation +1). L'hypobromite de sodium NaBrO peut être isolé sous la forme d'un solide orange.
Une réaction secondaire survient rapidement à 20 °C, plus lentement à 0 °C, dans laquelle l'hypobromite se dismute spontanément en bromure Br− (état d'oxydation -1) et bromate BrO3− (état d'oxydation +5) :
Ces deux réactions peuvent donc être contrôlées par la température, ce qui permet de choisir les composés qu'on souhaite former. L'hypobromite est thermodynamiquement instable à toutes les valeurs de pH mais est cinétiquement stabilisée par rapport à sa dismutation en bromure et bromate au-dessus du pKa de l'acide hypobromeux HBrO.
Les bromures absorbés par l'alimentation, qui sont présents naturellement dans le sang, sont utilisés par les granulocytes éosinophiles, une variété de leucocytes spécialisée dans la protection contre les parasites multicellulaires. Ces cellules produisent des ions hypobromite à partir de bromure et de peroxyde d'hydrogène H2O2 sous l'action d'une éosinophile peroxydase, qui utilise les bromures plutôt que les chlorures à cet effet[2] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A. N. Mayeno, A. J. Curran, R. L. Roberts et C. S. Foote, « Eosinophils preferentially use bromide to generate halogenating agents », Journal of Biological Chemistry, vol. 264, no 10, , p. 5660-5668 (PMID 2538427, lire en ligne)