Recristallisation (chimie)
La recristallisation est, en chimie, une méthode de purification qui repose sur la différence de solubilité entre le composé à purifier et ses impuretés dans un solvant donné. La solubilité augmentant généralement avec la température, on dissout habituellement le composé dans le minimum de solvant porté à ébullition[1].
Généralement on dispose d'un composé A contaminé par une petite quantité d'impureté B[2].
Recristallisation avec un seul solvant
Principe
Les composés solides obtenus par synthèse organique ou extraits de substances naturelles sont souvent contaminés par de faibles quantités d'impuretés. La technique habituelle de leur purification est la recristallisation, fondée sur leur différence de solubilité à chaud et à froid dans des solvants. La solubilité d'un solide augmente généralement avec la température ; aussi, lorsqu'il est solubilisé dans un solvant chaud, sa cristallisation peut être provoquée par le refroidissement de la solution jusqu'à sa sursaturation. La recristallisation consiste donc à la mise en solution du solide à purifier dans un solvant ou dans un mélange de plusieurs solvants, généralement à l'ébullition, puis au refroidissement de la solution, ce qui entraîne la cristallisation du solide, isolé ensuite par filtration. On peut également reconcentrer le soluté jusqu'à précipitation par évaporation du solvant.
Le produit organique synthétisé contient une certaine teneur en impuretés. Si l'on regarde un diagramme de phase binaire typique, représentant le produit pur et l'impureté, on voit que lors de la précipitation, le premier cristal formé a une teneur plus faible en impureté que le produit initial ; l'impureté est rejetée dans le solvant[3].
Protocole
Généralement, on procède suivant les étapes suivantes :
- le mélange du composé A et l'impureté B sont dissous dans la plus petite quantité de solvant chaud pour bien dissoudre le mélange, apportant ainsi une solution saturée ;
- la solution est ensuite laissée à refroidir ;
- comme la solution refroidit, la solubilité des composés diminue dans les gouttes de solution. Finalement seul reste le composé désiré...
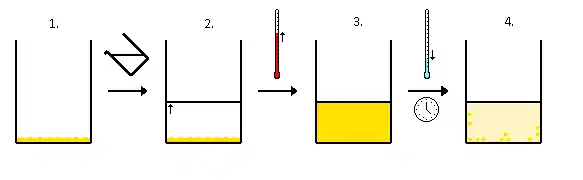
- 1. Solvant ajouté (clair) au composé (orange)
- 2. Chauffage du solvant qui donne une solution composé (orange)
- 3. Solution saturée en composé (orange), on la laisse refroidir
- 4. Ce qui donne des cristaux (orange) et une solution saturée (orange pâle)
Voir aussi
- Pour la partie thermodynamique du procédé, Solidification > Solidification à l'équilibre.
Références
- en:Recrystallization (chemistry)
- Eddy Flamand, Jacques Bilodeau, Chimie organique expérience de laboratoire, Griffon, p.5