Tétrathionate
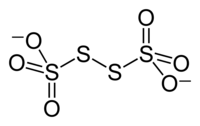
L'ion tétrathionate est un anion de formule S4O62−. C'est un oxoanion du soufre dérivé de l'acide tétrathionique, H2S4O6. Il appartient à la famille des polythionates, anions de formule [Sn(SO3)2]2−. Sa formule peut également s'écrire −O3S-S-S-SO3−. Deux des atomes de soufre présents dans l'ion sont au nombre d'oxydation 0 et les deux autres sont au nombre +V. L'ion tétrathionate est la forme oxydée du couple redox S4O62−/S2O32−.
Obtention
L'ion tétrathionate a historiquement été obtenu par John Dalton en 1808 en faisant réagir le dioxyde de soufre SO2 avec une solution de sulfure d'hydrogène H2S. Cet ion est formé pendant les titrages iodométriques suivant l'équation :
- 2 S2O32− + I2 → S4O62− + 2 I−
L'iode moléculaire (I2) peut être remplacé par d'autres oxydants doux tels que Cu(II), S2O82− ou H2O2.
L'ion tétrathionate peut également être formé lors de la réaction de S2Cl2 avec l'ion hydrogénosulfite HSO3−.
Ses sels de sodium, de potassium ou de baryum sont les plus courants[1].
Structure
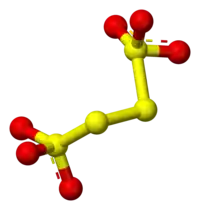
La structure du tétrathionate peut être vue comme appartenant à un parallélépipède dont trois atomes de soufre seraient les sommets (voir figure ci-dessous). La figure montrée est la structure présente dans le BaS4O6·2H2O et Na2S4O6·2H2O. Les polysulfures ont fréquemment une structure présentant des angles approchant de 90° entre les atomes de soufre. 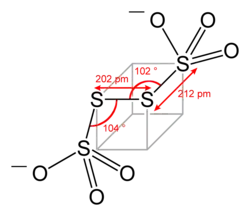
Notes et références
- N.N. Greenwood et A. Earnshaw (2003). Chemistry of the elements. 2nd Ed. Elsevier. p.717.
- La première ébauche de cet article était une traduction partielle de la page en anglais.