Bisulfite
Un bisulfite est un composé chimique contenant l'anion bisulfite, ou hydrogénosulfite selon l'appellation recommandée par l'IUPAC, de formule brute HSO3−. Le bisulfite de sodium NaHSO3 est un exemple de bisulfite. Il ne doit pas être confondu avec l'ion disulfite[1] de formule S2O52−.

Propriétés chimiques
Les bisulfites sont généralement préparés en traitant des solutions alcalines avec un excès de dioxyde de soufre SO2 :
L'anion HSO3− est la base conjuguée (pKa = 1.81) de l'acide sulfureux H2SO3 :
L'acide sulfureux ne peut être isolé à l'état pur et ne semble pas non plus exister en solution, de sorte que l'équilibre le plus cohérent avec les mesures spectroscopiques serait :
HSO3− est une espèce chimique faiblement acide, avec un pKa de 6,97 ; sa base conjuguée est l'ion sulfite SO32− :
Les bisulfites sont des agents réducteurs, comme le sont les sulfites et le dioxyde de soufre, qui contiennent tous du soufre à l'état d'oxydation +4.
Structure
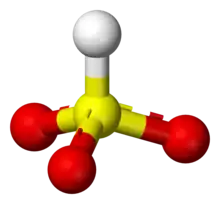
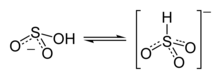
La plupart des mesures suggèrent que l'hydrogène de l'ion bisulfite est lié à l'atome de soufre, donnant lieu à une symétrie C3v, établie par diffractométrie de rayons X et, en solution aqueuse, par spectroscopie Raman (ν(S–H) = 2 500 cm−1). Certaines mesures de spectroscopie RMN à l'oxygène 17 suggèrent cependant l'existence de deux tautomères de HSO3 en équilibre dynamique, le premier à symétrie C3v (liaison H–S), le second à symétrie Cs (liaison H–O)[2].
Utilisation
Le bisulfite est utilisé dans le secteur médical. Il est un excipient de l'épinéphrine pour éviter une oxydation de l'épinéphrine qui la rendrait inactive. En revanche le bisulfite peut provoquer des réactions allergènes.
Notes et références
- Red book 2005 de l'IUPAC, p.130.
- (en) D. A. Horner et R. E. Connick, dans Inorg. Chem. 25, 2414-7 (1986).
